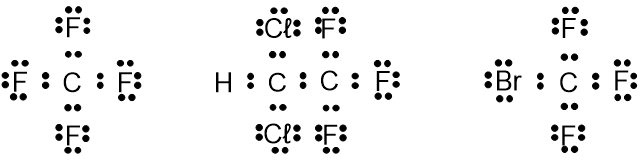
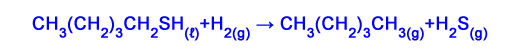أسئلة من امتحانات البچروت في موضوع المبنى والترابط
لقد جمعنا لكم جميع الأسئلة من امتحانات البچروت ابتداءً من عام 2007 في ملف PDF يمكن تنزيله. تمّت مُلاءَمة الأسئلة لتتوافق مع التغييرات التي طرأت على منهج التعلّم منذ عام 2007 وحتى يومنا هذا.
حلول الأسئلة متوفّرة أيضًا على الموقع للمشتركين في الموقع فقط.
مُقترح حلّ لامتحانات البچروت – المبنى والترابط
سؤال 1 بند أ
الإجابة 2.
عندما يتعلق الأمر بالمركّبات التي أساسها الكربون والهيدروجين، فكلّما كان عدد الذرّات في الجُزَيء أكبر، أصبح عدد الإيزوميرات للمادّة أكبر. عندما يكون عدد الذرّات الكلّيّ متساويًا (الإجابات 2 و- 4)، كلما زاد عدد أنواع الذرّات، أصبح عدد الإيزوميرات أكبر. أفضل طريقة لتحديد أيّ الصِيغ الجُزَيئيّة لها عدد أكبر من الإيزوميرات هي رسم جميع الإمكانيات، وهو أمر غير مطلوب في المنهاج التعليميّ.
سؤال 2 مقال
- א
- بين جُزَيئات المادّة A توجد تأثيرات متبادلة ڤان در ڤالس الناتجة عن حركة سحابة الإلكترونات في الجُزَيء، مما يؤدي إلى تكوّن قطبيّة لحظيّة ودائمة داخل الجُزَيء. كما وتوجد أربطة هيدروجينيّة لأنّ في جُزَيء A توجد ذرّة هيدروجين مكشوفة من الإلكترونات، والتي تنجذب إلى زوج من الإلكترونات لذرّة أكسجين في جُزَيء مجاور.
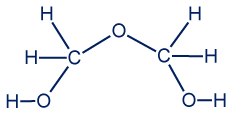 هناك إمكانيّات أخرى.
هناك إمكانيّات أخرى.
- (هذا البند تابع لفصل الحِسابات الكيميائيّة)
- ג
- بحسب الرسم البيانيّ المُعطى، تبدأ النجاعة في الانخفاض بعد 3-4 أسابيع.
- يصبح جهاز الترشيح/التصفية غير فعّال بعد ثمانية أسابيع تقريبًا.
- ד
- التأثيرات المتبادلة ڤان در ڤالس.
- تتكوّن أربطة هيدروجينيّة بين المجموعات وجُزَيئات الماء. في كلّ من المجموعة الكحوليّة وجُزَيء الماء، هناك ذرّة هيدروجين مكشوفة من الإلكترونات تنجذب إلى زوج من الإلكترونات لذرّة أكسجين في جُزَيء مجاور.
- رسم 3
- ה
- المادّة C.
- المادّة B غير مناسبة إذ أنّها تحتوي على طرفين هيدروفيليّين، بينما المادّة D غير مناسبة لأنها لا تحتوي على طرف هيدروفيليّ إطلاقًا.
سؤال 3
- *الاختلاف ناتج عن تأثير الذرّات المرتبطة بذرّات الكربون في الرابط C-C المشار إليه بالرقم 2. إحدى ذرّات الكربون مرتبطة بذرّة أكسجين ذات سالبيّة كهربائيّة عالية، ولذلك تتكوّن عليها شحنة جُزئيّة موجبة أكثر مقارنةً بذرّة الكربون الأخرى في الرابط ذاته، التي ترتبط مع ذرّتيّ هيدروجين لهما سالبيّة كهربائيّة أقلّ من ذرّة الكربون. (ذرّتا الكربون مرتبطتان أيضًا بكربون آخر، لكن هذا لا يؤثّر على الشحنة الجُزئيّة التي تحملها ذرّة الكربون في الرابط 2).
أما في الرابط 1، فإنّ كلّ ذرّة كربون مرتبطة بذرّتيّ هيدروجين وذرّة كربون أخرى، ولذلك تكون الشحنة الجُزئيّة عليها متماثلة. - لكتابة الصيغة الجُزَيئيّة لفيتامين C، من الأفضل أولاً كتابة التمثيل الكامل للصيغة البنائيّة لفيتامين C.
الصيغة الجُزَيئيّة هي: C6H8O6. - ג
- فيتامين C هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة (في عدّة مراكز). بين جُزَيئات الماء توجد أربطة هيدروجينيّة، ولذلك تتشكّل أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات فيتامين C، مما يجعله يذوب في الماء.
بين جزيئات فيتامين D أيضًا، توجد تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة، ولكن الجزء الهيدروفيليّ (الذي يسمح بتكوين روابط هيدروجينيّة) صغير جدًا، في حين أن الجزء الهيدروفوبيّ (الذي يسمح بتكوين تأثيرات متبادلة ڤان در ڤالس) كبير جدًا. لذلك، لا يمكن تكوين أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات فيتامين D. (جُزَيئات الماء غير قادرة على التغلغل بين جُزَيئات فيتامين D / تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات فيتامين D لا تنكسر، ولذلك لا تتكون روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات فيتامين D). - (على الرغم من أنه لم يُذكر بوضوح في امتحان البچروت، إلا أنّ فيتامين C هو مادّة صلبة في درجة حرارة الغرفة).
- فيتامين C هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة (في عدّة مراكز). بين جُزَيئات الماء توجد أربطة هيدروجينيّة، ولذلك تتشكّل أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات فيتامين C، مما يجعله يذوب في الماء.
- ד
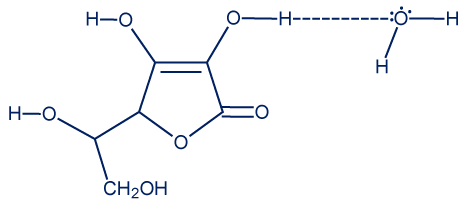
هناك طبعًا العديد من الإمكانيات المختلفة لرسم الرابط الهيدروجينيّ. - الطاقة المطلوبة لتفكيك الرابط المُشار إليه بِنجمة (والذي هو رابط تساهميّ) أكبر من الطاقة المطلوبة لتفكيك الرابط الهيدروجينيّ. الرابط التساهميّ هو رابط أقوى من الرابط الهيدروجينيّ. البُعد بين الأنوية وزوج الإلكترونات المرتبطة برابط تساهميّ أصغر، وبالتالي فإنّ قوّة التجاذُب الكهربائيّ بينهما أقوى مقارنةً بقوّة التجاذُب الكهربائيّ التي تنشأ في الرابط الهيدروجينيّ بين ذرّة الهيدروجين المكشوفة من الإلكترونات وزوج الإلكترونات غير الرابط على ذرّة الأكسجين في جُزَيء مجاور.
سؤال 1 بند أ
الإجابة 3
عندما نتحدث عن ذرّات متتالية (أيّ أعدادها الذرّيّة متتالية)، فهذا يعني أنّ العدد الذرّيّ للذرّة Y أكبر بواحد من العدد الذرّي للذرّة X، ولذلك لدى الذرّة Y بروتون واحد أكثر من الذرّة X.
سؤال 1 بند ب
الإجابة 3
عند تكثّف الماء (تحويل الماء من غاز إلى سائل)، تتشكّل روابط هيدروجينيّة بين جُزَيئات الماء.
سؤال 3
انتبهوا: في هذا السؤال تظهر المادّة HCOOH. وهو حامض كربوكسيليّ. في هذه المرحلة، لم نتعلّم بعد أنّ المحلول المائيّ لهذه المادّة يحتوي على أيونات حرّة الحركة، ولكننا سنستعين بهذه المعلومة لحلّ السؤال.
- א
المادّة الجملة المُلائمة لها MgCℓ2 (3) المحلول المائيّ للمادّة موصِل للكهرباء. HCOOH (3) المحلول المائيّ للمادّة موصِل للكهرباء. CH3CH2OH (2) تذوب المادّة في كلّ من الماء والهكسان، C6H14(ℓ). BrCℓ (4) في كلّ واحدة من جُزَيئات المادّة يوجد 52 إلكترونًا. Cu (1) المادّة موصِلة جيدًا للكهرباء في درجة حرارة الغرفة. - المادّة التي تُناسبها الجملة 1 هي مادّة فلزّيّة. في درجة حرارة الغرفة، في مبنى الفلزّ توجد إلكترونات حرّة الحركة، ولذلك الفلزّ موصِل للتيّار الكهربائيّ.
- المادّة التي تُناسبها الجملة 2 هي CH3CH2OH. هي مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. بين جُزَيئات الماء توجد أربطة هيدروجينيّة، لذلك تتكوّن أربطة هيدروجينيّة أيضًا بين جُزَيئات المادّة CH3CH2OH وبين جُزَيئات الماء. (لكلّ من الماء والمادّة CH3CH2OH ذرّة هيدروجين مكشوفة من الإلكترونات، ولذلك ذرّة الهيدروجين المكشوفة من الإلكترونات في جُزَيء الـ CH3CH2OH تنجذب لزوج إلكترونات غير رابط على ذرّة أكسجين في جُزَيء ماء مجاور). بين جُزَيئات الهكسان توجد تأثيرات متبادلة ڤان در ڤالس ولذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الهكسان وجُزَيئات الـ CH3CH2OH.
- الرسم الصحيح هو رسم II.
- يمكن غسله بالماء. حمض الفورميك يذوب في الماء. (لكلا المادّتين أربطة هيدروجينيّة بين الجُزَيئات، ولذلك يمكن أن تتشكّل أربطة هيدروجينيّة بين جُزَيئات حمض الفورميك (HCOOH) وجُزَيئات الماء).
- ד
- في جُزَيء حامض الفورميك لا يوجد رابط نقيّ – رابط بين ذرّتين متماثلتين.
- يُعتبر الرابط C=O أقوى من الرابط C-O. وذلك لأنّ الرابط C=O هو رابط ثُنائيّ بينما الرابط C-O هو رابط أحاديّ. (لهذا السبب التجاذب الكهربائيّ بين الأنوية وإلكتررونات الرابط في الرابط C=O أقوى).
- نصف قُطر ذرّة الأكسجين أصغر من نصف قُطر ذرّة الكربون على الرغم من أنهما يقعان في نفس السطر ولديهما العدد ذاته من مستويات الطاقة المعبّأة بالإلكترونات. ذلك لأنّ ذرّة الأكسجين تحتوي على بروتونات أكثر في النواة، وبالتالي فإن قوّة التجاذُب الكهربائيّ بين النواة والإلكترونات تكون أقوى ونصف القُطر أصغر.
- ה
- نعم.
- لا، في الألكين يوجد رابط مُزدوج بين ذرّات الكربون، لذلك هناك حاجة إلى وجود ذرّتيّ كربون على الأقل.
- نعم.
سؤال 1 بند أ
(عادةً في مثل هذه الأسئلة، يُفضّل وضع العناصر بشكل بيانيّ في قائمة العناصر الدوريّة).
الإجابة: 1.
| VIII | VII | VI | I | ||||
| c | b | a | |||||
| d | |||||||
بما أنّ العنصر b هو هالوجين، فإنّه يقع في العمود السابع، وبالتالي فإنّ العنصر a يقع في العمود السادس. العنصر c هو غاز نبيل/خامل، بينما العنصر d يفتتح سطرًا جديدًا وهو فلزّ قلويّ.
ذرّة c تقع في سطر فوق ذرّة d، ولديها عدد أقلّ من مستويات الطاقة المعبّأة بالإلكترونات مقارنةً بذرّة d، ولذلك فإن نصف قُطرها أصغر.
سؤال 1 بند ب
الإجابة 4 (رسم IV):
تمّ استبعاد الرسم I لأنّ الأيونات الموجبة متقاربة جدًا، وكذلك الأيونات السالبة (هناك تنافر بينهما وليس تجاذب).
تمّ استبعاد الرسم II لأنّه في محلول مائيّ لمادّة أيونيّة، الأيونات الموجبة تنفصل عن الأيونات السالبة، وكل أيون يُحاط بجُزَيئات ماء.
تمّ استبعاد الرسم III لأنّ الأيونات السالبة مُحاطة بجُزَيئات ماء بحيث تكون ذرّة الأوكسجين المشحونة بشحنة جزئية سالبة في جُزَيئات الماء قريبة منها، بينما الأيونات الموجبة مُحاطة بجُزَيئات ماء بحيث تكون ذرّة الهيدروجين المشحونة بشحنة جزئية موجبة قريبة منها، يجب أن يكون الوضع عكسيًا (الموجب ينجذب للسالب والعكس صحيح).
في الرسم IV الأيونات مُحاطة بجُزَيئات الماء. كلّ أيون موجب مُحاط بجُزَيئات ماء حيث تكون ذرّة الأكسجين في جُزَيء الماء المشحونة بشحنة جُزئيّة سالبة قريبة منه. بينما كلّ أيون سالب مُحاط بجُزَيئات ماء حيث تكون ذرّة الأكسجين في جُزَيء الماء المشحونة بشحنة جُزئيّة موجبة قريبه منه.
سؤال 3
- א
- الرسم الصحيح هو رسم II. الرسم I غير صحيح لأنّ زاوية الرابط الهيدروجينيّ ليست 180°.
- بين جُزَيئات حمض السيناميك توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة، ولكن الجزء الهيدروفيليّ (الذي يسمح بتكوين الروابط الهيدروجينيّة) صغير جدًا، بينما الجزء الهيدروفوبيّ (الذي يسمح بتكوين التأثيرات المتبادلة ڤان در ڤالس) كبير جدًا. لذلك، لا يمكن تكوين أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات حمض السيناميك. (جُزَيئات الماء غير قادرة على التغلغل بين جُزَيئات حمض السيناميك / تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات حمض السيناميك لا تنكسر، ولذلك لا تتكون روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات حمض السيناميك).
- ב
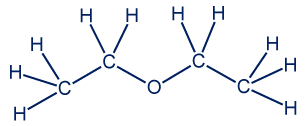
- C4H10O
- طاقة الرابط في رابط 1 C-O أكبر من طاقة الرابط في رابط 2 C-C لأنّ: رابط 1 قطبيّ ورابط 2 ليس قطبيًّا.
في الرابط 1 ذرّة الأكسجين لها نصف قُطر أصغر من ذرّة الكربون في الرابط 2. - ד
- الخطأ الأول هو أنّ الطالب كتب جُزَيئات نترات الأمونيوم. صحيح أنّ نترات الأمونيوم ليست مادّة جُزَيئيّة بل مادّة أيونيّة، لذلك هي لا تتكوّن من جُزَيئات بل من أيونات موجبة وأيونات سالبة. الخطأ الثاني هو أنّ الطالب كتب أنّه توجد أربطة هيدروجينيّة بين جُزَيئات الأمونيوم. صحيح أنّ بين الأيونات التي تُكوّن نترات الأمونيوم لا توجد أربطة هيدروجينيّة بل هناك تجاذُب كهربائيّ بين الأيونات الموجبة والسالبة. (الخطأ الثالث هو أنّ الطالب كتب أنّه تتشكّل أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات نترات الأمونيوم. يصحّ القول بأنّ هناك تجاذُب كهربائيّ يتكوّن بين نترات الأمونيوم وجُزَيئات الماء. الأيونات الموجبة تنجذب كهربائيًّا إلى ذرّات الأكسجين ذات الشحنة الجزئية السالبة في جُزَيئات الماء، والأيونات السالبة تنجذب كهربائيًّا إلى ذرّات الهيدروجين ذات الشحنة الجزئية الموجبة في جُزَيئات الماء).
سؤال 6

- طول الرابط N-H أكبر من طول الرابط O-H لأن نصف قُطر ذرّة الأكسجين (O) أصغر من نصف قُطر ذرّة النيتروجين N (الأكسجين يحتوي على عدد أكبر من البروتونات في النواة). إضافةً لذلك، الرابط O-H أكثر قطبيّة من الرابط N-H، وبالتالي فإنّ الشحنات الجُزئيّة على الذرّات في الرابط تكون أكبر، التجاذُب الكهربائيّ بينها أقوى، وبالتالي يكون طول الرابط أصغر.
- المادّتان – فوق أكسيد الهيدروجين والهيدرازين – هما مادّتان جُزَيئيّتا توجد بين جُزَيئاتهما روابط هيدروجينيّة. الرابط O-H في جُزًيء فوق أكسيد الهيدروجين أكثر قطبيّة من الرابط N-H في جُزَيء الهيدرازين، ولذلك فإنّ ذرّة الهيدروجين في الرابط O-H تكون مكشوفة من الإلكترونات أكثر، والشحنة الجُزئيّة الموجبة عليها أكبر مقارنةً بالشحنة الجُزئيّة الموجبة على ذرّة الهيدروجين في الرابط N-H. بناءً على ذلك، فإن التجاذُب الكهربائيّ لذرّة الهيدروجين في رابط O-H وزوج الإلكترونات غير الرابط في جُزَيء مجاور أقوى. بكلمات أخرى، الروابط الهيدروجينيّة التي تتشكل بين جُزَيئات فوق أكسيد الهيدروجين أقوى، ولذلك نحتاج لطاقة أكبر لتفكيك الروابط الهيدروجينيّة بين جُزَيئات فوق أكسيد الهيدروجين، ودرجة غليان فوق أكسيد الهيدروجين أعلى من درجة غليان الهيدرازين.
سؤال 1 بند أ
الإجابة: 4.
الذرّتان f و-g هما نظيران يختلفان عن بعضهما البعض في عدد النيترونات، هذا الأمر لا يؤثّر على نصف قُطر الذرّة.
سؤال 1 بند ب
الإجابة: 1.
سؤال 3
- א
- اليود الصلب يتكون من جُزَيئات (ثُنائيّة الذرّة) من اليود I2 في مبنى شبكة جُزَيئيّ. بين جُزَيئات اليود توجد تأثيرات متبادلة ڤان در ڤالس، للجُزَيئات حركة ذبذبة فقفط، والمبنى ذو ترتيب وكثافة عالية.
- يوديد البوتاسيوم الصلب يتكوّن من أيونات بوتاسيوم K+ وأيونات يود I–. في مبنى الشبكة الأيونيّة، حيث تكون الأيونات الموجبة مُحاطة بالأيونات السالبة والعكس صحيح، وبينها يوجد تجاذُب كهربائيّ (رابط أيونيّ)، تقوم الأيونات بحركات ذبذبة فقط، والمبنى مرتّب ومُتراصّ/كثيف.
- ב
- بين جُزَيئات اليود وجُزَيئات الإيثانول توجد تأثيرات متبادلة ڤان در ڤالس.
بين جُزَيئات الإيثانول نفسها توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة، وبين جُزَيئات اليود (قليلة جدًا) ستكون تأثيرات متبادلة ڤان در ڤالس.
- بين جُزَيئات اليود وجُزَيئات الإيثانول توجد تأثيرات متبادلة ڤان در ڤالس.
- ג

- للجُزَيء ثنائيّ قطب دائم وهناك عدم تماثُل في سحابة الإلكترونات (لا يوجد مبنى مُتماثل للجُزَيء).
- ד
- اليودوفورم هو مادّة جُزَيئيّة، توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة. لا تتكوّن أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس بين جُزَيئات اليودوفورم والماء، ولذلك اليودوفورم لا يذوب في الماء.
- يذوب الأستون في الماء لأنّ ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيئات الماء تنجذب إلى زوج الإلكترونات في ذرّة الأكسجين في جُزَيء الأسيتون المجاور لها، وبالتالي تتشكّل أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات الأستون، مما يجعل الأستون يذوب في الماء.
سؤال 1 بند أ
الإجابة 2.
سؤال 1 بند ب
الإجابة: 4.
الرابط C-C أطول لأنّه رابط أحاديّ، بينما الروابط الأخرى هي روابط مُزدوجة/ثُنائيّة.
الرابط C=O أقصر من الرابط C=C لأنّ الرابط C=O قطبيّ، بينما الرابط C=C ليس قطبيًّا ونصف قُطر ذرّة الأكسجين O أصغر من نصف قُطر ذرّة الكربون C، إذ أنّ ذرّة الأكسجين تحتوي عدد أكبر من البروتونات في النواة (لكليهما نفس عدد مستويات الطاقة المعبّأة بالإلكترونات).
سؤال 3
* في هذا السؤال تظهر مادّة بروميد الهيدروجين HBr. هذه المادّة من الحوامض، وعند التلامُس مع الماء تتفاعل مع الماء وتتكوّن أيونات حرّة الحركة في المحلول (سنتعلم عن هذا الموضوع في فصل الحوامض والقواعد فيما بعد). للإجابة على هذا السؤال، سنعتمد على حقيقة أنّ المحلول المائيّ لبروميد الهيدروجين موصِل للتيّار الكهربائيّ لأنّه يحتوي على أيونات حرّة الحركة.
المادّة رقم الجملة المُلائمة للمادّة (I – IV) الحرف الذي يرمز إلى الرسم المناسب للمادّة.
(a – d)حالة المادة كما هو موضّح في الرسم بروم III b سائلة بروميد الهيدروجين II d غازيّة چرافيت IV c صلبة فضّة I a صلبة - ב

- نصف قُطر ذرّة الهيدروجين H أصغر من نصف قُطر ذرّة البروم Br.
الرابط بين الهيدروجين والبروم في جُزَيء HBr قطبيّ، بينما الرابط بين ذرّات البروم في جُزَيء Br₂ هو ليس قطبيًّا.
- ג
- (غير ضروريّ في هذه المرحلة، فقط بعد فصل الحوامض والقواعد)
الصياغة هي:HBr(g) + H2O(ℓ) → H3O+(aq) + Br–(aq)
- المحلول موصلٌ للتيّار الكهربائيّ لأنّه يحتوي على أيونات مٌتنقّلة.
- (غير ضروريّ في هذه المرحلة، فقط بعد فصل الحوامض والقواعد)
- ד
- المادّة التي تنطبق عليها الجملة I هي مادّة فلزّيّة عند تشغيل قوّة خارجيّة على الفلزّ. طبقات الكاتيونات تتحرّك ولكن قوّة التجاذُب الكهربائيّ بين الكاتيونات والإلكترونات لا تزال قائمة (موجودة)، لذلك المبنى لا يتفكك تمامًا بل يغيّر صورته الخارجيّة فقط.
- المادّة c هي چرافيت. الچرافيت مكوّن من طبقات، وفي كلّ طبقة توجد ذرّات كربون مرتبطة بثلاث روابط تساهميّة مع ذرّات كربون أخرى. لكلّ ذرّة كربون يبقى إلكترون واحد غير مُزدوَج. جميع الإلكترونات غير المُزدوَجة غير مُتمركزة وتتحرّك بحريّة في الطبقة، ولذلك الچرافيت موصِل للكهرباء (لأنّ الچرافيت يحتوي على إلكترونات حرّة الحركة).
سؤال 4
- א

- الفرق الأوّل هو أنّه في الحالة الغازيّة، تتمتّع الجُزَيئات بحركة ذبذبة، دوران وإزاحة، بينما في الحالة السائلة تتمتّع الجزيئات بحركة دورانيّة وذبذبة.
في الحالة الغازيّة، تكون الجُزَيئات بعيدةً عن بعضها البعض (كثافة منخفضة جدًا)، بينما في الحالة السائلة تكون الجُزَيئات أقرب إلى بعضها البعض. (يمكن اعتبار القوى بين الجزيئات في الحالة الغازيّة كقوّة تجاذُب ضعيفة جدًا، بينما في الحالة السائلة كقوّة تجاذُب أقوى بين الجُزَيئات).
- ב
- الجملة غير صحيحة. ذرّات الكلور في الجُزَيء المُعطى مرتبطة بذرّة كربون برابط تساهميّ. لأنّ لذرّة الكربون سالبيّة كهربائيّة أقلّ من ذرّة الكلور، فإنّ ذرّات الكلور تحمل شحنة جُزئيّة سالبة وليس شحنة جُزئيّة موجبة.
- جملة صحيحة. المادّتان المعطاتان هما موادّ جُزَيئيّة، توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. بما أنّ سحابة الإلكترونات في الـ CCℓ2F2 أكبر من سحابة الإلكترونات في الـ CHCℓF2 يمكننا أن نقول أنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ CCℓ2F2 أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ CHCℓF2.
- ג
- C-C رابط نقيّ
C-Cℓ رابط قطبيّ
C-F رابط قطبيّ - الرابط C-C أطول لسبَبين:
- الرابط C-C هو رابط تساهميّ وليس قطبيًّا، بينما الرابط C-F هو قطبيّ.
- نصف قُطر ذرّة الـ F أصغر من نصف قُطر ذرّة الـ C.
- إيزومر المُركّب CCℓF2CCℓF2 هو المُركّب CF3CCℓ2F، لأنّ المادّتين لهما الصيغة الجُزّيئيّة ذاتها ولكن صيغة بنائيّة مختلفة.
- C-C رابط نقيّ
- ד
- الفريون CCℓ2F2(g) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. الزيت المعدنيّ C18H38(ℓ) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس، ولذلك عند خَلط الموادّ تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الـ CCℓ2F2(g) وبين جُزَيئات الـ C18H38(ℓ) ولذلك الفريون يذوب في الزيت المعدنيّ.
سؤال 1 بند أ
الإجابة 4.
بما أنّ ذرّة العنصر c تحتوي على إلكترون تكافؤ واحد، فهو يقع في العمود الأول، وبالتالي فإنّ العنصر d يقع في العمود الثاني. العنصر b يكون في سطر فوقه في العمود الثاني، بينما العنصر a يتواجد في نفس السطر مع العنصر b ولكن في العمود السابع.
| VIII | VII | II | I | |||||
| b | a | |||||||
| d | c | |||||||
العنصر d في العمود الثاني هو فلزّ. أيون الفلزّ d يحمل شحنة 2+. شحنة أيون ذرّة النيتروجين N هي 3-، ولذلك الصيغة الأمبيريّة التي ستنتج بينهما ستكون d3N2.
سؤال 1 بند ب
الإجابة 3
البوتاسيوم يحتوي على عدد أكبر من مستويات الطاقة المعبّأة بالإلكترونات مقارنةً بالكلور أو الأرغون، وبالتالي فإن البُعد بين النواة وإلكترونات التكافؤ يكون أكبر، هذا يؤدي إلى تقليل قوّة التجاذُب الكهربائيّ بين النواة وإلكترونات التكافؤ، وبالتالي يتطلّب الأمر طاقة أقلّ لإخراج الإلكترون.
سؤال 1 بند ج
الإجابة 2.
![]()
سؤال 1 بند د
الإجابة 4.
المحاليل II و-III موصِلة للتيّار الكهربائيّ لأنّ الموادّ المُذابة بها هي أيونات، وفي محاليلها توجد أيونات مُميّاة حرّة الحركة.
سؤال 3
- א
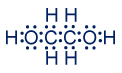
- الصيغة الجُزَيئيّة للإيثيلين غليكول هي C2H6O2.
الصيغة الجُزَيئيّة للبوتان هي C4H10.
- ב
- بين جُزَيئات الإيثيلين غليكول توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس.
بين جُزَيئات البوتان توجد تأثيرات متبادلة ڤان در ڤالس.
الأربطة الهيدروجينيّة بين جُزَيئات الإيثيلين غليكول أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات البوتان، ولذلك نحتاج إلى طاقة أكبر لتفكيك الأربطة الهيدروجينيّة بين جُزَيئات الإيثيلين غليكول، ودرجة غليانه أعلى. - الإيثيلين غليكول في درجة حرارة 25°C- هو صلب، وبينما الإيثيلين غليكول في درجة حرارة 250°C هو غاز.
في الحالة الصلبة توجد للجُزَيئات حركة ذبذبة فقط، بينما في الحالة الغازيّة تتمتّع الجُزَيئات بحركة ذبذبة، دوران وإزاحة.
في الحالة الصلبة، تكون الجُزَيئات أكثر كثافة مقارنة بالحالة الغازيّة (قوى التجاذُب بين الجُزَيئات في الحالة الصلبة أقوى من قوى التجاذُب بين الجُزَيئات في الحالة الغازيّة).
- بين جُزَيئات الإيثيلين غليكول توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس.
- ג
- البوتان هو مادة جزيئية توجد بين جزيئاتها تأثيرات متبادلة ڤان در ڤالس.
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة. لا تتكوّن أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الماء وجُزَيئات البوتان، ولذلك البوتان لا يذوب في الماء.
- البوتان هو مادة جزيئية توجد بين جزيئاتها تأثيرات متبادلة ڤان در ڤالس.
- أكسيد الإيثيلين هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس ضعيفة لأنّ سحابة الإلكترونات الخاصّة بها صغيرة نسبيًا. في درجة حرارة الغرفة يوجد ما يكفي من الطاقة لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات أكسيد الإيثيلين، ولذلك يتحوّل إلى غاز.
سؤال 4
سنتعلّم عن البند “أ” من هذا السؤال في فصل الأكسدة والاختزال فلا حاجة للإجابة عليه الآن.
- א
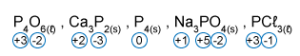
- نطاق درجات أكسدة الفوسفور يترواح بين قيمة دُنيا 3- وحتى قيمة قصوى 5+.
في المُركّب P4O6 ، كما رأينا، درجة أكسدة الفوسفور هي 3+. هذه درجة تأكسد متوسطة، ولذلك يمكن لذرّات الفوسفور أن تعمل كمختزٍل وأيضًا كمؤكسِد، أي يمكنها أن تستقبل وتمنح الإلكترونات.
في المُركّب Ca3P2 ، كما رأينا، درجة تأكسد الفوسفور هي 3-. هذه أدنى درجة تأكسد، ولذلك يمكن لذرّات الفوسفور أن تعمل كمختزِل فقط، أي أن تمنح إلكترونات.
- رسم II.
- ג

- لجُزَيء PCℓ3 ثنائيّ تقاطُب دائم.
- ד
- يحتوي المحلول على أيونات Na+(aq) وأيونات PO43-(aq) وجُزَيئات ماء. أيونات الـ Na+(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الهيدروجين ذات الشحنة الجُزئيّة السالبة تتجاذب كهربائيًّا إلى أيونات الـ Na+(aq).
أيونات الـ PO43-(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الهيدروجين ذات الشحنة الجُزئيّة الموجبة تتجاذب كهربائيًّا إلى أيونات الـ PO43-(aq).
بين جُزَيئات الماء (المُذيب) توجد أربطة هيدروجينيّة. الرابط الهيدروجينيّ يتكوّن بين ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء ماء واحد وزوج إلكترونات غير رابط لذرّة أوكسجين في جُزَيء ماء مجاور.
للجُسَيمات في المحلول حركة ذبذبة ودوران.
(للمحلول كثافة متوسّطة).
- يحتوي المحلول على أيونات Na+(aq) وأيونات PO43-(aq) وجُزَيئات ماء. أيونات الـ Na+(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الهيدروجين ذات الشحنة الجُزئيّة السالبة تتجاذب كهربائيًّا إلى أيونات الـ Na+(aq).
سؤال 1 بند أ
الإجابة 3.
من خلال المخطّط المُعطى يمكننا أن نفهم أنّ العناصر v ،w و x تقع في نفس الدورة (السطر)، وبما أنّها عناصر متتالية، فكلما انتقلنا إلى اليمين في السطر يقلّ نصف القُطر لأنّ عدد البروتونات في النواة يزداد (يوجد العدد ذاته من مستويات الطاقة المعبّأة بالإلكترونات)، ولذلك تصبح قوى التجاذُب في النواة أقوى ويصغر نصف القُطر.
العنصر y يبدأ سطرًا جديدًا لأن هناك قفزة ملحوظة في نصف قُطر العنصر y مقارنةً بالعناصر التي سبقته. هذا يعني أنّه تمّ إضافة مستوى طاقة آخر مسكون/معبّأ بالإلكترونات. العنصر z أيضًا في نفس السطر الذي يتواجد به العنصر y، نصف قُطره أصغر من نصف قُطر العنصر y لأنّ عدد البروتونات فيه أكبر من عدد البروتونات في العنصر y بواحد (لديهما نفس عدد مستويات الطاقة المعبّأة بالإلكترونات)، وبالتالي يكون التجاذُب في النواة أقوى ويصغر نصف القُطر.
| VIII | VII | VI | II | I | ||||
| X | W | V | ||||||
| Z | Y | |||||||
سؤال 1 بند ب
الإجابة: 2.
في المادّتين الجُزّيئيّتين توجد تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات. (للمادّتين سحابة الإلكترونات ذاتها) إذ انّ جُزَيئات المادّة CH2Cℓ2 قطبيّة، وبينما جُزَيئات المادّة CF4 ليست قطبيّة، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة CH2Cℓ2 أقوى، لذلك التجاذُب بين جُزَيئات CH2Cℓ2 أقوى.
سؤال 3
* (هذا البند تابع لفصل الحوامض والقواعد، ولذلك لا حاجة لحلّه الآن وسنتعلّمه لاحقًا).
- א
- نحسب لكلّ ذرّة العدد الذرّيّ والذي يمثّل أيضًا الشحنة النوويّة. العدد الذرّيّ يساوي عدد الكتلة ناقص عدد النيوترونات.
الذرّة a b c f g عدد الكتلة 14 14 15 17 18 عدد النويترونات 7 8 8 9 9 الشحنة النوويّة (عدد البروتونات/ العدد الذرّيّ) 7 6 7 8 9 للذرّة g الشحنة النوويّة الأكبر.
- العدد الذرّيّ لنظير عنصر النيتروجين N هو 7، ولذلك الذرّتان a و- c هما نظيران للنيتروجين (لهما نفس العدد الذرّيّ، في هذه الحالة 7، ويختلفان في عدد الكتلة/ أو في عدد النيوترونات في النواة).
- c 2,5
f 2,6
g 2,7
- نحسب لكلّ ذرّة العدد الذرّيّ والذي يمثّل أيضًا الشحنة النوويّة. العدد الذرّيّ يساوي عدد الكتلة ناقص عدد النيوترونات.
- ב

- في الجُزَيء NF3 يمكن الاستنتاج أن ذرّة النيتروجين تحمل شحنة جُزئيّة موجبة لأنّ ذرّات الفلور F
ذات سالبيّة كهربائيّة أعلى من ذرّات النيتروجين N.
في الجُزَيء NH3 يمكن الاستنتاج أن ذرّة النيتروجين تحمل شحنة جُزئيّة سالبة لأنّ ذرّات الهيدروجين H
ذات سالبيّة كهربائيّة أقلّ من ذرّات النيتروجين N.
في الجُزَيء FNO يمكن الاستنتاج أن ذرّة النيتروجين تحمل شحنة جُزئيّة لأنّ ذرّة الفلور F وذرّة الأوكسجين أيضًا O ذات سالبيّة كهربائيّة أعلى من ذرّات النيتروجين N.
الجُزَيء HONH2 أكثر تعقيدًا.
من ناحية واحدة، ذرّات النيتروجين ذات سالبيّة كهربائيّة أعلى من ذرّات الهيدروجين، ويوجد رابطان تساهميّان بين ذرّات النيتروجين والهيدروجين، ومن ناحية أخرى، يوجد رابط واحد بين النيتروجين والأوكسجين، وذرّة الأوكسجين ذات سالبيّة كهربائيّة أعلى من ذرّة النيتروجين. لذلك، في المجمل، سيكون على النيتروجين في هذه الحالة شحنة جُزئيّة سالبة.
- ג
- الرابط O-H أكثر قطبيّة من الرابط N-H، ولذلك الشحنات الجُزئيّة على الذرّات في الرابط تكون أكبر، التجاذُب الكهربائيّ بينها أقوى، وبالتالي الرابط أقصر.
خاصيّة إضافية هي أنّ نصف قُطر ذرّة الأكسجين أصغر من نصف قُطر ذرّة النيتروجين. - الرابط N=O أقصر من الرابط N-O لأنّه رابط ثُنائيّ مقابل رابط أحاديّ على التوالي، ولذلك يوجد أزواج أكثر من الإلكترونات الرابطة بين الذرّات، التجاذُب الكهربائيّ بين الأنوية وإلكترونات الرابط أقوى، ولذلك الرابط أقصر.
- الرابط O-H أكثر قطبيّة من الرابط N-H، ولذلك الشحنات الجُزئيّة على الذرّات في الرابط تكون أكبر، التجاذُب الكهربائيّ بينها أقوى، وبالتالي الرابط أقصر.
- ד
- أحد الخيارات للحصول على محلول يكون به الـ pH>7. هذا يعني، محلول قاعديّ هو عندما توضع مادّة في الماء وتتلقّى بروتونًا من الماء (أيونات +H) – هذا صحيح بالنسبة للموادّ الجُزَيئيّة. في الحالة المُعطاة المادّة HONH2 هي مادّة جُزَيئيّة، ولذلك التفاعُل رقم 1 يصف ما يحدث عند إضافة الماء، وبينما التفاعل رقم 2 يتناسب مع سلوك المادّة الأيونيّة في الماء.
- للأمونيا روابط هيدروجينيّة بين الجُزَيئات وثلاثي فلوريد النتروجين وتأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات. الروابط الهيدروجينيّة بين جُزَيئات الأمونيا أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات ثلاثي فلوريد النتروجين، ولذلك نحتاج لطاقة أكبر لتفكيك الروابط الهيدروجينيّة بين جُزَيئات الأمونيا، ودرجة غليانه أعلى.
سؤال 5
*البند “د” تابع لفصل الأكسدة والاختزال فلا حاجة لحلّه في هذه المرحلة.
- א
- درجة غليان المادّة A أعلى من درجة غليان المادّة B.
نتحدّث عن مادّتين جُزَيئيّتين (في الواقع إيزوميرات) يوجد في كلّ منهما روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات. بما أنّ المادّتين لهما نفس سحابة الإلكترونات ونفس عدد المراكز لتكوين روابط هيدروجينيّة، فإن الفرق الوحيد بينهما هو في مساحة سطح الجُزَيئات. لجُزَيئات المادّة A مساحة سطح أكبر، ولذلك فإنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة A أقوى، ونحتاج إلى مزيد من الطاقة لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة A، ولذلك فإن درجة غليانها أعلى. - للمادّة A ذائبيّة مُنخفضة في الماء على الرغم من وجود روابط هيدروجينيّة بين جُزَيئاتها، لأن الجزء الهيدروفوبيّ فيها أكبر نسبيًا من الجزء الهيدروفيليّ، وبالتالي فإن جُزَيئات الماء لا تستطيع تكوين روابط هيدروجينيّة مع جُزَيئات المادّة A. (التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة A قويّة جدًا، ولا تسمح بتكوين أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات المادّة A).
- سيكون الخليط معكّرًا.
- درجة غليان المادّة A أعلى من درجة غليان المادّة B.
- ב
- يجب أن تكون المادّة C دون أربطة هيدروجينيّة بين جُزَيئاتها، لأنّها إيزومير للموادّ A
و-B ولا يمكن أن يتفرّع مبنى التركيبة الكيميائيّة أكثر C4H10O من الإيزومير B. مُعطى أنّ درجة غليان المادّة C أقلّ من درجة غليان الموادّ A و-B، أيّ أنّ الروابط بين الجُزَيئات فيها أضعف، ولذلك يمكن الافتراض أنّه لا توجد روابط هيدروجينيّة بين الجُزَيئات وإنما فقط تأثيرات متبادلة ڤان در ڤالس.
اقتراح لتمثيل مُختصر للصيغة البنائيّة.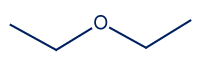
- الشرح موجود في البند السابق.
- يجب أن تكون المادّة C دون أربطة هيدروجينيّة بين جُزَيئاتها، لأنّها إيزومير للموادّ A
- ג
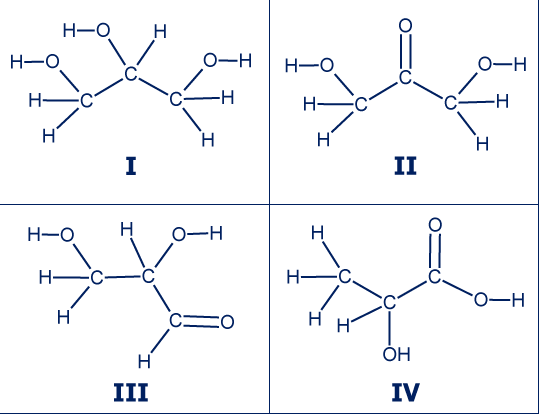
- لنحدّد أيّ من الموادّ هي إيزوميرات، يجب فحص صيغتها الجُزَيئيّة.
يمكننا أن نلاحظ أنّ الموادّ II , III ו-IV لها نفس الصيغة الجُزَيئيّة C3H6O3 ولكن صيَغ بنائيّة مختلفة، ولذلك هي إيزوميرات.
سؤال 1 بند أ
الإجابة 1.
الذرّة a هي ذات نصف القُطر الأكبر من بين جميع الذرّات في هذا السطر، لأنّ جميعها تحتوي على نفس عدد مستويات الطاقة المعبّأة بالإلكترونات. لكن الذرّة a هي ذات الشحنة النوويّة / عدد البروتونات الأقلّ، وبالتالي فإنّ التجاذُب الكهربائيّ في النواة تجاه إلكترونات التكافؤ لديها هو الأضعف، ونصف القُطر لديها هو الأكبر.
سؤال 1 بند ب
الإجابة 3.
للرابط الثُنائيّ C=C طاقة رابط أكبرمن الرابط الأحاديّ C-C.
سؤال 3
- مادّة كحوليّة —HO
إيثر –O–
حامض كربوكسيليّ –HOOC - ב
رمز النظير العدد
الذرّيّعدد
الكتلةعدد
البروتوناتعدد
الإلكتروناتعدد
النويترونات131I 53 131 53 53 78 123I 53 123 53 53 70 - نوع الأشعّة هو أشعّة β لأنّه في هذه الأشعّة يزداد العدد الذرّيّ بـ 1 (يزداد عدد البروتونات بـ 1) ولكن عدد الكتلة لا يتغيّر.
- ג
- تمّ الحصول على خليط متجانس في الأنبوب الاختباريّ (1).
- يحتوي المحلول على جُزَيئات I2 وجُزَيئاتC3H7OH. بين جُزَيئات الـ I2 وجُزَيئات
الـ C3H7OH تأثيرات متبادلة ڤان در ڤالس؛ بين جُزَيئات المُذيب (C3H7OH) توجد تأثيرات متبادلة ڤان در ڤالس، وأربطة هيدروجينيّة تتكوّن بين هيدروجين مكشوف من الإلكترونات في جُزَيء واحد وزوج من الإلكترونات غير الرابط على ذرّة أكسجين في جُزَيء مجاور (قد تكون هناك أيضًا تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات اليودI2).
- المادّة المناسبة هي المادة A.
استبعدت الصيغة الأخرى لأنّه بين جزيئات المادّة الثانية (المادّة B) توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة كما في المادّة 1 – بروبانول، والاختلاف بينهما يكمن في حجم سحابة الإلكترونات (إلكترونان إثنان فقط). لذلك من المحتمل أن تكون للمادّة B وللمادّة 1 – بروبانول درجة غليان مشابهة إلى حدّ كبير (بفارق بسيط). من ناحية أخرى، من المعروف أنّ الأستون له درجة غليان أقلّ بـ 400 درجة عن البروبانول 1، وهذا منطقيّ لأن في الأستون توجد فقط تأثيرات متبادلة ڤان در ڤالس بين جُزَيئاته، وهي أضعف من الأربطة الهيدروجينيّة الموجودة بين جُزَيئات المادّة 1 – البروبانول.
سؤال 4
الرسم صيغة المادّة الصلبة الموصوفة في الرسم نوع الجُسَيمات في المادّة الصلبة نوع الروابط بين الجُسَيمات في المادّة الصلبة a KCℓ كلوريد البوتاسيوم أيونات +K وأيونات – Cℓ أيونيّ (تجاذُب كهربائيّ بين أيونات موجبة وسالبة) b C الماس ذرّات C تساهميّ/ كوفالنتيّ c Mg مغنيسيوم أيونات +Mg2 بحر الإلكترونات فلزّيّ (تجاذُب كهربائيّ بين الأيونات الموجبة وبين الإلكترونات) d I2 يود جُزَيئات I2 ڤان در ڤالس - المغنيسيوم موصِل للكهرباء في الحالة الصلبة لأنّه يحتوي على إلكترونات حرّة الحركة.
الماس غير موصِل للكهرباء في الحالة الصلبة لأنّه لا يحتوي على شحنات كهربائيّة حرّة الحركة، إذ أنّه يتكوّن من ذرّات. - ג
- يحتوي المحلول على أيونات K+(aq) وأيونات Cℓ–(aq) وجُزَيئات ماء. أيونات الـ K+(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الأكسجين ذات الشحنة الجُزئيّة السالبة تتجاذب كهربائيًّا مع أيونات الـ K+(aq).
أيونات الـ Cℓ–(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الأكسجين ذات الشحنة الجُزئيّة الموجبة تتجاذب كهربائيًّا مع أيونات الـ Cℓ–(aq).
بين جُزَيئات الماء (المُذيب) توجد أربطة هيدروجينيّة بين ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء ماء واحد وزوج إلكترونات غير رابط لذرّة أكسجين في جُزَيء ماء مجاور.
للجُسَيمات في المحلول حركة ذبذبة ودوران.
(للمحلول كثافة متوسّطة).
- يحتوي المحلول على أيونات K+(aq) وأيونات Cℓ–(aq) وجُزَيئات ماء. أيونات الـ K+(aq) مُحاطة بجُزَيئات الماء بطريقة حيث أنّ ذرّات الأكسجين ذات الشحنة الجُزئيّة السالبة تتجاذب كهربائيًّا مع أيونات الـ K+(aq).
- ד
- غير صحيح. لذرّات اليود في الجُزَيء HI شحنة جُزئيّة سالبة لأنّ ذرّات اليود ذات سالبيّة كهربائيّة أعلى من ذرّات الهيدروجين.
- غير صحيح. الاختلاف في درجة حرارة الغرفة غير نابع من قوّة الروابط التساهميّة (الكوفالنتيّة) داخل الجُزَيء، بل من الاختلافات في قوّة الروابط بين الجُزَيئات (التأثيرات المتبادلة ڤان در ڤالس).
سؤال 1 بند أ
الإجابة 2.
في انبعاث جُسَيم a، يقلّ عدد الكتلة بـ 4 ويقلّ العدد الذرّيّ بـ 2 لأنّه يتمّ تحرير اثنين من البروتونات واثنين من النيوترونات (جُسَيمات الهيليوم).
سؤال 1 بند ب
الإجابة 1.
طاقة التأيُّن للمغنيسيوم أعلى من طاقة التأيُّن للكالسيوم لأنّ المغنيسيوم يحتوي على عدد أقلّ من مستويات الطاقة المعبّأة بالإلكترونات. البُعد بين النواة (التي تحتوي على بروتونات موجبة) وإلكترونات التكافؤ أصغر، ولذلك فإنّ التجاذُب الكهربائيّ بينهما أقوى، ونحتاج إلى طاقة أكبر لإخراج الإلكترون.
سؤال 1 بند ج
الإجابة 2.
الجُزَيئات CF4 و-CH4 ذات مبنى مُتماثل ليس به عدم تماثُل ثابت في سحابة الإلكترونات.
سؤال 3
* البند “ج” تابع لفصل الأكسدة والاختزال الذي سنتعلّمه فيما بعد ولهذا لا حاجة لحلّه في هذه المرحلة.
- א
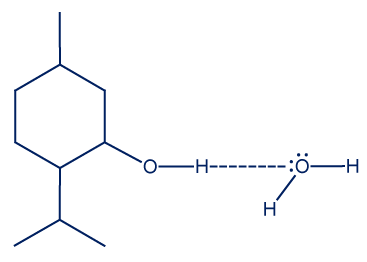
- للمنثول أربطة بين الجُزَيئات: أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. الجزء الهيدروفيليّ (الذي يسمح بتكوين الروابط الهيدروجينيّة) صغير نسبيًا مقارنةً بالجزء الهيدروفوبيّ (الذي يسمح بتكوين التأثيرات المتبادلة ڤان در ڤالس). لا يمكن تكوين أربطة هيدروجينيّة بين جُزَيئات الماء وجُزَيئات المنثول / يتكونّ عدد قليل جدًا من الأربطة الهيدروجينيّة بين جُزَيئات الماء وجُزَيئات المنثول ( التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المينتول قوية، ولا تستطيع جزيئات الماء التسلّل بين جزيئات المنثول وتكوين روابط هيدروجينيّة معها)، ولذلك لا يذوب المينتول جيدًا في الماء.
بالمقابل، للهكسان تأثيرات متبادلة ڤان در ڤالس بين جُزَيئاته، لذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الهكسان وجُزَيئات المنثول، ويذوب المنثول في الهكسان.
- في المنثول المجموعة الوظيفيّة هي المادّة الكحوليّة –OH–
في المنثول المجموعة الوظيفيّة هي كيتون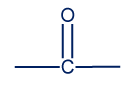 .
.- لكي نحدّد درجة تأكسُد ذرّة الكربون المُشار إليها بـ *. نرى جزئيًا فقط الذرّات المرتبطة بذرّة الكربون المُشار إليها بالرمز *.
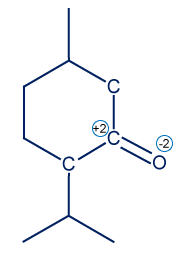 الروابط بين C-C لا تؤثّر على درجة التأكسُد لأنّ ذرّات الكربون لها نفس السالبيّة الكهربائيّة. في الرابط C=O للأكسجين سالبيّة كهربائيّة أعلى، لذلك درجة تأكسُده هي 2- ومن هنا يتبيّن أنّ الكربون المُشار إليها بالرمز * لديه درجة تأكسُد 2+.
الروابط بين C-C لا تؤثّر على درجة التأكسُد لأنّ ذرّات الكربون لها نفس السالبيّة الكهربائيّة. في الرابط C=O للأكسجين سالبيّة كهربائيّة أعلى، لذلك درجة تأكسُده هي 2- ومن هنا يتبيّن أنّ الكربون المُشار إليها بالرمز * لديه درجة تأكسُد 2+. - بما أن ذرّة الكربون في المنثول لها درجة تأكسُد 0 (مُعطى في السؤال) وذرّة الكربون في المنثون لها درجة تأكسُد 2+، يمكننا استنتاج أنّ ذرة الكربون قد مرّت بعملية أكسدة، واستُخدمت كمختزِل، وبالتالي المادّة التي يجب إضافتها ستعمل كعامل مؤكسِد.
- لكي نحدّد درجة تأكسُد ذرّة الكربون المُشار إليها بـ *. نرى جزئيًا فقط الذرّات المرتبطة بذرّة الكربون المُشار إليها بالرمز *.
- بين جُزَيئات المنثون توجد تأثيرات متبادلة ڤان در ڤالس، بين جُزَيئات المنثول توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس (للمادّتين حجم سحابة الإلكترونات مشابه جدًا). الدمج بين الأربطة الهيدروجينيّة والتأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المنثول يشكّل روابط أقوى بين جُزَيئات المنثول مقارنةً بالتأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المنثون ولذلك نحتاج إلى طاقة أكبر لتفكيك الأربطة الهيدروجينيّة والتأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المنثول، درجة غليانه أعلى (ولذلك درجة غليان المنثون أقلّ).
سؤال 6
- א
- ادّة الأيزوأوكتان في درجة حرارة 25°C هي سائلة (درجة الحرارة 25°C أعلى من درجة انصهار الأيزوأوكتان ولكنّها أقلّ من درجة غليانه).
الأيزوأوكتان هو مادّة جُزَيئيّة، ولذلك فهو مكوّن من جُزَيئات الأيزوأوكتان التي توجد بينها تأثيرات متبادلة ڤان در ڤالس، وللجُزَيئات حركة ذبذبة ودوران. (للمادّة كثافة ليست عالية ولا منخفضة). - اليود والبوتان هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس (للمادّتين حجم سحابة الإلكترونات ذاته). مساحة سطح البوتان أكبر، ولذلك فإنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاته أقوى ونحتاج إلى مزيد من الطاقة لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات البوتان ودرجة غليان البوتان أعلى (درجة غليان الإيزوبوتان أقلّ).
- في درجات الحرارة التي تقلّ عن 0°C، يتم استخدام غاز البروبان لأنّه عندما تنخفض درجة الحرارة تحت الـ 0°C يتحوّل البوتان إلى سائل، ولكن هناك حاجة لأنّ تحتوي العبوات على غاز. بالمقابل، يظلّ البروبان في الحالة الغازيّة حتى تحت درجة حرارة 0°C وحتى –42°C-.
- ادّة الأيزوأوكتان في درجة حرارة 25°C هي سائلة (درجة الحرارة 25°C أعلى من درجة انصهار الأيزوأوكتان ولكنّها أقلّ من درجة غليانه).
سؤال 1
الإجابة جسؤال 2
الإجابة بسؤال 3
الإجابة جسؤال 4
الإجابة أسؤال 10
- א
-
Mg(s) +Br2(ℓ) → MgBr2(s)
-
المادّة نوع الجُسَيمات في المادّة صيغة التمثيل الإلكترونيّ لجُسَيمات المادّة نوع الروابط بين الجُسَيمات Br2(ℓ) מולקולות 
تأثيرات مُتبادلة ڤان در ڤالس MgBr2(s) أيونات موجبة Mg2+, أيونات سالبة Br ‾ 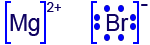
أيونيّ / تجاذُب كهربائيّ بين الأيونات الموجبة والسالبة Mg(s) أيونات موجبة في “بحر من الإلكترونات” فلزّيّ / تجاذُب كهربائيّ بين الكاتيونات (الموجبة) والإلكترونات السالبة
-
- ב
- يمكن أن نلاحظ في الرسم البيانيّ أنّه كلما زادت كتلة بروميد المغنيسيوم المُضاف، زاد التوصيل الكهربائيّ، لأنه بإضافة المادّة الصلبة تتفكّك الشبكة الأيونيّة وتتشكّل أيونات مميّأة حرّة الحركة. كلّما أضفنا المزيد من المادّة الصلبة، سيتكوّن مزيد من الأيونات حرّة الحركة، وسيزداد تركيز الأيونات الكلّيّ، وبالتالي سيزداد التوصيل الكهربائيّ.
- ד
- سنحصل على خليط متجانس في الوعاء B، لأنّ بين جُزَيئات الموادّ C2H4Br2(ℓ) و- C6H14(ℓ) توجد تأثيرات متبادلة ڤان در ڤالس، وبالتالي عند إضافة C2H4Br2(ℓ)، إلى C6H14(ℓ) يتفكّك جزء من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ C2H4Br2(ℓ)، ولكن تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الـ C6H14(ℓ) وجُزَيئات الـ C2H4Br2(ℓ).
- الخليط غير موصِل للكهرباء.
سؤال 12
- א
- لون المحلول أزرق، هذا وصف على المستوى الماكروسكوبيّ، لأنّ هذا ما نراه.
- كتب الطالب أنّ المحلول يحتوي على أيونات Cℓ2‾(aq). هذا خطأ، يحتوي المحلول على أيونات Cℓ ‾(aq). كتب الطالب أنّ الأيونات تكوّن أربطة هيدروجينيّة مع جُزَيئات الماء، هذا خطأ. بين جُزَيئات الماء والأيونات يتكوّن تجاذُب كهربائيّ بين (O) δ‾ والأيون الموجب، وبين (H) δ+ والأيون السالب.
- أيونات وجُزَِيئات الماء في المحلول تتمتّع بحركة ذبذبة ودوران.
سؤال 1 بند أ
إجابة 3
a فلزّ من العمود الثاني وتوجد لافلزّات من العمود الـ 6. a كأيون ستكون شحنته 2+، c كأيون ستكون شحنته 2-. لذلك ac.
سؤال 1 بند ب
الإجابة 1
فقط العنصر الذي عدده الذرّي 118 سيكون في العمود الثامن تحت عنصر الرادون،
. כ
بقيّة العناصر في أعمدة أخرى، ولذلك هذه هي الجملة غير الصحيحة.
سؤال 1 بند ج
الإجابة 4
Rb(s) فلزّ موصِل للكهرباء في الحالة الصلبة وفي الحالة السائلة بسبب وجود ‾e حرّة الحركة. المادّة ثاني أكسيد السيليكون SiO2(s) هي مادّة ذرّيّة، غير موصِلة في الحالة الصلبة وفي الحالة السائلة أيضًا. لا يوجد لديها شحنات كهربائيّة حرّة الحركة (لا إلكترونات ولا أيونات حرّة الحركة).
سؤال 3
- א
- האיזוטופ הוא
.في أشعّة β يزيد العدد الذرّيّ بـ 1 وعدد الكتلة لا يتغيّر لذلك كان للنظير X الوصف
.
- بين جُزَيئات الهيدروجين توجد تأثيرات متبادلة ڤان در ڤالس. سحابة الإلكترونات التابعة لجُزّيئات الهيدروجين صغيرة جدًا (تحتوي على إلكترونين)، ولذلك فإنّ التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات ضعيفة جدًا ويحتاج الأمر إلى طاقة صغيرة جدًا لتفكيك هذه التأثيرات، ودرجة غليان الهيدروجين منخفضة جدًا.
- ג
سؤال 5
- الخاصيّة الأولى: كثافة مُنخفضة.(يمكن أيضًا أن تكون القوى بين الجُزَيئات ضعيفة/البُعد بين الجُزَيئات كبير مقارنةً بحجم الجُزَيئات)
الخاصيّة الثانية: حركة إزاحة، دوران، ذبذبة.
خاصيّة إضافيّة: الجُزَيئات تتصادم مع بعضها البعض ومع جدار الوعاء
خاصيّة إضافيّة: الغاز يتكوّن من جُزَيئات - ב
- الرسم الصحيح هو رسم II.
رسم I غير صحيح إذ أنّه يُظهررابطًا بين أزواج إلكترونات غير رابطة.
رسم III غير صحيح لأنّ ذرّات الهيدروجين في المادّة H2CO(g) غير مكشوفة من الإلكترونات ولا يمكنها تكوين أربطة هيدروجينيّة.
- الرسم الصحيح هو رسم II.
- H2CO(g) هو مادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس أقوى من التأثيرات المتبادلة ڤان در ڤالس الموجودة بين جُزَيئات الـC2H6(g) ولذلك درجة غليانها أعلى وتتكاثف أوّلًا.
سؤال 1
الإجابة أ
في أشعّة β يزداد العدد الذرّيّ بـ 1، عدد الكتلة لا يتغيّر.
سؤال 2
الإجابة ب.
العنصر X هو فلزّ.
العنصر Z هو لا فلزّ.
كونهما يتواجدان في نفس السطر، فإنّ العنصر X والعنصر Z لهما نفس عدد مستويات الطاقة، لكن العنصر Z يحتوي على عدد أكبر من البروتونات في النواة، ولذلك نصف قُطره الذرّيّ أصغر.
سؤال 3
الإجابة د
لجُزَيئات اليوريا توجد ذرّات هيدروجين مكشوفة من الإلكترونات، ولجُزَيئات الأستون توجد ذرّة أكسجين تشكّل مركزًا لتكوين أربطة هيدروجينيّة.
سؤال 9 البنود أ و- ب
- في عمليات حرق الهيدروكربونات التي تُستخدم لاستخراج غاز الهيدروجين اللازم لإنتاج الأمونيا ينبعث غاز CO2(g).
Li(s) Li3N(s) مكوّن من كاتيونات وبحر إلكترونات مكوّن من كاتيونات وأنيونات رابط فلزّيّ رابط أيونيّ يوجد إلكترونات حرّة الحركة لا يوجد إلكترونات حرّة الحركة
سؤال 1
الإجابة ب يوجد نفس عدد البروتونات في النواة.سؤال 2
الإجابة ج. الصوديوم Na هو فلزّ من العمود الأوّل ولذلك أيون الصوديوم يحمل شحنة 1+ . الفوسفور هو لافلزّ من العمود الخامس، ولذلك فإنّ أيون الفوسفور يحمل شحنة 3-. لذلك الصيغة الأمبيريّة الناتجة ستكون Na3P. (يجب أن يكون إجماليّ الشحنات الكهربائيّة في الصيغة الأمبيريّة مساويًا لـ 0).سؤال 3
الإجابة دسؤال 9 البنود باستثناء البندين أi و- ج
- א
- C12H26(ℓ) + 18.5O2(g) →12CO2(g) + 13H2O(ℓ)
- ב
-
- * أكملنا الحلّ بالنسبة لـ 6 مُركّبات في السؤال، يجب اختيار 4 فقط
اسم المُركّب صيغة المجموعة الوظيفيّة اسم المجموعة الوظيفيّة 1 إيثيلين 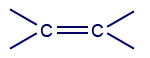
رابط ثُنائيّ بين ذرّات الكربون (ألكين) 2 أستون 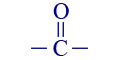 أو –CO–
أو –CO–كيتون 3 إيثانال 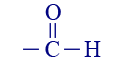 أو : CHO–
أو : CHO–ألديهيد 4 حامض الفورميك 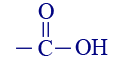 أو: COOH–
أو: COOH–الحامض الكربوكسيلي 5 ميثانول –OH مادّة كحوليّة أو: هيدروكسيل 6 يوريا 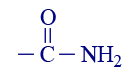 أو: CONH2–
أو: CONH2–أميد - الموادّ الثلاثة هي مواد جُزَيئيّة. بين جُزَيئات الأستون توجد تأثيرات متبادلة ڤان در ڤالس. بين جُزَيئات الميثانول توجد تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة. بين جُزَيئات حامض الفورميك توجد تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة. بما أنّ جُزَيء حامض الفورميك يحتوي على مراكز أكثر لتكوين روابط هيدروجينيّة بين جُزَيئاته مقارنةُ بجُزَيء الميثانول، فإنّ الأربطة بين الجُزَيئات بين جُزَيئات حامض الفورميك أقوى من الأربطة بين جُزَيئات الميثانول ولذلك نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات حامض الفورميك ودرجة غليانه أعلى. الروابط الموجودة بين جُزَيئات حامض الفورميك أقوى من التأثيرات المتبادلة ڤان در ڤالس الموجودة بين جُزَيئات الأستون ولذلك درجة غليان حامض الفورميك أعلى من درجة غليان الأستون.
- * أكملنا الحلّ بالنسبة لـ 6 مُركّبات في السؤال، يجب اختيار 4 فقط
-
- فوائد لاستخدام الـ CO2(g) :
- تقليل كميّة الـ CO2(g) الموجودة في الغلاف الجوّيّ وبالتالي تقليل التلوّث والاحتباس الحراريّ.
- يمكن إنتاج العديد من المواد التي تُستخدَم كوقود.
- استخدام ثاني أكسيد الكربون لإنتاج مجموعة متنوّعة من مركّبات الكربون الأخرى التي تُصنع اليوم من النفط الخام، وبالتالي تقليل الاعتماد على النفط الخام. (يكفي 2 من 3)
سؤال 10
- א
-
SiO2(s) Aℓ2O3(s) نوع الجُسَيمات في المادّة ذرّات O, Si أيونات Aℓ3+ و- O2- نوع الرابط بين الجُسَيمات رابط تساهميّ رابط أيونيّ 
- نترات البوتاسيوم هي المركّب المناسب لهذه العملية لأنّ أيونات الـ +K أكبر من أيونات الـ +Na. لأيونات الـ +K توجد مستويات طاقة أكثر معبّأة بالإلكترونات (نصف قُطر أكبر) مقارنةً بأيونات الـ +Na، لذلك فإنّ أيونات البوتاسيوم أكبر.
-
- In2O3(s)
بما أنّ الأوكسجين في المادّة الأيونيّة هو O2- فإنّ أيون الـ In سيحمل شحنة In3+.
لذلك، يوجد لهذا الأيون:
- 49 بروتونًا.
- 46 إلكترونًا.
- 66 نيوترونًا.
- ג
- كلا العنصرين موجودان في نفس السطر (الدورة) في قائمة العناصر الدوريّة. لكليهما نفس عدد مستويات الطاقة المعبّأة بالإلكترونات. لذرّة الفوسفور عدد أكبر من البروتونات في النواة مقارنةً بذرّة السيليكون ولذلك فإن التجاذُب الكهربائيّ بين النواة وإلكترونات التكافؤ أقوى، ويتطلّب الأمر طاقة أكبر لإخراج الإلكترون.
- القيمة 947kJ⁄moℓ هي لأنّ ذرّة الـ As تحتوي على مستويات طاقّة أكثر معبّأة بالإلكترونات (نصف قُطر أكبر). كلّما كان البُعد بين النواة وإلكترونات التكافؤ أكبر، كان التجاذُب الكهربائيّ أقلّ، ولذلك نحتاج إلى طاقة أقلّ لإخراج الإلكترون.
- ד
- i
- للذرّات حركة ذبذبة.
- روابط تساهميّة قويّة بين الذرّات.
- يتكوّن الچرافيت من مبنى ضخم من الطبقات.
- في كلّ طبقة، ترتبط كلّ ذرّة كربون بروابط تساهميّة مع ثلاث ذرّات كربون.
- لكلّ ذرّة كربون يبقى إلكترون واحد غير مُزدوَج، والإلكترونات غير المُزدوَجة لكلّ ذرّة كربون في الطبقة تتحرك بحرّيّة في الطبقة. (يكفي ذكر 3 خصائص)
- للچرافيت إلكترونات حرّة الحركة ولذلك الچرافيت موصِل للكهرباء في الحالة الصلبة.
- i
سؤال 1
الإجابة أ
سؤال 2
الإجابة أ – لأنّ ذرّة الأوكسجين تحتوي على مستويات طاقة أقلّ معبّأة بالإلكترونات، فإنّ البُعد بين النواة والإلكترون الذي نريد إخراجه أصغر، وبالتالي فإن التجاذُب الكهربائيّ بينهما أقوى ويجب استثمار طاقة أكبر لإخراج الإلكترون.
سؤال 3
الإجابة ج – الرابط بين ذرّة الكربون C وذرّة الكلور ℓC هو رابط قطبيّ نظرًا لوجود فارق في قيَم السالبيّة الكهربائيّة بين ذرّات الكربون وذرّات الكلور. الجُزَيء ليس قطبيًّا لعدم وجود تشوّه ثابت في سحابة الإلكترونات (لا يوجد مبنى مُتماثل للجُزَيء).
سؤال 10
- מצב הצבירה של חומר A הוא נוזל. כי בטמפרטורת החדר נמצאים מעל לטמפרטורת ההיתוך שלו אבל מתחת לטמפרטורת הרתיחה שלו.
מצב הצבירה של חומר B הוא נוזל. כי בטמפרטורת החדר נמצאים מעל לטמפרטורת ההיתוך שלו אבל מתחת לטמפרטורת הרתיחה שלו. - ל
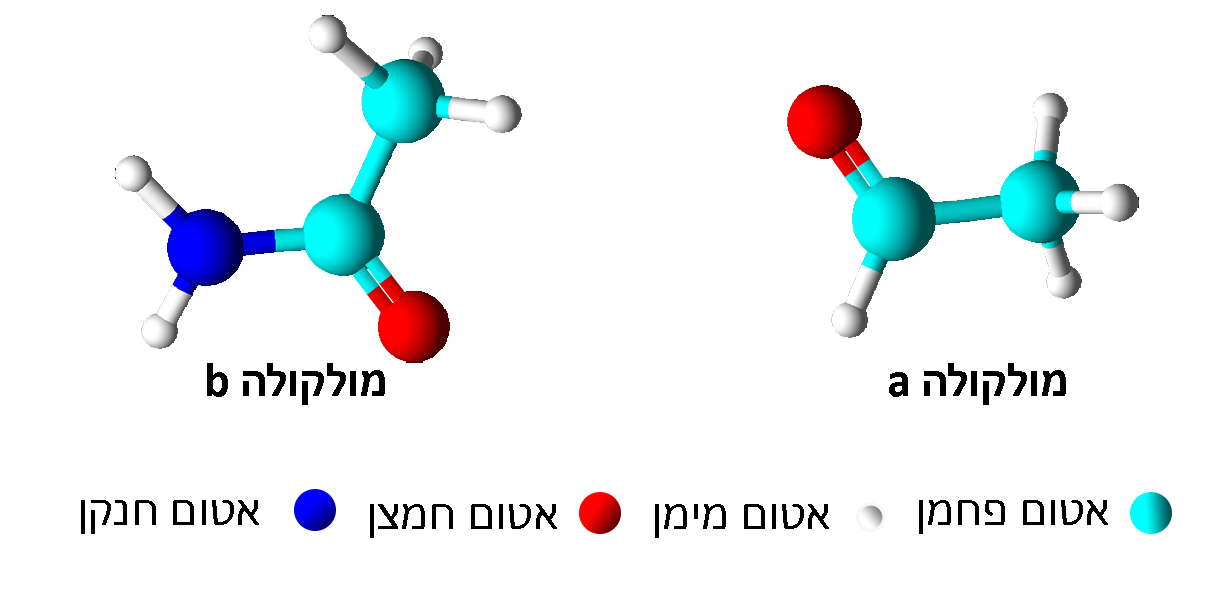
- 1
- صحيح (في كليهما توجد ذرّات هيدروجين، كربون وأكسجين)
- غير صحيح (في كليهما المجموعة الوظيفيّة هي الكحول)
- صحيح (في جُزَيء المادّة – A الرسم 2 توجد 6 ذرّات كربون وبينما في جُزَيء المادّة B- الرسم 1 توجد ذرّتا (2) كربون )
- غير صحيح (يوجد أيضًا حركة دوران وذبذبة).
- المادّة A هي الرسم 2 بين جُزَيئات المادّتين توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. الجزء الذي يسمح بتكوين الروابط الهيدروجينيّة مُتماثل في المادّتين، وفي جُزَيئات المادّة الموجودة في الرسم 2 يوجد جزء هيدروفوبيّ أكبر، سحابة إلكترونات أكبر (وأيضًا مساحة سطح أكبر)، وبالتالي فإنّ التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى، يتطلّب الأمر طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات، ولذلك فإنّ درجة غليانها أعلى.
لذلك المادّة A هي الرسم 2.
- 1
- ג
- الرسم 3 يصف محلولًا. في الرسم 3، هناك خليط جُزَيئات من نوعين مختلفين موزعة بشكل متساوٍ ممّا يكوّن خليطًا متجانسًا، هذا محلول لأنّه يحتوي على جُزَيئات مُذيب سائل، ماء، وجُزَيئات المادّة المُذابة. في الرسم 4، الموادّ لم تختلط (لم تذوب)، يتم وصف طبقتين من السوائل ولا يوجد في هذا الوصف توزيع متساوٍ للجُزَيئات.
- الإجابة
- المادّة A لا تذوب في الماء. المادّة التي لم تذوب في الماء هي مادّة ذات جزء هيدروفوبيّ كبير نسبيًا (على الرغم من وجود روابط هيدروجينيّة بين جُزَيئاتها، إلا أنّ هذه الروابط ضئيلة نسبيًا)، ولذلك لا تتمكن جُزَيئات الماء من التسلّل بين جُزَيئات المادّة A وتكوين روابط هيدروجينيّة معها.
- في الرسم 3 سنحصل على محلول صافٍ، بينما في الرسم 4 سنرى طبقَتين (ربما أيضًا تعكّر).
- ما هو ترتيب الإلكترونات للأيون
?
- 2 , 8
- 2 , 6
- 2 , 8 , 2
- 2 , 8 , 4
الشرح
لعنصر المغنيسيوم Mg ترتيب الإلكترونات التالي 2,8,2 أيون المغنيسيوم +Mg2 يحتوي على إلكترونين أقلّ ولذلك ترتيب الإلكترونات هو: 2,8.
- نشير لعنصر ما بالحرف العشوائيّ A.
عدد الكتلة لذرّة واحدة من العنصر A هو 87.
عدد النيوترونات في هذه الذرّة هو 49.
ما هو الأيون الملائم لذرّة العنصر A؟- A2+
- A2-
- A+
- A3+
الشرح
نطرح العدد الذرّيّ من عدد الكتلة
عدد البروتونات = 87 – 49 = 38
إنّه العنصر Sr الذي يقع في العمود الثاني في قائمة العناصر الدوريّة ولذلك شحنته 2+.
- يعرض الجدول أمامك معلومات حول المبنى الفراغيّ لأربع جُزَيئات
الجُزَيء CF4 CH2Cℓ2 C2F2 HCN المبنى الفراغيّ للجُزَيء رباعيّ السطوح رباعيّ السطوح خطّيّة خطّيّة أمامك أربعة أزواج من الجُزَيئات. في أيّ زوج الجُزَيئان قطبيّان؟
- HCN ו- C2F2
- HCN ו- CH2Cℓ2
- CF4 ו- C2F2
- CF4 ו- CH2Cℓ2
- الأحرف X و- Y هما رمزان عشوائيّان يمثّلان عنصرين موجودين في السطر الثاني أو الثالث من قائمة العناصر الدوريّة. العنصر X موجود في العمود 1 في قائمة العناصر الدوريّة. العنصر Y موجود في العمود 6 في قائمة العناصر الدوريّة. في التفاعُل بين العناصر X و- Y تمّ الحصول على مُركّب يذوب في الماء. من بين الجمل أ – د، ما هي الجملة الصحيحة بخصوص هذا المُركّب؟
- حالة المُركّب في درجة حرارة الغرفة هي غاز.
- صيغة المركّب هي XY2(s).
- المحلول المائيّ للمركّب موصِل للكهرباء.
- بدرجة حرارة الغرفة، يتكوّن المركّب من جُزَيئات صيغتها الجُزَيئيّة هي X2Y.
الشرح
العنصر X هو فلزّ من العمود الأوّل.
العنصر Y هو لافلزّ من العمود السادس.
المُركّب الناتج هو مُركّب أيونيّ، ولذلك فإن المحلول المائيّ لهذه المادّة موصل للتيّار الكهربائيّ لاحتوائه على أيونات مميّأة حرّة الحركة. - أمامك جدول يحتوي على مُعطيات عن ثلاث موادّ.
اسم المادّة حالة المادّة في درجة حرارة الغرفة التمثيل الكامل للصيغة البنائيّة للجُزَيء 2 – بروبانول سائلة أستون سائلة أوكتان سائلة أمامكم أربع جُمل من I – IV، تَصف ظواهر وكلّ الجُمل صحيحة.
- درجة غليان 2 – البروبانول أعلى من درجة غليان الأستون.
- درجة غليان الأوكتان أعلى من درجة غليان 2 – البروبانول.
- 2 – البروبانول يذوب في الأوكتان.
- أستون يذوب في الماء.
أيّ من الجُمل تَصف الظواهر التي يمكن شرحها من خلال التأثيرات المتبادلة ڤان در ڤالس فقط?
- الجُمل I و- III.
- الجُمل II و- III.
- الجُمل I و- IV.
- الجُمل II و- IV.
9. تحليل فقرة من مقال علميّ – إلزاميّ
هـ.
- الإيثانول هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. الأمونيا هي مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة. ذرّة الهيدروجين المكشوفة من الإلكترونات في جُزَيء الإيثانول تتواجد في رابط أكثر قطبيّة (O-H) مقارنةً بذرّة الهيدروجين المكشوفة من الإلكترونات في جُزَيء الأمونيا (N-H). لذلك، الشحنة الجُزئيّة الموجبة على ذرةّ الهيدروجين في الرابط O-H أكبر، التجاذُب الكهربائيّ لزوج الإلكترونات غير الرابط على ذرّة الأوكسجين في جُزَيء الإيثانول المجاور أقوى، ولذلك تتكوّن روابط هيدروجينيّة أقوى بين جُزَيئات الإيثانول. إضافةً لذلك، سحابة الإلكترونات لجُزَيء الإيثانول أكبر من سحابة الإلكترونات لجُزَيء الأمونيا، والتأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الإيثانول أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الأمونيا (بفضل الجزء الهيدروفوبيّ، الهيدروكربونيّ). محصّلة القوى بين جُزَيئات الإيثانول أقوى، ولذلك يتطلّب الأمر طاقة أكبر لتفكيكها وبالتالي فإنّ درجة غليانه أعلى.
13. المبنى والترابط، الطاقة
| أجِب عن البنود أ، ب، ج، د وعلى واحد من البنود هـ أو و. |
الجلّ الكحوليّ هو مادة تُستخدم لتعقيم وتنظيف اليدين عند عدم توفّر المياه والصابون.
الجلّ الكحوليّ هو خليط سائل لمادّتين كحوليّتين تُذاب في الماء.
أمامك جدول يحتوي على مُعطيات عن الموادّ الكحوليّة التي قد نجدها في الجلّ الكحوليّ.
| اسم المادّة الكحوليّة | درجة الغليان (°C) | التمثيل المختصر للصيغة البنائيّة لجُزَيء المادّة الكحوليّة | |
| 1 | إيثانول | 78 | |
| 2 | 1-بروبانول | 97 | |
| 3 | 2-بروبانول | 82 | |
| 4 | غليسرول |
- א
- اكتب صيغة التمثيل الإلكترونيّ لكلّ واحدة من جُزَيئات المادّة الكحوليّة المذكورة في الجدول.
الإجابة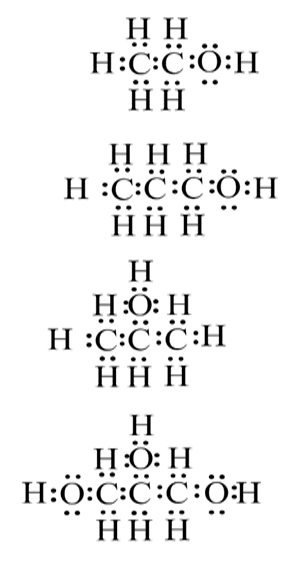
- أيّ نوعين من الموادّ الكحوليّة المُعطاة في الجدول هما إيزومرات؟علّل.
الإجابة
الموادّ 2، 3 هم إيزومرات لأنّ لها نفس الصيغة الجُزَيئيّة لكن صيغتها البنائيّة مختلفة.
- اكتب صيغة التمثيل الإلكترونيّ لكلّ واحدة من جُزَيئات المادّة الكحوليّة المذكورة في الجدول.
- اشرح لماذا درجة غليان 1-البروبانول أعلى من درجة غليان الإيثانول.
الإجابة
المادّتان هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. للمادّتين نفس عدد المراكز لتكوين الروابط الهيدروجينيّة. 1 للبروبانول سحابة إلكترونات أكبر ومساحة سطح أكبر ولذلك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات 1 البروبانول أقوى ونحتاج إلى طاقة أكبر لتفكيكها ولذلك درجة غليان 1 البروبانول أعلى. - أيّ من الجُمل (1) – (3) التي أمامك يشرح الفرق بين درجة غليان 1-البروبانول وبين درجة غليان 2-البروبانول. علّل.
(1) مساحة السطح لجُزَيء 1-البروبانول أكبر من مساحة السطح لجُزَيء 2-البروبانول.
(2) جُزَيء 1-البروبانول هو قطبيّ، وبينما جُزَيء 2-البروبانول ليس قطبيًّا.
(3) حجم سحابة الإلكترونات لجُزَيء 1-البروبانول يختلف عن حجم سحابة الإلكترونات لجُزَيء 2-البروبانول.
الإجابة
الإجابة هي (1).
في المادّتين توجد بين الجُزَيئات أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس.
للمادّتين سحابة إلكترونات مماثلة (هما إيزومِرات) ونفس عدد المراكز لتكوين الروابط الهيدروجينيّة.
لـ 1 بروبانول مساحة سطح أكبر (لأنّه أقلّ تشعّبًا) لذلك فإنّ مساحة التلامس بين جُزَيئات 1 البروبانول أكبر. التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات 1 البروبانول أقوى، تحتاج إلى طاقة أكبر لتفكيكها. لذلك، درجة غليان 1 البروبانول أعلى. - حدّد ما إذا كانت درجة غليان الغليسرول أعلى من درجة غليان 2-البروبانول أو أقلّ منها. علّل إجابتك.
في إجابتك، تتطرّق إلى جميع أنواع القوى التي تعمل بين الجُزَيئات في كلّ من المُركّبين.
الإجابة
للغليسرول درجة غليان أعلى.
بين جُزَيئات الغليسرول توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة.
بين جُزَيئات 2 البروبانول توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة.
جُزَيء الغليسرول يحتوي على مراكز أكثر لتشكيل روابط هيدروجينيّة وسحابة إلكترونات أكبر، لذلك الروابط بين الجُزَيئات في الغليسرول أقوى، وتحتاج إلى طاقة أكبر لتفكيكها. لذلك، درجة غليان الغليسرول أعلى.
14. الموادّ الأيونيّة، حِسابات
| أجب على البنود ج، د، هـ، و وعلى أحد البندَين أ أو ب. |
يتعلّق السؤال بالمواد الأيونيّة وصِفاتها.
| البند أ هو بند اختياريّ. إذا اخترت الإجابة عليه، لا تجِب على البندب. |
- كلّ الموادّ الأيونيّة تكون صلبة في درجة حرارة الغرفة.
اشرح هذه الجملة على المستوى الميكروسكوبيّ.
الإجابة
في الموادّ الأيونيّة يوجد رابط أيونيّ (تجاذُب كهربائيّ قويّ) بين الأيونات الموجبة والسالبة.
في درجة حرارة الغرفة، لا توجد طاقة كافية لتفكيك الروابط الأيونيّة، لذا فهي تكون صلبة. (للموادّ الأيونيّة درجة انصهار أعلى من درجة حرارة الغرفة).
| البند ب هو بند اختياريّ. إذا اخترت الإجابة عليه، لا تجِب على البند أ. |
- المادّة الأيونيّة غير موصِلة للكهرباء في درجة حرارة الغرفة.
الإجابة
تتكوّن الموادّ الأيونيّة في الحالة الصلبة من أيونات موجبة وسالبة يوجد بينها تجاذُب كهربائيّ قويّ. في الحالة الصلبة في الموادّ الأيونيّة، لا توجد أيونات حرّة الحركة، لذلك لا يوجد توصيل كهربائيّ.
اشرح هذه الجملة على المستوى الميكروسكوبيّ.
- أمامك أربع صِيَغ (1) – (4)
- حدّد أيّ من الصِيَغ (1) – (4) تصِف عمليّة انصهار يوديد البوتاسيوم، KI(s).
الإجابة
تفاعُل 4 - حدّد أيّ من الصِيَغ (1) – (4) تصِف عمليّة إذابة يوديد البوتاسيوم في الماء، KI(s).
الإجابة
تفاعُل 2
- حدّد أيّ من الصِيَغ (1) – (4) تصِف عمليّة انصهار يوديد البوتاسيوم، KI(s).
- كبريتات الألومنيوم هو مادّة صلبة تُستخدم في الصناعة الكيميائيّة لإنتاج كبريتيد الهيدروجين، H2S(g).
- اكتب الصيغة الأمبيريّة لكبريتات الألومنيوم.
الإجابة
Aℓ2S3(s) - كبريتات الألومنيوم يتفاعل مع الماء ويكوّن هيدروكسيد الألومنيوم، Aℓ(OH)3(s)، كبريتيد الهيدروجين، H2S(g). صِغ ووازِن التفاعل.
الإجابة
Aℓ2S3(s) + 6H2O(ℓ) → 2Aℓ(OH)3(s) + 3H2S(g)
- اكتب الصيغة الأمبيريّة لكبريتات الألومنيوم.
- مُعطى نظيران للصوديوم 22Na و- 23Na.
ما هي الجملة الصحيحة؟- الشحنة النوويّة للنظير 23Na أكبر من الشحنة النوويّة للنظير 22Na.
- عدد البروتونات في النظير 22Na أصغر من عدد البروتونات في النظير 23Na.
- عدد الإلكترونات في النظير 23Na أكبر من عدد الإلكترونات في النظير 22Na.
- عدد البروتونات في النظير22Na أصغر من عدد البروتونات في نظير كبريتيد الهيدروجين 23Na.
اشرح: الاختلاف بين النظيرين المُعطَيين هو في عدد الكتلة. نظرًا لأنّ لكلّ نظير من نظائر ذرّة الصوديوم عدد ذرّي / شحنّة نوويّة 11
يوجد 11 نيوترونًا وبينما للنظير
يوجد 12 نيوترونًا (الفرق بين عدد الكتلة والعدد الذرّيّ).
- أمامكم صيَغ التمثيل الإلكترونيّ I-V:
I II III IV V 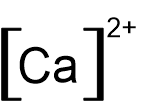
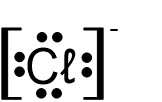
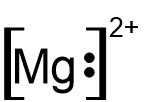
أيّ من بين الصيَغ I-V تمثّل بشكل صحيح أيونات أحاديّة الذرّة؟
- I و- II
- III و- IV
- III و- V
- IV و- V
الشرح: التمثيل الإلكترونيّ لأيون أحاديّ الذرّة موجب يكون دائمًا بدون إلكترونات مع أقواس مربّعة وشحنة كهربائيّة خارج الأقواس.
التمثيل الإلكترونيّ لأيون أحاديّ الذرّة سالب يكون دائمًا مكتملًا بثمانية إلكترونات، أقواس مربّعة وشحنة كهربائيّة خارج الأقواس. - أمامكم جدول يحتوي على بيانات لثلاث مواد:
اسم المادّة درجة الغليان
(C°)التمثيل الكامل للصيغة البنائيّة لجُزَيء الكامل 1-بنتانول 138 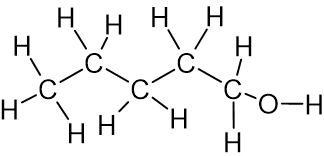
1-أمينو بنتان 104 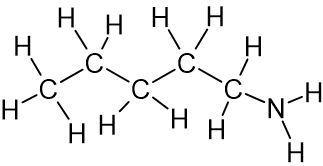
درجة غليان 1-الأمينو بنتان أقلّ من درجة غليان 1-البنتانول.
ما السبب في ذلك؟- مساحة السطح لجُزَيء 1- الأمينو بنتان أصغر من مساحة السطح لجُزَيء 1-البنتانول.
- سحابة الإلكترونات في جُزَيء 1- الأمينو بنتان أصغر من سحابة الإلكترونات في جُزَيء 1-البنتانول.
- الروابط الهيدروجينيّة التي تتكوّن بين جُزَيئات 1-الأمينو بنتان أضعف من الروابط الهيدروجينيّة التي تتكوّن بين جُزَيئات 1-البنتانول.
- في جُزَيء 1- الأمينو بنتان توجد أقلّ مراكز ممكنة لتكوين روابط هيدروجينيّة مقارنةً بجُزَيء 1-البنتانول.
الشرح: بين جُزَيئات الموادّ المُعطاة توجد تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة.
حجم سحابة الإلكترونات للموادّ هو ذاته.
الروابط الهيدروجينيّة التي تتكوّن بين جُزَيئات 1 البنتانول أقوى لأنّ الرابط O-H أكثر قطبيّة من الرابط N-H وبالتالي فإنّ ذرّة الهيدروجين مكشوفة أكثر من الإلكترونات ولديها شحنة جُزئيّة موجبة أكبر، مما يجعل التجاذُب الكهربائيّ بينها وبين زوج الإلكترونات غير الرابط على ذرّة أكسجين في جُزَيء مجاور أقوى. يحتاج الأمر إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات 1 البنتانول ولذلك درجة غليان 1 البنتانول أعلى من درجة غليان 1 الأمينو بنتان.
9. تحليل فقرة من مقال علميّ – إلزاميّ
- الناتج الممكن هو ماء H2O.
يتكوّن الماء من الهيدروجين والأكسجين، والمركّبان الآخران يحتويان على الكربون. لذلك، عند حرق الهيدروجين سيتكوّن مركّب يحتوي فقط على ذرّات هيدروجين وذرّات أكسجين، ولن يحتوي على ذرّات كربون. - CH4(g) + 2H2O(g) → CO2(g) + 4H2(g)
- درجة غليان الأكسجين أعلى من درجة غليان الهيدروجين.
درجة غليان الهيدروجين (درجة الحرارة التي يتحوّل فيها من سائل إلى غاز) مماثلة لدرجة التكثيف الخاصّة به (درجة الحرارة التي يتحوّل فيها من غاز إلى سائل) وهي 20.3K.
وبما أنّ للأكسجين سحابة إلكترونات أكبر من الهيدروجين، فإنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الأكسجين أقوى. يحتاج الأمر إلى طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جزيئات الأكسجين ولذلك درجة غليانه أعلى من 20.3K.
10. المبنى والترابط، الحِسابات، الطاقة
- قُطبيّة الجُزَيئات وكِبَر سحابة الإلكترونات.
- كلّما كانت سحابة الإلكترونات أكبر، تتكوّن تقاطُبات لحظيّة أكثر بسبب حركة سحابة الإلكترونات، وبالتالي تصبح التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى.
في الجُزَيئات القطبيّة، توجد أقطاب ثابتة في الجُزَيء ممّا يؤدّي إلى تقوية التأثيرات المتبادلة ڤان در ڤالس. (للجُزَيء CBrF3 سحابة إلكترونات أكبر من سحابة إلكترونات الجُزَيء CF4، والجُزَيء CBrF3 هو جُزَيء قطبيّ وبينما الجُزَيء CF4 ليس قطبيًّا). - 2Aℓ(OH)3(s) → Aℓ2O3(s) + 3H2O(g)
- Mg(OH)2(s) → MgO(s) + H2O(g)
11. المبنى والترابط، الطاقة
- الرسم الذي يَصف المبنى الميكروسكوبيّ للـ C2H5OH(ℓ) بدرجة حرارة الغرفة هو الرسم 3.
الرسم الذي يَصف المبنى الميكروسكوبيّ للـ KCℓ(s) بدرجة حرارة الغرفة هو الرسم 6. - محلول KCℓ(aq) لأنّه يحتوي على أيونات مُميّأة حرّة الحركة.
- المادّة هي C2H5OH(ℓ) .
بين جُزَيئات هذه المادّة توجد تأثيرات متبادلة ڤان در ڤالس وأربطة هيدروجينيّة، بين جُزَيئات الهكسان توجد تأثيرات متبادلة ڤان در ڤالس ولذلك عند خَلط هذه الموادّ تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الهكسان وجُزَيئات الـ C2H5OH(ℓ).
- يعرض الجدول الذي أمامكم مُعطيات حول تركيبة ثلاث جُسَيمات تمّت الإشارة إليها عشوائيًا باستخدام الأحرف X, Y, Z.
الجُسَيم عدد البروتونات عدد النويترونات ترتيب الإلكترونات X 18 18 2,8,8 Y 17 18 2,8,8 Z 18 20 2,8,8 ما هي الجملة الصحيحة؟
- شحنة النواة في الجُسَيمات X و- Y متطابقة.
- لكلّ واحد من الجُسَيمات الثلاثة X, Y, و-Z لا توجد شحنة كهربائيّة.
- الجُسَيمات X و- Z هي نظائر لنفس العنصر.
- الجُسَيمات الثلاثة X, Y و- Z هي ذرّات لعناصر مختلفة.
الشرح
للجُسَيمات X و- Z نفس عدد البروتونات عدد النيوترونات ولكن عدد النيوترونات مُختلف ولذلك عدد الكتلة مُختلف. - أمامكم الصيَغ الجُزَيئيّة لأربع جُزَيئات: CℓCN , CO2, C2Cℓ2 , CS2.
مبنى كلّ واحدة من الجُزَيئات هو خطّيّ.
فيما يلي أربع جمل أ-د، حول موضوع الروابط التساهميّة في الجُزَيئات وقطبيّة الجُزَيئات.
ما هي الجملة الصحيحة؟- في جميع الجُزَيئات، كلّ الروابط التساهميّة هي قُطبيّة.
- الجُزَيئات C2Cℓ2 و- CO2 هي جُزَيئات قُطبيّة.
- في الجُزَيئات CS2 و- CO2 توجد روابط تساهميّة أحاديّة.
- في الجُزَيئات CℓCN و- C2Cℓ2 يوجد رابط تساهميّ ثُلاثيّ.
الشرح
- النماذج التي أمامكم تمثّل الصيَغ البنائيّة لاثنين من الجُزَيئات المُشار إليها بشكل عشوائيّ بالأحرف a و- b.
 أمامكم أربع جُمل I-IV
أمامكم أربع جُمل I-IV
I. في الجُزَيء a المجموعة الوظيفيّة هي كيتون.
II. في الجُزَيء b المجموعة الوظيفيّة هي مجموعة الأميد.
III. بين جُزَيئات a قد تتكوّن أيضًا روابط هيدروجينيّة.
iV. بين جُزَيئات b قد تتكوّن أيضًا روابط هيدروجينيّة.
ما هي الجمل الصحيحة؟- I و- II
- II و- III
- I و- IV
- II و- IV
الشرح
المجموعة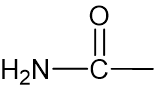 هي أميد. وفي هذه الحالة، توجد ذرّات هيدروجين مكشوفة من الإلكترونات لذلك يمكن أن تتكوّن روابط هيدروجينيّة بين الجُزَيئات.
هي أميد. وفي هذه الحالة، توجد ذرّات هيدروجين مكشوفة من الإلكترونات لذلك يمكن أن تتكوّن روابط هيدروجينيّة بين الجُزَيئات.
9. تحليل فقرة من مقال علميّ – إلزاميّ
- اكتبوا صيَغ 4 مُركّبات أيونيّة قد تكون مصدرًا للأيونات الموجودة في الكُتل الجليديّة.
الإجابة:
هناك عدد من الإمكانيات:
NaCℓ, Na2SO4, MgCℓ2, CaCℓ2, CaSO4, MgSO4
يجب ذكر 4 فقط من القائمة.
في نصف الأرض الشماليّ، تركيز أيونات الصوديوم في مياه البحر هو
0.46.
- النموذج في المخطّط الذي أمامكم يمثّل جزءًا من ترتيب جُزَيئات الماء في الجليد.
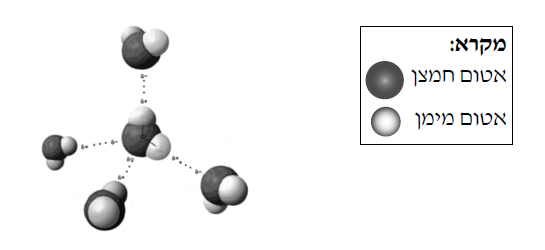
- أمعِنوا النظر في النموذج وحدّدوا كم عدد ذرّات الهيدروجين المرتبطة بكلّ ذرّة أكسجين وبأيّ أنواع من الروابط.
الإجابة:
كلّ جُزَيء ماء مرتبط بـ 4 ذرّات هيدروجين. يوجد رابطان داخل الجُزَيء وهما رابطان تساهميّان، ورابطان بين الجُزَيئات وهم روابط هيدروجينيّة. - صيغوا عمليّة انصهار الجليد.
الإجابة:
H2O(s) → H2O(ℓ)
- أمعِنوا النظر في النموذج وحدّدوا كم عدد ذرّات الهيدروجين المرتبطة بكلّ ذرّة أكسجين وبأيّ أنواع من الروابط.
- أمامكم الجملتان I و- II. حدِّدوا ما إذا كانت كلّ جملة من الجُمل صحيحة أو غير صحيحة.
- ذرّات جُزَيئات الماء في الجليد لها أنماط حركة من نوع الذبذبة فقط. صحيحة.
- لجُزَيئات الماء في الجليد توجد أنماط حركة من نوع الإزاحة فقط.غير صحيح.
- أمامكم ثلاث جُمل I, II و- III. استندوا إلى المقال العلميّ وحدّدوا بالنسبة لكلّ جملة ما إذا كانت صحيحة أم غير صحيحة.
- عند حدوث البرق، تنكسر الروابط التساهميّة بين الذرّات في جُزَيئات الماء الموجودة في السُحب/الغيوم. صحيحة.
- عند حدوث البرق، تنكسر الروابط التساهميّة بين الذرّات في الجُزَيئات الموجودة في الهواء. صحيحة.
- يؤثّر البرق على درجة حرارة البيئة فقط عندما يصطدم بالأرض. غير صحيح.
- أمامكم رسم تخطيطيّ للطاقة لـ 1 مول ماء.
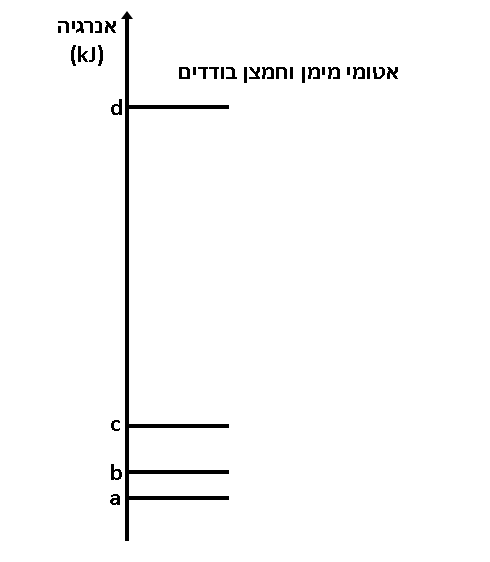
- ما هي حالة الماء في كلّ واحدة من الحالات التالية: a, b, c?
الإجابة:
a حالة المادّة صلبة.
b حالة المادّة سائلة.
c حالة المادّة غازيّة. - اشرحوا لماذا انتقال الطاقة بين d-c أكبر من انتقال الطاقة بين b-a.
الإجابة:
الانتقال بين c-d أكبر من الانتقال بين a-b لأنّ في انتقال الطاقة بين a-b تنكسر الروابط الهيدروجينيّة بين الجُزَيئات بينما في الانتقال بين c-d تنكسر الروابط التساهميّة بين الهيدروجين والأكسجين داخل الجُزَيء.
الرابط التساهميّ أقوى من الرابط الهيدروجينيّ ويتطلب تفكيكه طاقة أكبر بكثير مقارنةً بالطاقة المطلوبة لتفكيك الروابط الهيدروجينيّة بين الجُزَيئات.
- ما هي حالة الماء في كلّ واحدة من الحالات التالية: a, b, c?
10. مبنى الذرّة، المبنى والترابط، حِسابات
بطاريّات الليثيوم تزوّد الطاقة للعديد من الأجهزة. إنّها تحتوي على مركّبات أيونيّة، محاليل تحتوي على أيونات حرّة الحركة ومواد أخرى.
الليثيوم، Li(s)، كان مكونًا أساسيًا في بطاريات الليثيوم الأولى.
- صِفوا مبنى الليثيوم، Li(s)، واشرحوا لماذا المادّة موصِلة للكهرباء في درجة حرارة الغرفة.
الإجابة:
يحتوي المبنى على أيونات ليثيوم +Li يتحرّك بينها بحر من الإلكترونات غير المُتمركزة، (يوجد بينها رابط فلزّيّ).
Li(s) موصِل للتيّار الكهربائيّ بفضل بحر الإلكترونات حرّة الحركة الموجودة في مبنى فلزّ الليثيوم.
في البطاريات التي لا تعتمد على الليثيوم، المُذيب هو الماء. ولكن، في بطاريات الليثيوم المُذيبات ليست مائيّة.
إليكم التفاعل التالي:
Li(s) + H2O(ℓ) → H2(g) + Li+(aq) +OH–(aq) ΔH0 <0
- اشرحوا لماذا لا يُستخدم الماء كمُذيب في بطاريّة ليثيوم.
الإجابة:
لا يُستخدم الماء كمُذيب في بطاريّة ليثيوم لأنّ الماء يتفاعل مع الليثيوم.
في التفاعل، ينبعث غاز الهيدروجين القابل للاشتعال، وعادةً تكون البطارية محكمة الإغلاق وتكوين الغاز يؤدّي إلى زيادة الضغط داخل البطاريّة، مما قد يتسبب في انفجار البطاريّة.
إضافةً لذلك، في التفاعل يتمّ إطلاق طاقة مع غاز الهيدروجين القابل للاشتعال، الأمر الذي قد يسبّب حدوث انفجار.
أحد المُذيبات في بطاريّة ليثيوم هو ثنائي ميثيل الكربونات (DMC).
أمامكم التمثيل المختصر للصيغة البنائيّة لجُزَيء DMC:
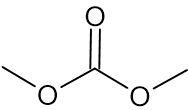
- اكتبوا الصيغة الجُزَيئيّة للـ DMC.
الإجابة:
C3H6O3
فيما يلي تمثيلات مُختصرة لصيَغ بنائيّة لثلاث جُزَيئات إضافيّة:
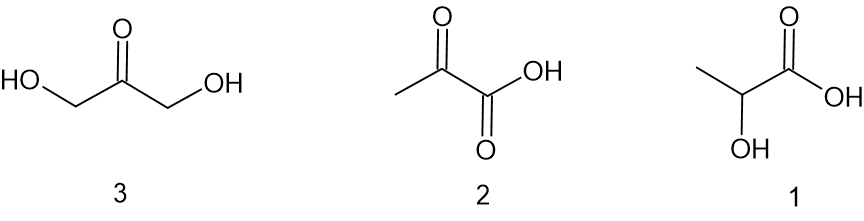
- أيّ جُزَيء أو أيّ جُزَيئات هي إيزومرات لـ DMC؟ فسّروا اختياركم.
الإجابة:
للجُزَيئات 1 و-3 الصيغة الجُزَيئيّة ذاتها مثل الـ DMC وصيغة بنائيّة مختلفة ولذلك هي إيزومرات لـ DMC.
لجُزَيئات المادّة 2 صيغة جُزَيئيّة محتلفة عن الـ DMC ولذلك المادّة 2 ليست إيزومر للـ DMC. (الصيغة الجُزَيئيّة للمادّة 2 هي C3H4O3) - درجة غليان الـ DMC أقلّ من درجة غليان الماء في ظروف مُماثلة. فسّروا هذه الحقيقة.
الإجابة:
بين جُزَيئات الـ DMC توجد تأثيرات متبادلة ڤان در ڤالس. بين جُزَيئات الماء توجد روابط هيدروجينيّة أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات DMC.
يتطلّب تفكيك الروابط الهيدروجينيّة بين جُزَيئات الماء طاقة أكبر، وبالتالي فإنّ درجة غليان الماء أعلى من درجة غليان الـ DMC. (درجة غليان الـ DMC أقلّ من درجة غليان الماء). - قوموا بإذابة 139 غرام DMC في الماء وأعدّوا محلولًا بحجم 1 لتر.
- اشرحوا لماذا يذوب الـ DMC في الماء.
الإجابة:
يذوب الـ DMC في الماء لأنّ ذرّات الأكسجين في جُزَيء الـ DMC تشكّل مركزًا لتكوين روابط هيدروجينيّة. ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء الماء تنجذب إلى زوج الإلكترونات غير الرابط لذرّة الأوكسجين في جُزَيء DMC مُجاور لهم.
- اشرحوا لماذا يذوب الـ DMC في الماء.
بطاريّات الليثيوم القابلة للشحن تُسمى بطاريّات ليثيوم-أيون وتُستخدم، من بين أمور أخرى، لتشغيل السيّارات الكهربائيّة.
هناك بطارياّت ليثيوم-أيون تعتمد على مُركّبات الليثيوم، مثل أكسيد الليثيوم والكوبالت، LiCoO2(g).
المُركّب الأيونيّ LiCoO2(g) يتكوّن من أيونات ليثيوم، أيونات كوبالت Co3+، وأيونات أكسجين O2-.
- اكتبوا صيغة التمثيل الإلكترونيّ لأيونات الليثيوم وأيونات الأكسجين.
الإجابة: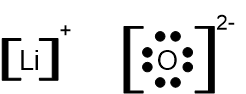
14. المبنى والترابط، الأكسدة والاختزال، الحوامض والقواعد
يعرض الجدول أمامكم مُعطيات لثلاثة عناصر تمّت الإشارة إليها عشوائيًّا بالحروف: c، b، a
| رمزعشوائيّ للعنصر | درجة الانصهار للعنصر (C°) | درجة الغليان للعنصر (C°) | التوصيل الكهربائيّ للعنصر في درجة حرارة الغرفة |
| a | 98 | 883 | موصِل للكهرباء |
| b | 259- | 253- | غير موصِل للكهرباء |
| c | 7- | 59 | غير موصِل للكهرباء |
- لائموا بين العناصر: هيدروجين، H2(g)، بروم، Br2(ℓ), صوديوم، Na(s) وبين الأحرف c، b، a.
الإجابة:
a – Na(s)
b – H2(g)
c – Br2(ℓ) - ב
- حدّدوا نوع الروابط بين ذرّات العنصر المُشار إليه بالحرف b.
الإجابة:
بين ذرّات العنصر b – H2(g) توجد روابط تساهميّة. - اشرحوا لماذا درجة غليان العنصر المُشار إليه بالحرف c أعلى من درجة غليان العنصر المُشار إليه بالحرف b.
الإجابة:
درجة غليان العنصر c – Br2(ℓ) أعلى من درجة غليان العنصر b – H2(g) لأنّ جُزَيء الـ Br2(ℓ) يحتوي على سحابة إلكترونات أكبر حجمًا من جُزَيء الـ H2(g)، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ Br2(ℓ) أقوى من تلك الموجودة بين جُزَيئات الـ H2(g)، يتطلّب الأمر طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ Br2(ℓ)، ولذلك درجة غليان المادّة Br2(ℓ) أعلى.
- حدّدوا نوع الروابط بين ذرّات العنصر المُشار إليه بالحرف b.
- في التفاعُل بين العنصر المُشار إليه بالحرف a وبين العنصر المُشار إليه بالحرف c، يتمّ الحصول على ناتج واحد يكون صلبًا في درجة حرارة الغرفة.
هذا الناتج يذوب في الماء.- الإجابة:
الناتج الذي نحصل عليه بين a – Na(s) وبين c – Br2(ℓ) هو NaBr(s) ، مادّة أيونيّة.
الصوديوم Na(s) هو فلزّ من العمود الأوّل ولذلك عندما يتحوّل إلى أيون تكون شحنته 1+.
البروم Br2(ℓ) هو لافلزّ من العمود السابع ولذلك عندما يتحوّل إلى أيون تكون شحنته 1-.
صياغة تفاعُل إذابة الناتج في الماء: - هل المحلول الناتج موصِل للكهرباء؟ علِّلوا إجابتكم.
الإجابة:
المحلول موصِل للكهرباء لأنّه يحتوي على أيونات مُميّأة حرّة الحركة.
- الإجابة:
- في التفاعُل بين العنصر المُشار إليه بالحرف b وبين العنصر المُشار إليه بالحرف c، يتمّ الحصول على ناتج واحد يكون غازًا في درجة حرارة الغرفة.
هذا الناتج يتفاعل مع الماء ونحصل على محلول.- ما هي صيغة الناتج؟
الإجابة:
الناتج الذي نحصل عليه من التفاعُل بين b – H2(g) وبين c – Br2(ℓ) هو HBr(g) ، مادّة جُزَيئيّة.
الهيدروجين H2(g) هو لافلزّ لديه إلكترون واحد غير مُزدوَج، يشارِك فقط إلكترونًا واحدًا برابط تساهميّ.
البروم Br2(ℓ) هو لافلزّ لديه إلكترون واحد غير مُزدوَج، يشارِك فقط إلكترونًا واحدًا برابط تساهميّ.
- ما هي صيغة الناتج؟
- عنصر النيتروجين، N2(g)، يتفاعل مع العنصر المُشار إليه بالحرف b، ونحصل على ناتج واحد وهو غاز. هذا الناتج يتفاعل مع الماء ويكوّن محلولًا قاعديًّا.
- صيغوا التفاعُل للحصول على الناتج.
الإجابة:
ناتج التفاعُل بين b – H2(g) وبين N2(g) هوNH3(g) ، مادّة جُزَيئيّة.
الهيدروجين H2(g) هو لافلزّ لديه إلكترون واحد غير مُزدوَج، يشارِك فقط إلكترونًا واحدًا برابط تساهميّ.
النيتروجين N2(g) هو لافلزّ لديه ثلاث إلكترونات غير مُزدوَجة، يشارك ثلاث إلكترونات برابط تساهميّ.
صياغة التفاعُل:
N2(g) + 3H2(g) → 2NH3(g)
- صيغوا التفاعُل للحصول على الناتج.
- عنصر النيتروجين، N2(g)، يتفاعل مع العنصر المُشار إليه بالحرف a، ونحصل على ناتج واحد.
اكتبوا صيغة الناتج بدرجة حرارة الغرفة.
الإجابة:
الناتج الذي نحصل عليه بين a – Na(s) وبين N2(g) هو Na3N(s) ، مادّة أيونيّة.
الصوديوم Na(s) هو فلزّ من العمود الأوّل يتحوّل لأيون شحنته 1+.
النيتروجين N2(g) هو لافلزّ من العمود الخامس يتحوّل لأيون شحنته 3-.
- البنود أ-د في الجدول الذي أمامكم تعرض مُعطيات حول أربع ذرّات مختلفة.
في أيّ من البنود تتطابق المعلومات المُعطاة بشكل كامل؟موقِع ذرّة العنصر
في قائمة العناصر الدوريّةرتيب
الإلكتروناتصيغة التمثيل
الإلكترونيّالعمود السطر أ 7 2 2,7 
ب 3 2,2,2 
ج 2 2,8,3 
د 4 2 2,4 
الشرح
للعنصرمستويان من الطاقة المعبّأة بالإلكترونات بحسب ترتيب الإلكترونات المُعطى، ولذلك هو موجود في السطر الثاني ولديه 4 إلكترونات تكافؤ بحسب صيغة التمثيل الإلكترونيّ الخاصّة به ولذلك يقع العنصر في العمود الرابع. - أمامكم الصيَغ الجُزَيئيّة لأربع جُزَيئات: CS2, C2H2, C2Cℓ2, CO2.
مبنى كلّ واحدة من الجُزَيئات هو خطّي.
ما هي الجُملة الصحيحة؟- في كلّ واحدة من الجُزَيئات المُعطاة يوجد رابط تساهميّ أحاديّ.
- فقط في اثنتان من الجُزَيئات المُعطاة توجد أربطة تساهميّة ثنائيّة.
- الرابط بين ذرّة الكربون وذرّة الكبريت في الجُزَيء CS2 أكثر قطبيّةً الرابط بين ذرّة الكربون وذرّة الأكسجين في الجُزَيء CO2.
- الروابط بين ذرّات الكربون في الجُزَيء C2H2 هي روابط تساهميّة نقيّة، لكن الجُزَيء قطبيّ.
الشرح
بحسب التمثيل الكامل للصيغة البنائيّة للجُزَيئات الأربعة يمكن أن نلاحظ أنّ هناك روابط تساهميّة ثنائيّة في اثنين من الجُزَيئات فقط.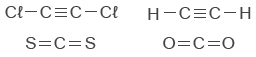
- من بين الجُزَيئات أ-د التي أمامكم، أيّ جُزَيء يمكنه تكوين روابط هيدروجينيّة مع جُزَيئات الماء، H2O ومع جُزَيئات الأستون CH3COH3؟
- CH3CH2OCH2CH3
- CH3CH(OH)CH2CH3
- CH3CH2CHFCH2CH3
- (CH3)2CHF
الشرح
بين جُزَيئات المادّة ب توجد أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. ولذلك، يمكن ان تتكوّن روابط هيدروجينيّة بين جُزَيئاته وجُزَيئات الماء ويمكن أن تتكوّن روابط هيدروجينيّة بين جُزَيئات المادّة ب (التي تحتوي على ذرّة هيدروجين مكشوفة من الإلكترونات في مجموعة OH) وبين جُزَيئات الأستون (مع زوج إلكترونات غير رابط على ذرّة الأكسجين في جُزَيء الأستون. - درجة غليان الماء، H2O(ℓ) أعلى من درجة غليان كبريتيد الهيدروجين H2S(ℓ).
ما هو السبب الرئيسيّ لذلك؟- سحابة إلكترونات جُزَيء كبريتيد الهيدروجين أكبر من سحابة إلكترونات جُزَيء الماء.
- التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات كبريتيد الهيدروجين في الحالة السائلة أضعف من التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات الماء في الحالة السائلة.
- بين جُزَيئات كبريتيد الهيدروجين في الحالة السائلة توجد أساسًا تأثيرات مُتبادلة ڤان در ڤالس، بينما بين جُزَيئات الماء في الحالة السائلة توجد أساسًا روابط هيدروجينيّة.
- الروابط الهيدروجينيّة بين جُزَيئات كبريتيد الهيدروجين في الحالة السائلة أضعف من الروابط الهيدروجينيّة بين جُزَيئات الماء في الحالة السائلة.
الشرح
الروابط الهيدروجينيّة القائمة بين جُزَيئات الماء أقوى من التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات كبريتيد الهيدروجين. وبالتالي يجب بذل طاقة أكبر لتفكيك الروابط الهيدروجينيّة القائمة بين جُزَيئات الماء. لذلك، درجة غليان الماء أعلى.
سؤال 9
- بين جُزَيئات الـ TMA تكون التأثيرات المُتبادلة ڤان در ڤالس أقوى من الروابط الهيدروجينيّة القائمة بين جُزًيئات الأمونيا بسبب الفارق الكبير بينهم في حجم سحابة الإلكترونات (سحابة إلكترونات جُزَيء الـ TMA أكبر بكثير من سحابة إلكترونات الأمونيا). لذلك يتطلّب الأمر طاقة أكثر لتفكيك التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات الـ TMA ودرجة غليانه أعلى.
- بين جُزَيئات الـ DMA توجد تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة ولكن سحابة إلكترونات جُزَيء الـ DMA أصغر من سحابة إلكترونات جُزَيء الـ TMA الذي توجد بين جُزَيئاته تأثيرات مُتبادلة ڤان در ڤالس. الدمج بين الروابط الهيدروجينيّة والتأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات الـ DMA يساوي في شدّته التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات الـ TMA ولذلك الطاقة المطلوبة لتفكيك الأربطة بين جُزَيئات الـ DMA والطاقة المطلوبة لتفكيك الأربطة بين جُزَيئات الـ TMA مُماثلة ولذلك درجة غليانها قريبة من بعضها البعض.
- بين جُزَيئات الماء وجُزَيئات الإيثيلين لا تتكوّن أربطة هيدروجينيّة أو تأثيرات متبادلة ڤان در ڤالس، ولذلك الإيثيلين لا يذوب في الماء.
10. مبنى الذرّة، المبنى والترابط
- א
- Z هو نظير الكبريت. النظائر هي ذرّات لها نفس عدد البروتونات (العدد الذرّيّ) ولكن لها عدد مختلف من النيوترونات.
الذرّة الوحيدة التي تحتوي على 16 بروتونًا هي ذرّة Z. - S 2, 8, 6
- Z هو نظير الكبريت. النظائر هي ذرّات لها نفس عدد البروتونات (العدد الذرّيّ) ولكن لها عدد مختلف من النيوترونات.
- ב
- الروابط بين ذرّات الـ S هي روابط نقيّة، الفارق في قيَم السالبيّة الكهربائيّة بين الذرَات في هذه الأربطة هو 0.
- تحتوي ذرّة الكبريت على إلكترونين غير مُزدوَجين ولذلك تشارك 2 إلكترونات. بما أنّ كلّ ذرّة كبريت مرتبطة بذرّتّي كبريت أخرى، فإنها تُكوّن رابطين تساهميّين أحاديّين، تكوّن ذرّة الكبريت مع كلّ ذرّة كبريت أخرى زوجًا واحدًا فقط من الإلكترونات المشتركة، رابط تساهميّ أحاديّ.
- سحابة الإلكترونات في جُزَيء الكبريت أكبر من سحابة الإلكترونات في جُزَيء الفوسفور ولذلك التأثيرات المُتبادلة ڤان در ڤالس بين جُزَيئات الكبريت أقوى وتحتاج إلى طاقة أكبر لتفكيك الأربطة بين جُزَيئات الكبريت.
- بين جُزَيئات الكبريت وجُزَيئات الهكسان تتكوّن تأثيرات متبادلة ڤان در ڤالس. لذلك يذوب الكبريت في الهكسان.
- Na2S(s)

- 16Na(s) + S8(s) → 8Na2S(s)
- ה
- S8(s) + 8O2(g) → 8SO2(g)

- 16Na(s) + S8(s) → 8Na2S(s)
- S8(s) + 8O2(g) → 8SO2(g)
13. الأكسدة والاختزال، المبنى والترابط
- א
- اللفّة النحاسيّة موصِلة للكهرباء لأنّه في النحاس الصلب توجد إلكترونات حرّة الحركة.
- محلول نترات الفضّة موصِل للكهرباء لأنّه يحتوي على أيونات مميّأة وحرّة الحركة في المحلول.