قطبيّة الجُزَيء
في فصل قُطبيّة الرابط، تحدّثنا عن قُطبيّة رابط واحد. هناك جُزَيئات تحتوي على رابط واحد فقط، لكن هناك جُزَيئات تحتوي على عدّة روابط.
- كيف نحدّد ما إذا كان مجمل كلّ الروابط في جُزَيء معيّن، سيكوِّن جُزَيئًا قطبيًّا أو ليس قطبيًّا؟
- هل سيحدُث عدم تماثُل في سحابة الإلكترونات في الجُزَيء، ممّا يعني أنّ الجُزَيء قطبيّ، أم أنّه لن عدم تماثُل في سحابة الإلكترونات، وبالتالي سيكون الجزيء غير قطبيّ؟
للإجابة عن هذه الأسئلة، نُشير إلى ما يلي:
أأوّلاً، يجب أنّ نفهم أن قطبيّة الرابط التساهميّ (الكوفالنتيّ) تتميّز بمقدار واتّجاه. المقدار هو درجة القطبيّة التي تُحدَّد بناءً على الفرق في قيَم السالبيّة الكهربائيّة بين الذرّات في الرابط، والاتّجاه يُشير إلى اتّجاه القطبيّة. البارامتر (مثل القوّة) الذي له مقدار واتّجاه، يسمّى “مُتَّجَه” (فيكتور).
من خلال حسابات رياضيّة، يمكن جمع كلّ المتّجهات (القوى العاملة) للروابط في الجُزَيء. إذا كان مجموع مُتَّجَهات القطبيّة 0، فإنّ الجُزَيء ليس قطبيًّا. إذا كان مجموع مُتَّجَهات القطبيّة لا يساوي 0، فإنّ الجُزَيء قطبيّ.
بما أنّ هذه الحسابات معقّدة، سنتعلّم كيفيّة تحديد ما إذا كان الجُزَيء قطبيًّا أو ليس قطبيًّا، بحسب مبناه الهندسيّ.
في الحالات البسيطة، عندما يكون المبنى الهندسيّ للجُزَيء متماثلًا، فإنّ الجُزَيء ليس قطبيًّاـ ولن يحدُث عدم تماثُل في سحابة الإلكترونات. إذا كان الجُزَيء غير مُتماثل، سيحدُث عدم تماثُل في سحابة الإلكترونات، وبالتالي قطبيّ دائم. الجُزَيء سيكون قطبيًّا.
لكي نُحدّد ما إذا كان الجُزَيء قطبيًّا أو ليس قطبيًّا بحسب مبناه الهندسيّ، يجب أن نتعرّف على مصطلح جديد: الصيغة البنائيّة للجُزَيء.
الصيغة البنائيّة تصِف الروابط بين الذرّات في الجُزَيء.
عند كتابة الصيغة البنائيّة، لا حاجة لكتابة أزواج الإلكترونات غير الرابطة.
في الدروس القادمة، سنُميّز بين كتابة الصيغة البنائيّة بتمثيل كامل أو بتمثيل مختصر.
االصيغة البنائيّة تُوضّح كيف ترتبط الذرّات ببعضها في مبنى الجُزَيء، وتُمكّننا من معرفة المبنى الهندسيّ للجُزَيء. في الصيغة البنائيّة، نُشير إلى كلّ زوج إلكترونات رابطة بخطّ. لا حاجة لكتابة أزواج الإلكترونات غير الرابطة في الجُزَيء.
فيما يلي مثال على الصيغة البنائيّة لحامض الهيدروكلوريك:H–Cℓ بدلًا من HCℓ
سنتعرّف الآن على خمسة مبانٍ هندسيّة تُمثّل جُزَيئًا مكوّنًا من ذرّة مركزيّة واحدة، وسنفحص ما إذا كان الجُزَيء الذي نحصل عليه في كلّ واحد من المباني الهندسيّة قطبيًّا أو ليس قطبيًّا.
المبنى الهندسيّ، أو بكلمات أخرى شكل الجُزَيء الذي نحصل عليه، يُحدَّد بحسب عدد الذرّات المرتبطة بالذرّة المركزيّة، وبحسب أزواج الإلكترونات غير الرابطة حول الذرّة المركزيّة والتنافُر بينها.
المبنى الهندسيّ (الشكل) الذي نحصل عليه هو الشكل الذي تكون فيه درجة التنافُر بين أزواج الإلكترونات غير الرابطة وأزواج الإلكترونات الرابطة، هي الأصغر.
في النماذج التالية، حاولنا كتابة الصيَغ البنائيّة على شكل نموذج فراغيّ وليس شكلًا مستويًا وثنائيّ الأبعاد.
تجدر الإشارة أيضًا إلى أنّه إذا طُلب منّا في أيّ سياق أن نرسم الصيغة البنائيّة (بتمثيل كامل) لمادّة معينة، فلا حاجة للتقيُّد بالمبنى الهندسيّ الدقيق لها، بل يكفي أن نصف بالشكل الصحيح الروابط بين الذرّات المختلفة في جُزَيْء المادّة.
يتميّز المبنى بذرّة مركزيّة مرتبطة بأربع ذرّات.
مثال على جُزَيء له مبنى تتراهيدر: CH4
وصف المبنى من خلال نوعَين من النماذج: نموذج مالئ الفراغ (الأيمن) ونموذج عصا-كرة (الأيسر)
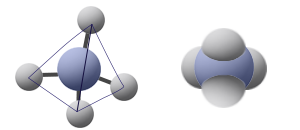
كِلا النموذجَين، مالئ الفراغ (الأيمن) وعصا-كرة (الأيسر)، مُشتقّان من نوع الذرّات في الجُزَيء. لكلّ واحدة من الذرّات، كما في لعبة الليجو، أشكال ارتباط خاصة بها. لكلّ نموذج مميّزاته في تمثيل وتوضيح الجُزَيء.
الذرّة المركزيّة مرتبطة بأربع ذرّات، التي تبعُد عن بعضها البعض إلى أقصى درجة ممكنة. عمليًّا، ، الزاوية التي تتكوّن بين كل ثلاث ذرّات هي 109° تقريبًا.
هناك حالتان ممكنتان:
- إذا كانت الذرّات حول الذرّة المركزيّة متطابقة، كما في CH4، سيكون المبنى متماثلًا، وبدون عدم تماثُل دائم في سحابة الإلكترونات. لذلك، الجُزَيء لن يكون قطبيًّا، حتى وإن كان الرابط C-H قطبيًّا.
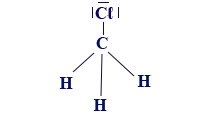
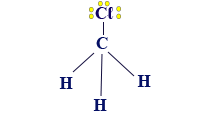
- إذا كانت الذرّات حول الذرّة المركزيّة غير متطابقة، كما في CH3Cℓ، لن يكون المبنى متماثلًا، وسيحدُث عدم تماثُل في سحابة الإلكترونات في الجُزَيء. الجُزَيء سيكون قطبيًّا، وله ثنائيّ تقاطُب دائم.
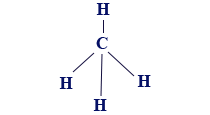
إذا أردنا أن نصف الصيغة البنائيّة لجُزَيء CH4 وأن نحاول وصف مبناه الهندسيّ بأدقّ صورة ممكنة، نكتب الصيغة البنائيّة للجُزَيء CH4 على النحو التالي:
- CH4
- CH3Cℓ
كلّ خطّ حول ذرّات الكلور (Cℓ) يمثّل زوج إلكترونات غير رابطة. يمكن أيضًا الإشارة إلى أزواج الإلكترونات غير الرابطة بواسطة نقاط، كما فعلنا لغاية الآن. لا حاجة للإشارة إلى أزواج الإلكترونات غير الرابطة في الصيغة البنائيّة.
يتميّز المبنى بذرّة مركزيّة مرتبطة بثلاث ذرّات ولها زوج إلكترونات غير رابطة.
مثال على جُزَيء له مبنى هندسيّ هرم ثلاثيّ: NH3
فيما يلي وصف للمبنى من خلال نوعَين من النماذج: نموذج مالئ الفراغ ونموذج عصا-كرة:
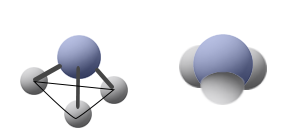
الذرّة المركزيّة مرتبطة بثلاث ذرّات. عند كتابة المبنى، نُشير إلى زوج الإلكترونات غير الرابطة على الذرّة المركزيّة (بالرغم من أنّ ذلك ليس ضروريًا عند كتابة الصيغة البنائيّة).
الجُزَيء الذي له مبنى هرم ثلاثيّ، يكون قطبيًّا، ويحدُث فيه دائمًا عدم تماثُل في سحابة الإلكترونات.
إذا أردنا أن نصف الصيغة البنائيّة لجُزَيء NH3 وأن نحاول وصف مبناه الهندسيّ بأدقّ صورة ممكنة، نكتب الصيغة البنائيّة للجُزَيء NH3 على النحو التالي:
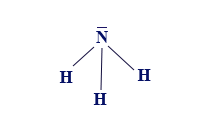
أو
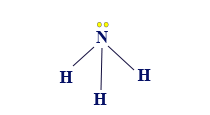
يتميّز المبنى بذرّة مركزيّة مرتبطة بذرّتَيْن. للذرّة المركزيّة يوجد زوج أو زوجان من الإلكترونات غير الرابطة.
مثال على جُزَيء له مبنى زاوية: H2O
فيما يلي وصف للمبنى من خلال نموذج مالئ الفراغ ونموذج عصا-كرة:
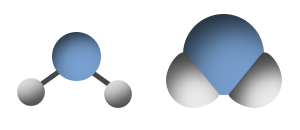
مبنى الزاوية يكون قطبيًّا دائمًا. في سحابة الإلكترونات ينتُج عدم تماثُل دائمًا.
إذا أردنا أن نصف الصيغة البنائيّة لجُزَيء H2O وأن نحاول وصف مبناه الهندسيّ بأدقّ صورة ممكنة، نكتب الصيغة البنائيّة للجُزَيء H2O ב على النحو التالي:
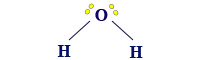
الجُزَيء الذي له مبنى هندسيّ زاوية، يكون قطبيًّا، ويحدُث فيه دائمًا عدم تماثُل في سحابة الإلكترونات.
يتميّز المبنى بذرّة مركزيّة مرتبطة بثلاث ذرّات.
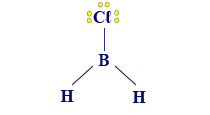
مثال على جُزَيء له مبنى هندسيّ مثلّث مستوٍ: BH3.
فيما يلي وصف للمبنى من خلال نوعَين من النماذج: نموذج مالئ الفراغ ونموذج عصا-كرة:
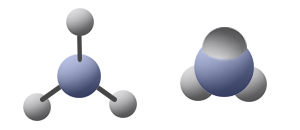
في هذا الجُزَيء هناك حالتان مُمكِنتان:
- إذا كانت الذرّات حول الذرّة المركزيّة متطابقة، كما في BH3، سيكون المبنى متماثلًا، ويشبه المثلّث متساوي الأضلاع/مبنى هندسيّ منتظَم، وبدون تشوُّه دائم في سحابة الإلكترونات. لذلك، الجُزَيء سيكون غير قطبيّ.
- إذا كانت الذرّات حول الذرّة المركزيّة غير متطابقة (كما في BCℓH2)، لن يكون المبنى متماثلًا، وسينتُج عدم تماثُل في سحابة الإلكترونات في الجُزَيء، وسيكون فيه ثنائيّ تقاطُب دائم وسيكون الجُزَيء قطبيًّا.
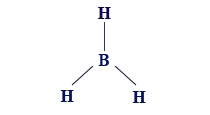
إذا أردنا أن نصِف الصيغة البنائيّة لجُزَيء BH3 وأن نحاول وصف مبناه الهندسيّ بأدقّ صورة ممكنة، نكتب الصيغة البنائيّة للجُزَيء BH3 على النحو التالي:
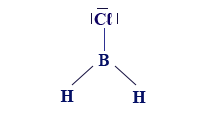
وبالنسبة لجُزَيء BCℓH2 نكتب الصيغة البنائيّة التالية:
أو
نعرض نموذجَين.
- يتميّز المبنى بذرّة مركزيّة مرتبطة بذرّتَيْن.
نحاول أن نشرح: لماذا عندما تكون الذرّة المركزيّة مرتبطة بذرّتَيْن فقط، وليس لها أزواج إلكترونات غير رابطة، سنحصل على مبنى خطّيّ.
بحسب نموذج تنافُر الإلكترونات، سيتكوّن البُعد الأكبر بين أزواج الإلكترونات الرابطة. لذلك سيتكوّن مبنى، فيه كلّ واحدة من الذرّتَين المرتبطتَين بالذرّة المركزيّة تكون على جانب آخر من الذرّة المركزيّة. لكي يكون البُعد بينهما أكبر ما يمكن، يجب أن تكون الزاوية بينهما °180. مثال على جُزَيء له مبنى خطّيّ: CO2 نشير إلى أنّ الروابط الزوجيّة في الجُزَيء CO2 لا تؤثّر على المبنى الهندسيّ للجُزَيء. يُحدَّد مبنى الجُزَيء بحسب عدد الإلكترونات غير الرابطة وعدد الذرّات المرتبطة بالذرّة المركزيّة. وصف المبنى في نموذج عصا-كرة:
في هذا الجُزَيء هناك حالتان ممكنتان:
- إذا كانت الذرّات حول الذرّة المركزيّة متطابقة، كما في CO2، سيكون المبنى متماثلًا، لن يكون هناك عدم تماثُل دائم في سحابة الإلكترونات في الجُزَيء، لذلك سيكون الجُزَيء غير قطبيّ.
- إذا كانت الذرّات حول الذرّة المركزيّة غير متطابقة، كما في CSO، لن يكون المبنى متماثلًا، وسينتُج عدم تماثُل في سحابة الإلكترونات في الجُزَيء، وسيكون فيه ثنائيّ تقاطُب دائم وسيكون الجُزَيء قطبيًّا.
سنشرح في هذا النموذج، لماذا يكون المبنى غير قطبيّ عندما تكون الذرّات حول الذرّة المركزيّة متطابقة، ولماذا يكون المبنى قطبيًّا عندما عندما تكون الذرّات حول الذرّة المركزيّة مختلفة.
الأمر يشبه الشدّ في حبل في وسطه كُرة. إذا شددنا الحبل من كِلا طرفَيه بنفس القوّة لكن باتّجاهَين مختلفَين، لن تتحرّك الكرة في وسط الحبل. لكن، عندما تكون قوّة الشدّ في طرفَيّ الحبل غير متساوية، ستتحرّك الكُرة باتّجاه أحد الطرفَين. كذلك في الجُزَيء الذي له مبنى خطّيّ، عندما تكون الذرّات حول الذرّة المركزيّة متطابقة، تكون قوّة التجاذُب من كِلا الطرفَين متساوية. لذلك لن يحدُث تشوُّه في سحابة الإلكترونات والجُزَيء سيكون غير قطبيّ. عندما تكون الذرّات حول الذرّة المركزيّة مختلفة، سيحدُث تشوُّه في سحابة الإلكترونات، وسيكون المبنى قطبيًّا.
الصيغة البنائيّة لجُزَيء CO2 ستكون على النحو التالي: ولجُزَيء CSO:
ولجُزَيء CSO:
هناك نموذج آخر، وهو نموذج الجُزَيء ثنائيّ الذرّة، الذي فيه ذرّتان فقط.
يوجد في الجُزَيء رابط واحد فقط، لذلك، إذا كان الرابط قطبيًّا سيكون الجُزَيء قطبيًّا، وإذا كان الرابط غير قطبيّ سيكون الجُزَيء غير قطبيّ.
فيما يلي أمثلة: الجُزَيء H2 و- HCℓ
نموذج مالئ الفراغ لجُزَيء الهيدروجين (H2): نموذج عصا-كرة لجُزَيء الهيدروجين (H2):
نموذج عصا-كرة لجُزَيء الهيدروجين (H2):
لكي نُحدِّد ما إذا كان رابط واحد فرديّ قطبيًّا أو غير قطبيّ، نتذكّر الدرس السابق والعلاقة بالسالبيّة الكهربائيّة. عندما يكون هناك فرق في قيَم السالبيّة الكهربائيّة بين الذرّات في الرابط، يكون الرابط قطبيًّا. عندما لا يكون هناك فرق في قيَم السالبيّة الكهربائيّة بين الذرّات في الرابط، يكون الرابط غير قطبيّ. لذلك، الرابط بين ذرّتَيّ الهيدروجين هو رابط غير قطبيّ، وجُزَيء الهيدروجين ليس قطبيًّا. بينما الرابط بين الهيدروجين والكلور هو رابط قطبيّ، لذلك الجُزَيء H—Cℓ قطبيّ.
تجدر الإشارة إلى أنّه يجب عليكم معرفة مباني الجُزَيئات، لكن لا حاجة لحفظ أسمائها عن ظهر قلب. في الأسئلة التي يُطلب منكم التطرّق إلى مبنى الجُزَيء، سيكون اسم المبنى معطى لكم.
سؤال كمثال
أيٌّ من بين الجُزَيئات التالية قطبيّ:
| الجُزَيء | CF4 | H2S | HF | BF3 |
| شكل الجُزَيء | تتراهيدر (هرم رباعيّ) | زاوية | خطّيّ | مثلّث مستوٍ |
جُزَيء CF4 ليس قطبيًّا. الجُزَيء يكوّن مبنًى متماثلًا سحابة الإلكترونات تكون مُتماثلة، لذلك الجُزَيء غير قطبيّ. فيما يلي تفسير إضافي غير مطلوب في السؤال: للجُزَيء مبنى فيه أربع ذرّات متطابقة حول الذرّة المركزيّة، لذلك يتكوّن المبنى المتماثل وغير.
قطبيّ.زَيء H2S له مبنى زاوية، وفيه يوجد للذرّة المركزيّة زوجان من الإلكترونات غير الرابطة، وذرّتان مرتبطتان بها. هذا المبنى يكون قطبيًّا دائمًا. لن يكون متماثلًا وسينتُج عدم تماثُل في سحابة الإلكترونات دائمًا.
جُزَيء H–F قطبيّ. في الجُزَيء ثنائيّ الذرّات، الذي فيه ذرّتان مختلفتان، الرابط قطبيّ بسبب الفرق في قيَم السالبيّة الكهربائيّة. لهذا السبب، سينتُج عدم تماثُل في سحابة الإلكترونات، ويكون الجُزَيء قطبيًّا.
جُزَيء BF3 ليس قطبيًّا. له مبنى متماثل، مثلّث مستوٍ، ولا ينتُج عدم تماثُل في سحابة الإلكترونات، لذلك فهو غير قطبيّ.
يمكن التعميم والقول إنّ كلّ جُزَيء له ذرّة مركزيّة واحدة، وللذرّة المركزيّة يوجد زوج أو أزواج إلكترونات غير رابطة، سيكون قطبيًّا. انتبهوا إلى أنّ هذا التعميم هو بمثابة أداة مساعِدة وليس تفسيرًا.
في الجُزَيئات التي لا يوجد فيها للذرّة المركزيّة زوج أو أزواج إلكترونات غير رابطة، نُحدّد قطبيّة الجُزَيء بحسب الذرّات المرتبطة بالذرّة المركزيّة. إذا كانت متطابقة، يكون الجُزَيء غير قطبيّ. إذا كانت مختلفة، يكون الجُزَيء قطبيًّا، وهذا يشمل أيضًا الجُزَيئات ثنائيّة الذرّات.
المخطّط التالي يساعدنا على التحديد ما إذا كان الجُزَيء، الذي فيه ذرّة واحدة مركزيّة، قطبيًّا أو غير قطبيّ. تذكّروا أنّ ذلك ليس تفسيرًا أو شرحًا لقطبيّة الجُزَيء، بل أداة مساعِدة لتحديد ومعرفة الحقيقة نفسها.
تفسير قُطبيّة الجُزَيء يُكتَب على النحو التالي:
- إذا حدّدنا أنّ الجُزَيء قطبيّ نكتب في التفسير أنّ للجُزَيء المعطى مبنى غير متماثل. لذلك، يحدُث عدم تماثُل في سحابة الإلكترونات، ولذلك فهو قطبيّ.
- إذا حدّدنا أنّ الجُزَيء غير قطبيّ نكتب في التفسير أنّ للجُزَيء المعطى مبنى متماثل. لذلك، تكون سحابة الإلكترونات مُتماثلة، ولذلك فهو غير قطبيّ.
في جميع الأحوال، علينا أن نتذكّر أنّ مخطّط فحص قُطبيّة الجُزَيء، هو أداة مساعِدة فقط للتحديد وليس للتفسير.
سؤال للتمرين
معطى الجُزَيء CF2S.
لهذا الجُزَيء مبنى هندسيّ مثلّث مستوٍ.
- اكتبوا صيغة التمثيل الإلكترونيّ للجُزَيء والتمثيل الكامل للصيغة البنائيّة. اكتبوا أيّ روابط تساهميّة (كوفالنتيّة) توجد في الجُزَيء (بين أيّ ذرّات، مثلًا C—C. هذا مثال فقط… الرابط غير موجود في هذه المادّة).
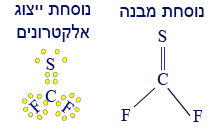
في الجُزَيء المعطى توجد الروابط التالية: C—F ، C═S.
- أيّ رابط هو الأكثر قطبيّةً من بين الروابط التي ذكرتموها في البند السابق؟ اشرحوا السبب!
الرابط الأكثر قطبيّةً هو الرابط C—F لأنّ الفرق في قيَم السالبيّة الكهربائيّة في هذا الرابط هو الأكبر من بين الاثنين.
- هل يمكن أن نُحدِّد أيّ رابط هو الأقوى من بين الروابط التي ذكرتموها في البند “أ”؟ اكتبوا ما هو العامل أو العوامل التي تُفسِّر لماذا هذا الرابط هو الأقوى.
الرابط S=C هو رابط زوجيّ، بينما الرابط C–F هو رابط فرديّ (رتبة الرابط). بحسب هذا العامل، كان من المفترض أن نحدّد أنّ الرابط S=C أقوى من الرابط C–F.
بالمقابل، الرابط C–F قطبيّ بينما الرابط S=C غير قطبيّ، كما وأنّ لذرّة الفلور (F) في الرابط C–F يوجد نصف قُطر أصغر من نصف قُطر ذرّة الكبريت (S) في الرابط S=C. بحسب هذه العوامل، كان من المفترض أن نُحدِّد أنّ الرابط C–F أقوى من الرابط S=C.
لذلك، لا يمكن أن نحدّد بالتأكيد أيّ رابط هو الأقوى.
- هل الجُزَيء CF2S له ثنائيّ تقاطُب دائم أو لحظيّ؟ علِّلوا إجابتكم!
للجُزَيء مبنى غير متماثل، لذلك له ثنائيّ تقاطُب دائم، لأنّ فيه عدم تماثُل في سحابة الإلكترونات.
