أسئلة تلخيصيّة المبنى والترابط
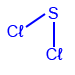
- الكلوريدات هي موادّ ناتجة عن التفاعُل بين العنصر Cℓ2(g) وعنصر آخر.
- اكتبوا الصيغة الجُزَيئيّة للكلوريد الناتج من التفاعُل بين الكلور والكبريت (S8(s)).
نظرًا لأنّ ذرّات الكلور تتشارك إلكترونًا واحدًا في رابط تساهميّ (يحتوي الكلور على إلكترون واحد غير مُزدوَج / يفتقر إلى إلكترون واحد لإكمال المستوى الأخير بالكامل)، بينما تتشارك ذرّات الكبريت إلكترونين (تحتوي ذرّات الكبريت على إلكترونَين غير مُزدوَجين / يفتقران إلى إلكترونَين لإكمال المستوى الأخير بالكامل)، فإنّ الصيغة الجُزَيئيّة الناتجة للكلوريد هي:
Cℓ2S
- اكتبوا صيغة التمثيل الإلكترونيّ للكلوريد الناتج من التفاعُل بين الكلور والكبريت.
- اكتبوا تمثيلًا كاملًا للصيغة البنائيّة للكوريد الناتج بين الكلور والكبريت.
للتذكير، عند كتابة الصيغة البنائيّة لا حاجة لكتابة أزواج الإلكترونات غير الرابطة
- هل يحتوي الكلوريد الناتج من تفاعُل الكلور والكبريت على أربطة تساهميّة أحاديّة، ثُنائيّة أم ثُلاثيّة؟
للكلوريد الناتج من التفاعُل بين الكلور والكبريت درجة انصهار -121°C ودرجة غليان 59°C.
- صيغوا ووازِنوا التفاعُل الذي يحدُث بين الكلور والكبريت في درجة حرارة الغرفة.
8Cℓ2(g) + S8(s) → 8Cℓ2S(ℓ)
- درجة غليان الكلوريد الناتج من التفاعُل بين الكلور والكبريت أعلى من درجة غليان الـ Cℓ2O. اشرحوا السبب.
الكلوريدات المُعطاة هما مادّتان جُزَيئيّتان وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس. لجُزَيئات الكلوريد Cℓ2S سحابة إلكترونات أكبر، وبالتالي هناك إمكانيات أكثر لتكوين قوى ثنائيّ القطب على الجُزَيئات، وتكون الشحنات الجُزئيّة الناتجة أكبر، ولذلك تكون التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الكلوريد Cℓ2S أقوى. نظرًا لذلك، نحتاج إلى طاقة أكبر لتفكيك هذه التأثيرات المتبادلة وبالتالي فإنّ درجة غليان المادّة Cℓ2S أعلى.
- حدّدوا ما هي الروابط التساهميّة الموجودة في كلّ من الكلوريدات (على سبيل المثال: H—C. هذا الرابط غير موجود طبعًا في الكلوريدات المُعطاة). حدّدوا أيّ رابط تساهميّ هو الأقوى. اذكروا العامل أو العوامل التي تدعم إجابتكم.
الرابط التساهميّ الموجود في الكلوريد Cℓ2S هو: Cℓ—S.
الرابط التساهميّ الموجود في الكلوريد Cℓ2O هو: Cℓ—O.
الرابط الأقوى هو الرابط Cℓ—O. العامل الذي يفسّر هذه الحقيقة هو:
نصف قُطر ذرّة الأكسجين (O) أصغر من نصف قُطر ذرّة الكبريت (S) وبالتالي فإنّ البُعد بين الأنوية والإلكترونات في الرابط Cℓ—O أصغر، والتجاذب الكهربائيّ بين الأنوية وإلكترونات الرابط أقوى.
- للكلوريد الناتِج من التفاعُل بين الكلور والكبريت ذائبيّة جيّدة في ثاني كبريتيد الكربون (CS2(ℓ)).
- فسّروا لماذا يتمتّع الكلوريد بذائبيّة جيّدة في ثاني كبريتيد الكربون؟
المادّتان: Cℓ2S و- CS2 هما موادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس، لذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئاتها، ممّا يعني أنّ المادّة Cℓ2S تذوب في المادّة CS2
- صيغوا معادلة عمليّة إذابة الكلوريد في ثاني كبريتيد الكربون.
- حدّدوا ما إذا كان المحلول موصلًا للتيّار الكهربائيّ. علِّلوا إجابتكم.
- الفوسفيدات هي موادّ ناتجة من التفاعُل بين عنصر الفوسفور (P4(s)) وعنصر آخر.
- اكتبوا الصيغة الجُزَيئيّة للفوسفيد الناتج من التفاعُل بين عنصر الفوسفور وعنصر اليود (I2(s)).
نظرًا لأنّ ذرّات اليود تشارك إلكترونًا واحدًا في رابط تساهميّ (يحتوي اليود على إلكترون واحد غير مُزدوَج / يفتقر إلى إلكترون واحد لإكمال المستوى الأخير)، بينما تشارك ذرّات الفوسفور 3 إلكترونات (لذرّات لفوسفور 3 إلكترونات غير مُزدوَجة / تفتقر إلى 3 إلكترونات لإكمال المستوى الأخير)، الصيغة الجُزَيئيّة للكلوريد الناتج هي
PI3
- اكتبوا صيغة التمثيل الإلكترونيّ للفوسفيد الناتج من التفاعُل بين الفوسفور واليود.
- اكتبوا تمثيلًا كاملًا للصيغة البنائيّة للفوسفيد الناتج بين الفوسفور واليود.
للتذكير، عند كتابة الصيغة البنائيّة لا حاجة لكتابة أزواج الإلكترونات غير الرابطة

- هل في الفوسفيد الناتج بين الفوسفور واليود توجد روابط تساهميّة أحاديّة، ثُنائيّة أم ثُلاثيّة؟
في الفوسفيد، الذي كتبنا صيغته الجُزَيئيّة في البند أ توجد أربطة أحاديّة فقط.
للفوسفيد الناتج من التفاعُل بين الفوسفور واليود درجة انصهار 61.2°C ودرجة غليان 200°C.
- صيغوا ووازِنوا التفاعُل الذي يحدُث بين الفوسفور واليود في درجة حرارة الغرفة.
6I2(s) + P4(s) → 4PI3(s)
- فوسفيد آخر هو PN. حدّدوا ما إذا كانت الطاقة التي نحتاجها لتفكيك الرابط التساهميّ بين ذرّات النيتروجين (N) وذرّات الفوسفور (P) في الجُزَيء PN أكبر، أصغر أم مُساوية للطاقة التي نحتاجها لتفكيك الرابط التساهميّ بين ذرّة فوسفور وذرّة يود في الفوسفيد الذي الذي كتبنا صيغته الجُزَيئيّة في البند أ.
الرابط التساهميّ بين ذرّات الفوسفور وذرّات اليود في المادةّ PI3 هو رابط أحاديّ.
الرابط بين ذرّات الفوسفور وذرّات النيتروجين في المادةّ PN هو رابط ثُلاثيّ. أيّ أنّ رُتبة الرابط أكبر في الرابط بين ذرّات النيتروجين والفوسفور في المادّة PN.
لذرّة النيتروجين نصف قُطر أصغر من ذرّة اليود. لذلك، البُعد بين الأنوية وإلكترونات الرابط، في الرابط بين ذرّات النيتروجين وذرّات الفوسفور، أصغر.
الرابط بين ذرّات النيتروجين وذرّات الفوسفور أكثر قُطبيّة (الفارِق في قِيَم السالبيّة الكهربائيّة بين الذرّات في الرابط بين النيتروجين والفوسفور أكبر).
لذلك، يمكن تحديد أنّ الرابط بين ذرّات النيتروجين وذرّات الفوسفور أقوى. بالتالي، نحتاج إلى طاقة أكبر لتفكيك الرابط التساهميّ بين ذرّات الفوسفور وذرّات النيتروجين.
- الفوسفيد الناتِج من التفاعُل بين الفوسفور واليود يكون في الحالة الصلبة بدرجة حرارة الغرفة. بينما المادّة PH3 تكون في الحالة الغازيّة بدرجة حرارة الغرفة. اشرحوا السبب.
الفوسفيدات PI3 و- PH3 هي موادّ جُزَيئيّة توجد بين جُزَيئاتها التأثيرات المتبادلة ڤان در ڤالس.
لجُزَيئات الفوسفيد PI3 سحابة إلكترونات أكبر (هناك إمكانيات أكثر لتكوين قوى ثنائيّ القطب على الجُزَيئات، وتكون الشحنات الجُزئيّة الناتجة أكبر)، ولذلك، تكون التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات PI3 أقوى. لا توجد طاقة كافية بدرجة حرارة الغرفة لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات PI3 ولذلك تكون المادّة صلبة. للمادّة PH3 سحابة إلكترونات أصغر (هناك إمكانيات أقلّ لتكوين قوى ثنائيّ القطب على الجُزَيئات، وتكون الشحنات الجُزئيّة الناتجة أقلّ)، ولذلك، تكون التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات PI3 ضعيفة. في درجة حرارة الغرفة توجد طاقة كافية لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات PH3 ولذلك تكون المادّة غازيّة بدرجة حرارة الغرفة.
- الفوسفيد الناتج من التفاعُل بين الفوسفور واليود له ذائبيّة ضئيلة جدًا (لا يذوب) في الماء (H2O(ℓ)). اشرحوا السبب.
الفوسفيد PI3 هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة. لا تتكوّن تأثيرات مُتبادلة بين جُزَيئات الـ PI3 وبين جُزَيئات الماء. لذلك، المادّة PI3 لا تذوب في الماء.
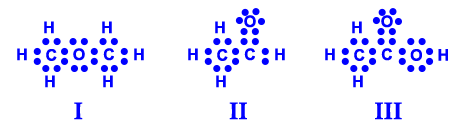
- أمامكم صِيَغ بنائيّة لثلاث موادّ:
III II I CH3COOH CH3CHO CH3OCH3
- اكتبوا صيغة التمثيل الإلكترونيّ لكلّ واحدة من الجُزَيئات.
- حددوا لكلّ جُزَيء من الجُزَيئات المُعطاة المجموعة الوظيفيّة الموجودة فيه.
تحتوي المادّة I على مجموعة إثير.
تحتوي المادّة II على مجموعة ألديهيد.
تحتوي المادّة III على مجموعة حامض كربوكسيلي.
| المادّة | درجة الانصهار (C°) | درجة الغليان (C°) | الذائبيّة في الماء H2O |
| L | 16 | 118 | + |
| M | 141- | 24- | + |
| N | 123- | 20 | + |
- لائموا الموادّ المُعطاة I-III للموادّ الموجودة في الجدول N,M,L.
- المادّة المناسبة لحرف L لديها أعلى درجة غليان. علِّلوا إجابتكم.
المادّة المُطابقة للحرف L هي CH3COOH. لهذه المادّة درجة الغليان الأعلى بسبب وجود أربطة هيدروجينيّة بين جُزَيئاتها، بالإضافة إلى تأثيرات متبادلة ڤان در ڤالس. بما أنّ سحابة الإلكترونات في الموادّ الثلاثة مُتشابهة إلى حدّ ما (ثمّة اختلافات صغيرة في سحابة الإلكترونات)، فإن وجود أربطة هيدروجينيّة بين جزيئات المادّة CH3COOH (بالإضافة إلى التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات هذه المادّة) يجعل الأربطة بين جُزَيئاتها الأكثر قوّة. لذلك، نحتاج إلى أعلى قدر من الطاقة لتفكيك الروابط الهيدروجينيّة والتأثيرات المتبادلة ڤان در ڤالس، وبالتالي فإنّ درجة غليانها هي الأعلى.
- حدّدوا ما إذا كانت الموادّ I و- II إيزوميرات. علِّلوا إجابتكم.
الموادّ I ו- II ليست إيزوميرات لأنّها لا تمتلك الصيغة الجُزَيئيّة ذاتها. الإيزوميرات هي موادّ لها نفس الصيغة الجُزَيئيّة لكن صيغتها البنائيّة مختلفة.
- للمادّة رقم I إيزومير يحتوي على مجموعة وظيفيّة مختلفة. ما هي المجموعة الوظيفيّة لإيزومير المادّة I؟
- للمادّة I ذائبيّة جيّدة في الماء.
- صيغوا عمليّة الإذابة في الماء للمادّة I.
وفقًا لمطابقة الموادّ المُعطاة مع الموادّ في الجدول، يمكن ملاحظة أنّ المادّة I تكون في الحالة الغازيّة بدرجة حرارة الغرفة، وبالتالي فإنّ صياغة عملية الإذابة في الماء تكون كالتالي:
- حدّدوا ما إذا كان المحلول موصلًا للتيّار الكهربائيّ. علِّلوا إجابتكم.
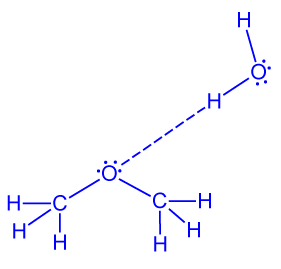
- ارسموا رابطًا يتكوّن بين جُزَيء من المادّة I وبين جُزَيء من الماء.
- صِفوا على المستوى الميكروسكوبيّ المحلول المائي للمادّة I.
المحلول الناتج يحتوي على جُزَيئات من الماء وجُزَيئات من CH3OCH3.
بين جُزَيئات الماء وجُزَيئات CH3OCH3 توجد أربطة هيدروجينيّة وبين جُزَيئات الماء أيضًا توجد أربطة هيدروجينيّة (من المحتمل أن تتكوّن أيضًا تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات المادّة CH3OCH3 ولكنّها ستكون ضئيلة جدًا)
تتكوّن أربطة هيدروجينيّة بين ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيئات الماء التي تحمل شحنة جزئية موجبة كبيرة، وزوج من الإلكترونات غير الرابطة الموجود على ذرّة الأوكسجين، سواء في جُزَيء ماء آخر أو في جُزَيء CH3OCH3 .
لجزيئات المادّة حركة دوران وتذبذُب. جسيمات المادّة متراصّة ومنظّمة نسبيًا مقارنةً بالحالة الغازيّة ولكن أقلّ من الحالة الصلبة.
- حدّدوا ما هو السبب أو الأسباب التي تجعل طاقة (إنتالبيا) الرابط C=O أكبر من طاقة (إنتالبيا) الرابط C–O.
- أمامكم جدول بقائمة موادّ يشمل أيضًا درجات انصهار وغليان الموادّ:
المادّة درجة
الانصهار
(C°)درجة
الغليان
(C°)التوصيل
الكهربائيّ
في الحالة السائلةUCℓ3 837 1657 N2H4 2 104 ℓNH4C 235 452 C10H20 30- 173 U 1405 4091 NH3 77- 33-
- صنِّف الموادّ المُعطاة بحسب نوع الشبكة (أيونيّة، ذرّيّة، فلزّيّة، جُزَيئيّة).
| الموادّ الأيونيّة | NH4Cℓ , UCℓ3 |
| الفلزّات | U |
المواد | NH3, C10H20 , N2H4 |
- درجة غليان المادّة NH3 أقلّ من درجة غليان المادّة N2H4. اشرحوا السبب.
المادّتان NH3 و- N2H4، هما موادّ جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة.
للمادّة- N2H4 توجد أكثر مراكز (إمكانيات) لتكوين روابط هيدروجينيّة بين الجُزَيئات، لذلك بين جُزَيئات الـ N2H4 ستتكوّن روابط هيدروجينيّة أكثر. سيكون من الأصعب تفكيك هذه الروابط الهيدروجينيّة. سنحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات N2H4 ولذلك درجة غليان الـ N2H4 تكون أعلى.
- درجة غليان المادّة C10H20 أعلى من درجة غليان المادّة N2H4. اشرحوا السبب.
المادّتان هما مادّتان جُزَيئيّتان. بين جُزَيئات المادّة N2H4 توجد أربطة هيدروجينيّة. بين جُزَيئات المادّة C10H20 توجد تأثيرات متبادلة ڤان در ڤالس. نظرًا لوجود فرق كبير في كِبَر سحابة الإلكترونات بين الجُزَيئات (للجُزَيء C10H20 سحابة إلكترونات فيها 80 إلكترونًا، بينما لجُزَيء N2H4 سحابة إلكترونات فيها 18 إلكترونًا). إضافةً لذلك، للجُزَيء C10H20 مساحة سطح أكبر بكثير من مساحة سطح الجُزَيء N2H4 ولذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات C10H20 أقوى من الأربطة الهيدروجينيّة الموجودة بين جُزَيئات الـ N2H4 ولذلك نحتاج إلى طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الـ C10H20 ودرجة غليانها أعلى.
- للمادّة C10H20 ذائبيّة جيّدة في الـ CS2(ℓ)
- صيغوا عمليّة إذابة الـ C10H20 في ثاني كبريتيد الكربون (CS2(ℓ)) بدرجة حرارة الغرفة.
- اشرحوا لماذا يتمتّع الـ C10H20 بذائبيّة جيّدة في ثاني كبريتيد الكربون.
المادّتان هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس. لذلك، عند خلط الموادّ تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات المادّة C10H20 وبين جُزَيئات المادّة CS2 .
- حددّوا ما إذا كان محلول الـ C10H20 في ثاني كبريتيد الكربون موصلًا للتيّار الكهربائيّ. علِّلوا إجابتكم.
- اذكروا صِفتين ماكروسكوبيّتين لفلزّ اليورانيوم U(s).
- انسخوا قائمة الموادّ الموجودة في الجدول وحدّدوا بجانب كلّ مادة إذا كانت موصِلة للتيّار الكهربائيّ في الحالة السائلة (يمكن وضع علامة “+” للحالة التي تكون بها المادّة موصِلة للكهرباء ووضع علامة “-” للحالة التي لا تكون بها المادّة موصِلة للكهرباء). اشرحوا فقط بالنسبة للموادّ الموصِلة للتيّار الكهربائيّ، لماذا هي موصِلة للكهرباء.
| المادّة | درجة الانصهار (C°) | درجة الغليان (C°) | التوصيل الكهربائيّ في الحالة السائلة |
| UCℓ3 | 837 | 1657 | + |
| N2H4 | 2 | 104 | – |
| ℓNH4C | 235 | 452 | + |
| C10H20 | 30- | 173 | – |
| U | 1405 | 4091 | + |
| NH3 | 77- | 33- | – |
الموادّ UCℓ3 و- NH4Cℓ موصِلة للتيّار الكهربائيّ في الحالة السائلة لأنّها موادّ أيونيّة، للموادّ الأيونيّة في الحالة السائلة أيونات حرّة الحركة تسمح بالتوصيل الكهربائيّ.
المادّة U موصِلة للتيّار الكهربائيّ في الحالة السائلة لأنّها فلزّ. للفلزّات في الحالة السائلة إلكترونات حرّة الحركة.
- اكتبوا صيغة التمثيل الإلكترونيّ للأيونات السالبة التي تظهر في قائمة الموادّ المُعطاة في الجدول المعروض في بداية السؤال.
الأيون السالب الوحيد الموجود في قائمة الموادّ المُعطاة هو ‾Cℓ.
صيغة التمثيل الإلكترونيّ لهذا الأيون هي: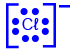
أحد نظائر عنصر اليورانيوم هو:.
من هذا النظير كوّنوا المُركّب UCℓ3(s).
- حّددوا عدد البروتونات، الإلكترونات، والنيوترونات في جُزَيئات اليورانيوم في المُركّب UCℓ3(s).
المادّة UCℓ3(s) هي مادّة أيونيّة. اليورانيوم في هذه المادّة هو أيون موجب شُحنته 3+ (لأنّ شُحنة الكلور 1-).
لذلك، ستحتوي أيونات اليورانيوم على 92 بروتونًا ولكن فقط على 89 إلكترونًا و-146 نيوترونًا.
يتفاعل اليورانيوم في عمليّة ينبعث منها إشعاعات.
أمامكم صِيغَتان:
- اختاروا الصياغة الصحيحة.
- مادّة كلوريد الألومنيوم تتكوّن من التفاعُل بين الألومنيوم (Aℓ(s)) والكلور (Cℓ2(s)).
- صيغوا التفاعُل بين الألومنيوم والكلور للحصول على كلوريد الألومنيوم.
2Aℓ(s) + 3Cℓ2(g) → 2AℓCℓ3(s)
- لكلوريد الألومنيوم درجة انصهار 173°C ودرجة غليان 423°C.
- ما هي حالة مادّة كلوريد الألومنيوم في درجة حرارة الغرفة (25°C)؟ علِّلوا إجابتكم.
يكون كلوريد الألومنيوم في درجة حرارة الغرفة في الحالة الصلبة لأنّ درجة انصهاره أعلى من درجة حرارة الغرفة، وبالتالي لا توجد طاقة كافية في درجة حرارة الغرفة لتفكيك الروابط الأيونيّة بين أيونات المادّة.
- صِفوا على المستوى الميكروسكوبيّ مادّة كلوريد الألومنيوم في درجة حرارة الغرفة.
مادّة كلوريد الألومنيوم صلبة في درجة حرارة الغرفة. يتكوّن كلوريد الألومنيوم من أيونات ألومنيوم Aℓ3+ وأيونات كلور Cℓ‾. أيونات الكلور مُحاطة بأيونات الألومنيوم وأيونات الألومنيوم مُحاطة بأيونات الكلور ويوجد بينها تجاذُب كهربائيّ قويّ (رابط أيونيّ).
للأيونات حركة تذبذبيّة والمبنى متراصّ للغاية.
- اكتبوا صيغة التمثيل الإلكترونيّ للجُسيمات في مادّة كلوريد الألومنيوم.
- اكتبوا صِفتين ماكروسكوبيّة للألومنيوم (Aℓ(s)).
- اكتبوا خاصّتين على المستوى الميكروسكوبيّ للكلور (Cℓ2(g)).
الكلور هو غاز. لذلك يمكن القول أنّه على المستوى الميكروسكوبيّ جُسَيمات الغاز لديها حركة إزاحة، دوران وتذبذُب. بين جُسَيمات الغاز لا توجد أربطة، والتجاذُب بينها ضعيف، البُعد بينها كبير جدًا (مقارنةً بحجم الجُسَيمات)، جُسَيمات الغاز تصطدم ببعضها البعض، وإذا كانت محصورة في وعاء مغلق فإنّها تصطدم أيضًا بجدران الوعاء.
- صيغوا معادلة عمليّة إذابة كلوريد الألومنيوم في الماء وحدّدوا، باستخدام الصيغة التي كتبتموها، ما إذا كان المحلول موصلًا للكهرباء أم لا. علِّلوا إجابتكم.
المحلول موصلّ للكهرباء لأنّه يحتوي على أيونات حرّة الحركة.
- أمامكم صِيَغ لمُركّبات تحتوي على عنصر النيتروجين (N):
NaNO3 CH3CH2NH2 (NH4)2S NH3 N2H4 5 4 3 2 1
- صنّفوا المُركّبات وفقًا للمبنى الأيونيّ أو الجُزَيئيّ .
الموادّ الأيونيّة هي NaNO3 , (NH4)2S
الموادّ الجُزَيئيّة هي N2H4 , NH3 , CH3CH2NH2
- ב
- درجة غليان المادّة 1 أعلى من درجة غليان المادّة 2. اشرحوا السبب.
الموادّ 1 و-2 هما موادّ جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة.
للمادّة 1 توجد أكثر مراكز (إمكانيات) لتكوين أربطة هيدروجينيّة بين جُزَيئاتها، لذلك الروابط بين جُزَيئاتها أقوى. نحتاج إلى طاقة أكبر لتفكيك هذه الروابط. بالتالي، درجة غليانها أعلى. الأيونات لها حركة تذبذُب فقط ومبنى كثيف.
- المحلول المائيّ للمادّة 3 موصِل للكهرباء. اشرحوا السبب.
- ג
- اكتبوا صيغة الإذابة في الماء للمادّة 5 وصِفوا على المستوى الميكروسكوبيّ المحلول.
عمليّة الإذابة هي
وصف المحلول على المستوى الميكروسكوبيّ
يحتوي المحلول على أيونات صوديوم Na+، أيونات NO3– وجُزَيئات من الماء.
أيونات الـNa+ مُحاطة بجُزَيئات ماء (مميّأة) حيث أنّ ذرّة الأوكسجين (المشحونة بشحنة جُزئيّة سالبة ¯δ) في جُزَيئات الماء تتّجه نحو الأيونات الموجبة.
بهذه الطريقة، تُحيط جزيئات الماء بالأيون الموجب ويوجد بينها وبين الأيون تجاذب كهربائيّ.
أيونات الـ NO3– أيضًا مُحاطة بجُزَيئات ماء، حيث أنّ ذرّات الهيدروجين في جُزَيئات الماء (المشحونة بشحنة جُزئيّة موجبة +δ) تتّجه نحو أيونات الـ NO3– .
بهذه الطريقة، تُحيط جزيئات الماء بالأيون السالب ويوجد بينها وبين الأيون تجاذب كهربائيّ .
بين جُزَيئات الماء نفسها توجد أربطة هيدروجينيّة. الأربطة الهيدروجينيّة هي بين ذرّة هيدروجين مكشوفة من الإلكترونات في جُزَيء واحد وزوج إلكترونات غير رابط في ذرّة أوكسجين في جُزَيء آخر.
الجُزَيئات والأيونات غير مرتّبة وكثافتها أقلّ نسبيًا مقارنةً بالحالة الصلبة. كلّ من جُزَيئات الماء والأيونات المُحاطة بجُزَيئات ماء تتحرّك في المحلول بحركة دورانيّة وتذبذُبيّة.
- هل المحلول المائيّ للمادّة 5 موصِل للكهرباء؟ علِّلوا إجابتكم.
- أمامكم صيغتان لمُركّبين إضافيّين يحتويان على النيتروجين
| CH3CH2CH2CH2CH2NH2 | H2N–CH2–COOH |
| B | A |
- أيّ من المُركّبات المُعطاة تحتوي على مجموعتين وظيفيّتين؟ اختاروها وامنحوا لها أسماء.
المُركّب الذي يحتوي على مجموعتين وظيفيّتين هو المُركّب A.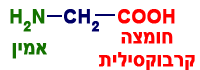
- إحدى المُركّبات تذوب في الماء وأيضًا في CCℓ4. أيّ من المُركّبات المُعطاة تذوب فقط بالماء وأيّ منها تذوب في المُذيبَين؟
المادّة التي تذوب في الماء وأيضًا في CCℓ4 هي المادّة B.
- صيغوا عمليّة إذابة المادّة التي تذوب في CCℓ4(ℓ).
المحلول المائيّ موصِلٌ للكهرباء لأنّه يحتوي على أيونات حرّة الحركة.
- المُركّب 5 يحتوي على أيون صوديوم شُحنته موجبة. صِفوا المبنى الجُسيميّ (بروتونات، إلكترونات ونيوترونات ) لنَظير أيون الصوديوم الذي يكون عدد كتلته 23 واكتبوا صيغة التمثيل الإلكترونيّ له.
أيون الصوديوم Na+ يحتوي على 11 بروتونًا، 10 إلكترونات و-12 نيوترونًا.
صيغة التمثيل الإلكترونيّ لأيون الصوديوم: [Na]+
- اقترحوا تجربةً يمكن بمساعدتها التمييز بين الصوديوم (Na(s)) وبين NaNO3(s). لماذا اخترتم هذه التجربة؟
للتمييز بين Na(s) وبين NaNO3(s) نفحص التوصيل الكهربائيّ.
الـ Na(s) في الحالة الصلبة موصِل للكهرباء لأنّه فلزّ ويحتوي في الحالة الصلبة على إلكترونات حرّة الحركة غير مُتمركزة.
المادّة NaNO3(s) غير موصِلة للكهرباء بالحالة الصلبة لأنّها لا تحتوي على شحنات حرّة الحركة (لا يوجد بها إلكترونات غير مُتمركزة أو أيونات حرّة الحركة).
- في الجدول التالي مُعطاة صِيَغ الموادّ في العمود الأيمن وصِفات الموادّ في العمود الأيسر.
صِيَغ | الصِفات |
| S8 | أ. يذوب جيّدًا في الماء وموصِل للكهرباء في الحالة السائلة |
| KCℓ | ب. غاز في درجة حرارة الغرفة، لا يذوب في الماء، للمادّة جُزَيئات غير قُطبيّة |
| CCℓ2O | ج. يذوب جيّدًا في الماء وغير موصِل للكهرباء |
| Mg | د. صلب بدرجة حرارة الغرفة ولا يذوب في الماء |
| H2 | ه. موصِل للكهرباء في الحالة الصلبة وفي الحالة المُنصهرة |
| (CH3CH2)2O | و. غاز في درجة حرارة الغرفة، لا يذوب في الماء، للمادّة جُزَيئات قُطبيّة |
للـ H2 مبنى خطّيّ وللـ CCℓ2O مبنى مثلّث مستوٍ.
لائموا لكّل صيغة من صِيَغ الموادّ في عمود الموادّ إحدى الصِفات التي تظهر في العمود الأيسر (من أ – و) والتي تميّزها.
لاحِظوا أنّه يجب الإجابة على هذا السؤال باستخدام الجدول الموجود ضمن الإجابة.
תקציר המבחן
0 מתוך 1 שאלות הושלמו
שאלות:
מידע
כבר השלמת את המבחן בעבר. לכן אינך יכול להתחיל אותו שוב.
המבחן נטען…
עליך להתחבר או להירשם כדי להתחיל את המבחן.
אתה חייב להשלים קודם את הבאים:
תוצאות
תוצאות
0 מתוך 1 שאלות נענו נכון
הזמן שלך:
זמן חלף
השגת 0 מתוך 0 נקודה(ות), (0)
נקודה(ות) שקיבלת: 0 מתוך 0, (0)
0 שאלות פתוחות בהמתנה (נקודה(ות) אפשרית(יות): 0)
קטגוריות
- כללי 0%
- 1
-
שאלה 1 מתוך 1
1. שאלה
נכוןלא נכון
- مُعطاة الأزواج التالية من المواد.ّ ما هي التجربة التي ستقومون بإجراءها وما الذي سترونه لتتمكّنوا من التمييز بين الموادّ؟
- Na(s) و- NaCℓ(s)
التجربة التي سنُجريها للتمييز بين Na(s) وبين NaCℓ(s) هي فحص التوصيل الكهربائيّ.
Na(s) موصِل للكهرباء لأنّه مادّة فلزّيّة يحتوي على إلكترونات حرّة الحركة غير مُتمركزة في الحالة الصلبة.
NaCℓ(s) هي مادّة أيونيّة وفي حالتها الصلبة لا تحتوي على شحنات كهربائيّة حرّة الحركة (لا توجد أيونات حرّة الحركة ولا إلكترونات غير مُتمركزة)، لذا هي غير موصِلة للتيّار الكهربائيّ.
- H2O2(ℓ) و- C7H14(ℓ)
التجربة التي سنُجريها للتمييز بين H2O2(ℓ) وبينC7H14(ℓ) هي فحص الذائبيّة في الماء.
H2O2(ℓ) هي مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة. كي نفحص ذائبيّتها في الماء (التي هي أيضًا مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة) سنكتشف وجود ذائبيّة بتكوّن أربطة هيدروجينيّة بين جُزَيئات المادّتين. سنحصل على محلول مُتجانس.
C7H14(ℓ) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. لذلك لن تتكوّن بين جُزَيئات هذه المادّة وجُزَيئات الماء تأثيرات متبادلة. هذا يعني أنّ المادّة لا تذوب في الماء. في مرحلة الخلط سنرى سائلًا مُعكّرًا. بعد ذلك، ستنفصل الموادّ وستتكوّن طبقتان لا تختلطان ببعضهما البعض (كمثال الزيت والماء)..
- C(s) جرافيت و- MnO2(s)
التجربة التي سنُجريها للتمييز بين الچرافيت C(s) وبين MnO2(s) هي فحص التوصيل الكهربائيّ.
الچرافيت C(s) موصِل للكهرباء في الحالة الصلبة لأنّ مبناه في هذه الحالة يحتوي على إلكترونات حرّة الحركة.
MnO2(s) هي مادّة أيونيّة في الحالة الصلبة. لا تحتوي على أيونات حرّة الحركة وبالتالي هي غير موصِلة للكهرباء في هذه الحالة.
- K(s) والماس C(s)
التجربة التي سنُجريها للتمييز بين الماس C(s) وبين K(s) هي فحص التوصيل الكهربائيّ.
الفلزّ K(s) موصِل للكهرباء في الحالة الصلبة. توجد للفلزّات في الحالة الصلبة إلكترونات حرّة الحركة غير مُتمركزة ولذلك فهي موصِلة للكهرباء.
الماس C(s) المكوّن من ذرّات كربون مرتبطة ببعضها بروابط تساهميّة، هو مادّة ذرّيّة في الحالة الصلبة. لا تحتوي المادّة على شحنات كهربائيّة حرّة الحركة ولذلك الماس غير موصِل للكهرباء في الحالة الصلبة.
- مُعطاة الموادّ التالية: KCℓ, SiO2, Rb, PF3
لائموا بين الموادّ التي تظهر في القائمة وبين صِفاتها في الجدول التالي.المادّة درجة الانصهار (C°) التوصيل الكهربائيّ في المادّة الصلبة التوصيل الكهربائيّ في المادّة السائل المادّة I 688 + + II 772 – + III 151- – – IV 1610 – –
| المادّة | درجة الانصهار (C°) | التوصيل الكهربائيّ في المادّة الصلبة | التوصيل الكهربائيّ في المادّة السائل | المادّة |
| I | 688 | + | + | Rb |
| II | 772 | – | + | KCℓ |
| III | 151- | – | – | PF3 |
| IV | 1610 | – | – | SiO2 |
- اشرحوا الحقائق التالية:
- المغنيسيوم (Mg) موصِل للكهرباء في الحالة الصلبة وفي الحالة السائلة أيضًا، بينما كلوريد المغنيسيوم (MgCℓ2) موصِل للكهرباء فقط في الحالة السائلة.
- المغنيسيوم (Mg) موصِل للكهرباء في الحالة الصلبة وفي الحالة السائلة أيضًا لأنّه مادّة فلزّيّة مكوّنة من أيونات موجبة وبحر من الإلكترونات حرّة الحركة وغير المُتمركزة. في كلّ من الحالتين الصلبة والسائلة توجد إلكترونات حرّة الحركة وغير مُتمركزة، ولذلك المغنيسيوم موصِل للكهرباء في هاتين الحالتين.
- كلوريد المغنيسيوم MgCℓ2 هو مادّة أيونيّة مكوّنة من أيونات موجبة مُحاطة بأيونات سالبة والعكس.
فيالحالة الصلبة الأيونات ليست حرّة الحركة ولذلك كلوريد المغنيسيوم غير موصِل للكهرباء في الحالة الصلبة.
بينما فيالحالة السائلة يحتوي كلوريد المغنيسيوم على أيونات حرّة الحركة ولذلك يكون موصِلًا للكهرباء.
- الچرافيت (C) موصِل للكهرباء في الحالة الصلبة وبينما الماس (C) غير موصِل للكهرباء في الحالة الصلبة.
- الچرافيت (C) هي مادّة ذرّيّة، مكوّنة من ذرّات كربون مرتبطة فيما بينها بأربطة تساهميّة. يتكوّن الچرافيت من طبقات عديدة. تتكوّن كلّ طبقة من ذرّات كربون، حيث ترتبط كلّ ذرّة بثلاث ذرّات أخرى بأربطة تساهميّة أحاديّة.
بين الطبقات توجد التأثيرات المتبادلة ڤان در ڤالس.
لكلّ ذرّة كربون في الطبقة يبقى إلكترون واحد غير مُزدوَج، وجميع الإلكترونات غير المُزدوَجة لجميع ذرّات الكربون في الطبقة تتحرّك بعشوائيّة.
الچرافيت موصِل للكهرباء في الحالة الصلبة بسبب وجود إلكترونات حرّة الحركة في كلّ طبقة. - الماس أيضًا مكوّن من ذرّات كربون فقط. كلّ ذرّة كربون تكوّن أربعة روابط تساهميّة أحاديّة مع أربع ذرّات كربون أخرى.
في مبنى الماس لا توجد إلكترونات حرّة الحركة ولذلك الماس غير موصِل للكهرباء في الحالة الصلبة.
- الهيدرازين (N2H4) يذوب في الماء وبينما اليود (I2) لا يذوب في الماء.
- الهيدرازين (N2H4) هو مادّة جُزَيئيّة توجد بين جُزَيئاته أربطة هيدروجينيّة.
بين جُزَيئات الماء أيضًا توجد أربطة هيدروجينيّة.
لذلك، عندما يتمّ خلط الهيدرازين مع الماء، تتكوّن روابط هيدروجينيّة بين جُزَيئات الهيدرازين وجُزَيئات الماء. لهذا السبب الهيدرازين قابل للذوبان بالماء. - اليود (I2) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. لذلك، لا تتكوّن تأثيرات مُتبادلة بين جُزَيئات اليود وبين جُزَيئات الماء. نتيجًة لذلك، اليود لا يذوب بالماء.
- محلول نترات الصوديوم (NaNO3) موصِل للكهرباء بينما محلول السكّر (C6H12O6) غير موصِل للكهرباء.
- نترات الصوديوم (NaNO3) هو مادّة أيونيّة قابليّتها للذوبان عالية. يحتوي محلول نترات الصوديوم على أيونات حرّة الحركة مُميّأةولذلك المحلول موصِل للكهرباء.
- السكّر (C6H12O6) هومادّة جُزَيئيّة.
عند ذوبانها في الماء لا تتكوّن في المحلول أيونات حرّة الحركة. يذوب السكّر على شكل جُزَيئات وبين جُزَيئاته وجُزَيئات الماء تتكوّن أربطة هيدروجينيّة ولكنلا تتكوّن شحنات كهربائيّة حرّة الحركة. لذلك محلول السكّر غير موصِل للكهرباء.
- رُباعي كلوريد الكربون (CCℓ4) لا يذوب في الماء وبينما الميثانول (CH3OH) يذوب في الماء.ُ
- رُباعي كلوريد الكربون (CCℓ4) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة.
بين جُزَيئات الماء وجُزيئات رُباعي كلوريد الكربون (CCℓ4) لا تتكوّن تأثيرات متبادلة ولذلك، رُباعي كلوريد الكربون لا يذوب في الماء. - ميثانول (CH3OH) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس.
بين جُزَيئات الماء توجد أربطة هيدروجينيّة.
لذلك تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات الميثانول. لذلك، الميثانول يذوب في الماء.
- للهِبتان (C7H16) درجة غليان مُماثلة لدرجة غليان كلوريد اليود (ICℓ).
الهِبتان (C7H16) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
كلوريد اليود (ICℓ) هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
سنقوم بفحص العوامل الثلاثة التي تؤثّر على قوّة التأثيرات المتبادلة ڤان در ڤالس:
| المادّة | سحابة إلكترونات | قُطبيّة | مساحة السطح |
| هبتان | 58 | غير قطبيّ | كبير |
| كلوريد اليود | 70 | قُطبيّ | صغير |
من جهة واحدة، جُزَيئات الهِبتان أكثر انتشارًا أي لها مساحة سطح أكبر تساهم في تقوية التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات.
من جهة أخرى، جُزَيئات كلوريد اليود قُطبيّة وسحابة الإلكترونات التابعة لها أكبر حجمًا. هذه العوامل تُساهم في تقوية التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات.
حجم التأثير على قوّة التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات يتوازن مما يجعل درجات غليان الموادّ قريبة من بعضها البعض.
- تتكونّ جُزَيئات ثاني كبريتيد الكربون من ذرّات كربون (C) وكبريت (S). لجُزَيئات ثاني كبريتيد الكربون CS2 مبنى خطّيّ. طاقة الرابط C═S هي .
- اكتبوا للجُزَيء صيغة التمثيل الإلكترونيّ وحدّدوا ما إذا كان الجُزَيء قطبيًّا أم غير قطبيّ. علِّلوا إجابتكم.
![]()
الجُزَيء غير قطبيّ إذ يوجد به تماثل في سحابة الإلكترونات. للجُزَيء مبنى مُتماثل.
- أيّ قوى تعمل بين جُزَيئات ثاني كبريتيد الكربون؟
بما أنّ نصف قُطر ذرّة السيلينيوم أكبر من نصف قُطر ذرّة الكبريت، فإنّ البُعد بين الأنوية والإلكترونات الرابطة في الرابط Se═C، أكبر من البعد الموجود في الرابط S=C.
لذلك، فإن التجاذُب الكهربائيّ بين الأنوية والإلكترونات الرابطة في الرابط Se═C أضعف.
- طاقة الرابط بين الكربون والسيلينيوم (Se) في المُركّب CSe2 أقلّ من طاقة الرابط بين الكربون والكبريت (C═S) في المُركّب CS2. علِّلوا إجابتكم.
بما أنّ نصف قُطر ذرّة السيلينيوم أكبر من نصف قُطر ذرّة الكبريت، فإنّ البُعد بين الأنوية والإلكترونات الرابطة في الرابط Se═C، أكبر من البعد الموجود في الرابط S=C.
لذلك، فإن التجاذُب الكهربائيّ بين الأنوية والإلكترونات الرابطة في الرابط Se═C أضعف.
- أيّ من المادّتين، ثاني كبريتيد الكربون أو ثُنائي سيلينيد الكربون CSe2 لديها درجة غليان أعلى؟ علِّلوا إجابتكم.
لثُنائي سيلينيد الكربون CSe2 درجة غليان أعلى.
المادّتان هما موادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
سحابة الإلكترونات في جُزَيئات ثُنائي سيلينيد الكربونأكبر حجمًا ولذلك هناك احتمال أكبر لتكوين ثنائيّات تقاطُب لحظيّة على الجُزَيئات، والشحنات الجُزئيّة المتكوّنة أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى. نحتاج إلى طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات ثُنائي سيلينيد الكربون.
لذلك، درجة غليان ثُنائي سيلينيد الكربون أعلى.
- الموادّCSe2(ℓ) و- CS2(ℓ) لا تذوب في الماء ولكنّها تذوب في الـCCℓ4(ℓ). اشرحوا السبب واكتبوا صياغة عمليّات الإذابة للمادّتين في CCℓ4(ℓ).
ثاني كبريتيد الكربون وثُنائي سيلينيد الكربون هم موادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
حتّى بين جُزَيئات المادّة CCℓ4(ℓ) توجد تأثيرات متبادلة ڤان در ڤالس.
لذلك بين جُزَيئات الـ CCℓ4 وجُزَيئات ثاني كبريتيد الكربون أو بين جُزِيئات الـ CCℓ4 وجُزَيئات ثُنائي سيلينيد الكربون تتكوّن تأثيرات متبادلة ڤان در ڤالس. لهذا السبب فإنّ الموادّ المُعطاة تذوب في رباعي كلوريد الكربون.
بين جُزَيئات الماء توجد أربطة هيدروجينيّة ولذلك لا تتكوّن تأثيرات متبادلة (أربطة) بين جُزَيئات الماء وجُزَيئات الموادّ المُعطاة. لذلك الموادّ لا تذوب في الماء.
صياغة عمليّة الإذابة:
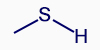
- مُعطى المُركّب CH3SH. في هذا الجُزَيء يوجد رابط تساهميّ C—S.
- اذكروا ما هي الأربطة التساهميّة الأخرى الموجودة في الجُزَيء.
الروابط هي C—S, C—H, S—H
- اكتبوا التمثيل المختصر للصيغة البنائيّة للجُزَيء.
- هل طاقة الرابط C—S أكبر، أصغر أو مُساوية لطاقة الرابط C═S؟ اشرحوا ما هي العوامل التي تُسبّب الفرق بين طاقة الرابط لهذه الروابط.
طاقة الرابط C—S أصغر من طاقة الرابط C═S بسبب الفرق في رتبة الرابط.
الرابط C═S هو رابط ثُنائيّ وبينما الرابط C—S هو رابط أحاديّ.
- مُعطاة صِيَغ لأربعة موادّ: HF ، C3H7OH ، CCℓ4 ، CH3Cℓ
في الجدول التالي تظهر مُعطيات حول الموادّ:المادّة قطبيّة الجُزَيء الذائبيّة في الماء الذائبيّة في-CS2 A + + + B – – + C + + – D + – +
- ائِموا كلّ من الموادّ المُعطاة للأحرف A-D.
| المادّة | الصيغة الجُزَيئيّة |
| A | C3H7OH |
| B | CCℓ4 |
| C | HF |
| D | CH3Cℓ |
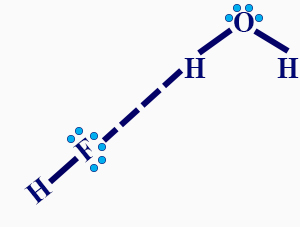
- اشرحوا لماذا تذوب المادّة C في الماء وارسموا الرابط الذي يتكوّن بين جُزَيء المادّة C وبين الماء.
المادّة C تذوب في الماء لأنّ بين جُزَيئاتها توجد روابط هيدروجينيّة. بين جُزَيئات الماء أيضًا توجد روابط هيدروجينيّة لذلك تتكوّن روابط هيدروجينيّة بين جُزَيئات المادّة C وجُزَيئات الماء.
- ارسموا التمثيل المُختصر للصيغة البنائيّة للمادّة A.
- اذكروا الروابط الموجودة في المادّة A بين أزواج الذرّات المُختلفة في الجُزَيء.
الروابط هي C—C , C—H , C—O , O—H.
- هل المادّة
 هي أيزومر للمادّة A؟ علِّلوا إجابتكم.
هي أيزومر للمادّة A؟ علِّلوا إجابتكم.
- أمامكم قائمة تحتوي على خمسة خصائص تمّت الإشارة إليها بالأرقام I-V
- للمادّة مبنى ضخم، المادّة لا تذوب في الماء وغير موصِلة للكهرباء.
- المادّة موصِلة للكهرباء في درجة حرارة الغرفة.
- يمكن وصف جُسَيمات المادّة حسب المجموعة الوظيفيّة (هناك مادّتان).
- المادّة موصِلة للكهرباء في الحالة السائلة ولكن ليس في الحالة الصلبة.
- المادّة مُكوّنة من جُزَيئات ثُنائيّة الذرّة خطّية.
مُعطاة قائمة المواد التالية:
BrF(ℓ) , CH3CH2OH(ℓ) , MgCℓ2(s) , Si(s) , CH3COOH(ℓ) , Cu(s)
- لائِموا لكلّ خاصّيّة المادّة أو الموادّ المناسبة من القائمة.
| المادّة | الخاصيّة |
|---|---|
| BrF(ℓ) | المادّة مُكوّنة من جُزَيئات ثُنائيّة الذرّة خطّية. |
| CH3CH2OH(ℓ) | يمكن وصف جُسَيمات المادّة حسب المجموعة الوظيفيّة. |
| MgCℓ2(s) | المادّة موصِلة للكهرباء في الحالة السائلة ولكن ليس في الحالة الصلبة. |
| Si(s) | للمادّة مبنى ضخم، المادّة لا تذوب في الماء وغير موصِلة للكهرباء. |
| CH3COOH(ℓ) | يمكن وصف جُسَيمات المادّة حسب المجموعة الوظيفيّة. |
| Cu(s) | المادّة موصِلة للكهرباء في درجة حرارة الغرفة. |
- اشرحوا لماذا المادّة/الموادّ التي قمتم بملاءَمتها للخاصيّة رقم 2 موصِلة للكهرباء في درجة حرارة الغرفة.
المادّة التي تمّت مُلاءَمة الخاصيّة رقم 2 لها هي Cu(s) لانّها فلزّ وفي درجة حرارة الغرفة تكون في الحالة الصلبة. في هذه الحالة يوجد في الفلزّ إلكترونات حرّة الحركة ولهذا هو موصِل للكهرباء.
- حدّدوا أيّ من الموادّ التي تمّت مُلاءَمتها مع الخاصيّة رقم 3 لديها درجة غليان أعلى. علِّلوا إجابتكم.
الموادّ التي تمّت مُلاءَمة الخاصيّة رقم 3 لها هي CH3CH2OH(ℓ) و-CH3COOH(ℓ). المادّتان هما مادّتان جُزَيئيّتان توجد بين جُزَيئاتها أربطة هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس.
للمادّة CH3COOH(ℓ) توجد أكثر مراكز لتكوين أربطة هيدروجينيّة بين جُزَيئاتها، لذلك الروابط بين جُزَيئاتها أقوى وتحتاج إلى طاقة أكبر لتفكيكها. لذلك، درجة غليانها أعلى (للمادّتين سحابة إلكترونات متشابهة، وبالتالي لا يوجد فارق كبير في قوّة التأثيرات المتبادلة ڤان در ڤالس في هذه الحالة).
- صيغوا عمليّة انصهار المادّة/الموادّ التي تمّت مُلاءَمة الخاصيّة رقم 4 لها.
- اكتبوا صيغة التمثيل الإلكتروني لجُزَيء/جُزَيئات المادّة/الموادّ التي تمّت ملاءَمته/ا مع الخاصيّة رقم 5.
- اكتبوا صيغة عمليّات الانصهار للموادّ التي لاءَمتم لها خاصيّة رقم 2 و-5 واقترحوا تجربة يمكن من خلالها التمييز بين المادّتين في الحالة السائلة. ماذا ستفعلون وماذا ستجدون ولماذا؟
التجربة التي سنُجريها للتمييز بين الموادّ في الحالة السائلة هي فحص التوصيل الكهربائيّ. المادّة Cu(ℓ) هي مادّة فلزّيّة. في الحالة السائلة لديها إلكترونات حرّة الحركة غير مُتمركزة ولذلك تكون موصِلة للكهرباء. المادّة BrF(ℓ) هي مادّة جُزَيئيّة في حالتها السائلة لا تحتوي على شحنات كهربائيّة حرّة الحركة (لا توجد أيونات حرّة الحركة ولا إلكترونات غير مُتمركزة) ولذلك هي غير موصِلة للكهرباء.
- مُعطى الجدول التالي: مُعطاة صِيَغ لثلاثة فلوريدات (مُركّبات لعنصر الفلور مع عنصر آخر)
المُركّب HF PF3 SiF4 درجة الغليان (C°) 20 101- 86- الشكل الهندسيّ خطّيّ هرم ثلاثيّ رباعيّ السطوح
- اكتبوا صيغة التمثيل الإلكترونيّ للفلوريدات الثلاثة.
- حدّدوا لأيّ من الفلوريدات جُزَيئات قُطبيّة. علِّلوا إجابتكم.
- للـ P والـ H قيمة السالبيّة الكهربائيّة ذاتها. لأيّ من الروابط طاقة رابط أكبر، للـ H—P أو للـ F—H؟ اذكروا ما هي أسباب هذا الفارق.
طاقة الرابط الأكبر تكون في الرابط H—F.
الرابط H—F قُطبيّ بينما الرابط P—H غير قُطبيّ. إضافةً لذلك، البُعد بين الأنوية والإلكترونات الرابطة في الرابط H—F أصغر لأنّ نصف قُطر ذرّة الفلور أصغر من نصف قُطر ذرّة الفوسفور.
- ד
- اشرحوا باستخدام مُصطلحات المبنى والترابط الفرق في درجة الغليان بين HF و- SiF4.
بين جُزَيئات المادّة HF توجد أربطة هيدروجينيّة. بين جُزَيئات المادّة SiF4 توجد تأثيرات متبادلة ڤان در ڤالس.
الروابط الهيدروجينيّة بين جُزَيئات المادّة HF أقوى من التأثيرات المتبادلة ڤان در ڤالس بين روابط المادّة SiF4.
بما أنّ القُوى بين جُزَيئات المادّة HF أقوى، نحتاج إلى طاقة أكبر لتفكيك هذه الروابط ودرجة غليانها أعلى.
- اشرحوا باستخدام مُصطلحات المبنى والترابط الفرق في درجة الغليان بين المادّة SiF4 والمادّة PF3.
المادّتان المُعطاتان هم موادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
بما أنّ سحابة الإلكترونات في SiF4 أكبر حجمًا من سحابة الإلكترونات في PF3، هناك احتمال أكبر لتكوين ثنائيّات تقاطُب لحظيّة على الجُزَيئات، والشحنات الجُزئيّة المُتكوّنة أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة SiF4 أقوى. نظرًا لذلك، نحتاج إلى طاقة أكبر لتفكيك هذه التأثيرات المتبادلة ودرجة غليان المادّة أعلى.
- واحد فقط من بين الفلوريدات الثلاثة المُعطاة يذوب في الماء.
- حدّدوا الفلوريد الذي يذوب في الماء واشرحوا لماذا يذوب في الماء.
الفلوريد الذي يذوب في الماء هو HF.
وهو مادّة جُزَيئيّة توجد بين جُزَيئاتها أربطة هيدروجينيّة. بين جُزَيئات الماء أيضًا توجد روابط هيدروجينيّة، لذلك تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات المادّة HF .
المادّتان المُتبقّيتان فهما موادّ جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس، ولذلك لا تتكوّن تأثيرات متبادلة (روابط) بين جُزَيئاتها وجُزَيئات الماء.
بما أنّ سحابة الإلكترونات في SiF4 أكبر من سحابة الإلكترونات في PF3، هناك احتمال أكبر لتكوين ثنائيّات تقاطُب لحظيّة على الجُزَيئات، والشحنات الجُزئيّة المُتكوّنة أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة SiF4 أقوى. نظرًا لذلك، نحتاج إلى طاقة أكبر لتفكيك هذه التأثيرات المتبادلة ودرجة غليان المادّة أعلى.
- صيغوا عمليّة الإذابة في الماء لهذه المادّة.
- ما هي الخصائص المطلوبة من مُذيب آخر لكي يكون من الممكن إذابة الفلوريدات الأخرى فيه؟ علِّلوا إجابتكم.
يجب أن يكون المُذيب مادّةتوجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس كي تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات المُذيب وجُزَيئات الموادّ المُعطاة (PF3 أو SiF4).
- معطى أنبوبان اختباريّان مُغلقان دون أن يُكتب عليهما أيّ شيء. في أحد الأنابيب يوجد PF3 وفي الأنبوب الثاني يوجد MgF2.
- كيف يمكنكم التعرّف من خلال النظر فقط على المادّة الموجودة في كلّ أنبوب اختبار؟ اشرحوا بالتفصيل.
بما أنّنا نتعامل مع مادّة أيونيّة MgF2 ومادّة جُزَيئيّة PF3، فمن المتوقّع أن تكون المادّة الأيونيّة صلبة في درجة حرارة الغرفة، بينما المادّة الجُزَيئيّة المُعطاة، بناءً على درجة غليانها في الجدول المُعطى، ستكون غازيّة.
لذلك، في الأنبوب الاختباريّ الأوّل، سنرى مادّة صلبة وهي MgF2 بينما في الأنبوب الاختباريّ الثاني، لن نرى مادّة صلبة. إذا كان الغاز ملوّنًا سنرى اللون في الأنبوب الاختباريّ، وإذا كان الغاز عديم اللون فسنرى أنبوبًا شفّافًا.
- كيف يمكننا التمييز بين الموادّ في الأنابيب من خلال إجراء تجربة؟ اشرحوا بالتفصيل.
يمكن التمييز بين الموادّ من خلال فحص التوصيل الكهربائيّ.
المادّة الأيونيّة MgF2 في الحالة السائلة موصِلة للكهرباء، لأنّها تحتوي على أيونات حرّة الحركة بينما المادّة الجُزَيئيّة غير موصِلة للكهرباء في الحالة السائلة لعدم وجود شحنات كهربائيّة حرّة الحركة.