السالبيّة الكهربائيّة وقُطبيّة الرابط
بعد أن فهمنا ماذا يحدُث بين الذرّات المختلفة للّافلزّات ورأينا تكوين الرابط التساهميّ (الكوفالنتيّ) بينها، تعلّمنا كتابة صيغة التمثيل الإلكترونيّ والصيغة الجُزيئيّة. سنتعرّف الآن على جانب آخر من الروابط التساهميّة (الكوفالنتيّة). سنركّز في كلّ مرّة على رابط واحد فقط من بين كلّ الروابط في الجُزَيء. على سبيل المثال، في جُزَيء الماء، H2O، يوجد رابطان فرديّان: بين ذرّة الأكسجين وذرّة الهيدروجين الأولى، وبين ذرّة الأكسجين وذرّة الهيدروجين الثانية. سنتطرّق إلى كلّ رابك بشكل منفرد.
نبدأ بالتعرّف على شكل الإشارة الجديدة. لغاية الآن تعلّنا أن نرسم، نُعبِّر ونُشير إلى صيغة المادّة بطريقتَين. نُوضّح ذلك على جُزَيء الماء:
- الصيغة الجُزَيئيّة: H2O
- صيغة التمثيل الإلكترونيّ (صيغة لويس):
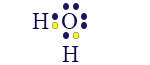
كما ذكرنا، يمكن الإشارة إلى كلّ زوج إلكترونات بواسطة خطّ (—) لذلك، عندما نتحدّث عن الرابط بين ذرّة الأكسجين وذرّة الهيدروجين، نُشير إليه على النحو التالي: H — O.
نتطرّق إلى الرابطَين التاليَين: الرابط H — H في جُزَيء H2 والرابط H — Cℓ في جُزَيء HCℓ.
كِلا الرابطَين فرديّان. في كليهما، يوجد زوج إلكترونات مشترك موجود في المدار الجُزَيئيّ. زوج الإلكترونات الرابط والمشحون بشحنة سالبة، ينجذب إلى النواتَين المشحونتَين بشحنة موجبة/بروتونات.
بموجب قانون كولوم، قوّة التجاذُب الكهربائيّ تتعلّق بالبُعد بين الشحنات وبمقدار الشحنات الكهربائيّة.
نتيجةً لحركة الإلكترونات، تتكوّن في الجُزَيء مناطق ذات شحنات كهربائيّة تسمّى “أقطاب” (من كلمة “قُطب”). هناك قطب (منطقة) سالب وقطب (منطقة) موجب.
نبسّط الشرح ونصف ما يحدُث في مدار جُزَيء الهيدروجين. تجدر الإشارة إلى أنّ هذا الوصف ليس دقيقًا تمامًا، لكنّه جيّد وكافٍ لفهم معنى الأقطاب التي تتكوّن في الجُزَيء.
المدار الجُزَيئيّ لجُزَيء الهيدروجين معبّأ بزوج إلكترونات. نذكّر أنّ المدار الجُزَيئيّ يصف المجال في الفراغ، والذي هناك احتمال لأن نجد فيه زوج الإلكترونات. الاحتمال الأكبر لإيجاد زوج الإلكترونات هو في الوسط، بين ذرّتَيّ الهيدروجين.
لنفترض أنّه بإمكاننا وقف حركة الإلكترونات في أيّ وقت، وتصوير موقعها. الحالة التالية ستكون الحالة التي فيها الاحتمال الأكبر:

لكن هناك حالات ممكنة أخرى، مثل الحالة التالية:

في هذه الحالة، إلكترونات أقرب إلى نواة ذرّة الهيدروجين اليسرى، وأبعد عن ذرّة الهيدروجين اليمنى. لذلك، المنطقة اليسرى في جُزَيء الهيدروجين مشحونة بشحنة جزئيّة سالبة، والمنطقة اليمنى في الجُزَيء مشحونة بشحنة جزئيّة موجبة.
إذا كانت الإلكترونات موجودة في الجانب الأيمن من المدار، كان بإمكاننا قول العكس تمامًا، وكانت الصور ستبدو كالآتي:

في هذه الحالة، كان يمكن القول إنّ المنطقة اليمنى في الجُزَيء مشحونة بشحنة جزئية سالبة، والمنطقة اليسرى مشحونة بشحنة جزئية موجبة.
نشير إلى أنّه كلّما كان عدد الإلكترونات أكبر:
1. سيتكون هناك مدارات أكثر معبّأة بالإلكترونات.
2. مدى توزيع الإلكترونات سيكون أكبر.
3. ستكون هناك حالات ميكروسكوبيّة أكثر، والتي يمكننا فيها إيجاد الإلكترونات: بالتالي، ستتكوّن تقطُّبات أكثر.
سنصف فيما يلي بعض الحالات الميكروسكوبيّة للإلكترونات حول النواة، من خلال محاكاة لصندوق مقسّم إلى 4 خانات.
لو أدخلنا كرة واحدة إلى الصندوق، ستكون هناك 4 حالات مختلفة:
بالمقابل، لو أدخلنا كرتَين، يمكن وصف 10 حالات مختلفة:
نعود للإلكترونات، كلّما كانت هناك إلكترونات أكثر في الذرّة، ستكون هناك حالات ميكروسكوبيّة أكثر، أيّ أنّ هناك إمكانيّات أكثر لتوزيع الإلكترونات في سحابة الإلكترونات. لذلك، ستتكوّن تقطُّبات أكثر.
نعود إلى ذرّة الهيدروجين. في حالة ذرّتَيّ الهيدروجين، تجاذُب النواتَين متساوٍ. لذلك، توزيع الحالات المختلفة في سحابة الإلكترونات وتوزيع الشحنة الكهربائيّة سيكون متجانسًا ومتماثلًا في المدار الجُزَيئيّ. قد يكون هناك استقطاب لحظيّ في الجُزَيء، لكن ليس هناك تفضيل لوجود شحنة موجبة على واحدة من ذرّتَيّ الهيدروجين.
يمكن القول إنّ الاحتمال بأن نجد الإلكترونات في منطقة نواة ذرّة الهيدروجين اليمنى مساوٍ للاحتمال بأن نجد الإلكترونات في منطقة نواة ذرّة الهيدروجين اليسرى. وذلك لأنّ قوّة تجاذُب نواتَيّ ذرّتَيّ الهيدروجين إلى زوج الإلكترونات المشترك متساوية. لذرّتَيّ الهيدروجين نفس الحجم (=نصف القُطر الذرّيّ). شحنتهما الذرّيّة أيضًا متساوية لأنّ لكليهما بروتون واحد في النواة. أيّ أنّ العوامل التي تؤثّر على قوّة التجاذُب الكهربائيّ بين النواتَين والإلكترونات المشتركة، هي نفس العوامل.
بالمقابل، في حالة الرابط بين ذرّة الهيدروجين وذرّة الكلور، التجاذُب بين النواتَين وزوج الإلكترونات الرابطة ليس متساويًا. من جهة، ذرّة الهيدروجين أصغر، ومن جهة أخرى ذرّة الكلور تحتوي على بروتونات أكثر في النواة. في هذه الحالة، هناك مشكلة في تحديد الذرّة التي تجذب الإلكترونات الرابطة بقوّة أكبر.
لتحديد الذرّة التي تجذب الإلكترونات المشتركة بقوّة أكبر، يجب التعرّف على المصطلح الجديد: السالبيّة الكهربائيّة.
السالبيّة الكهربائيّة هي مؤشّر كمّيّ لقدرة الذرّة عل جذب الإلكترونات إليها.
لكلكلّ ذرّة في قائمة العناصر الدوريّة توجد قيمة سالبيّة كهربائيّة، ما عدا الغازات الخاملة، التي تميل بشكل أقلّ لتكوين روابط كيميائيّة. كلّما كانت قيمة السالبيّة الكهربائيّة أكبر، تزداد قوّة جذب نواة الذرّة لزوج أو أزواج الإلكترونات المشترَكَة، لذلك يحدُث انحراف للشحنة السالبة (=الإلكترونات المشترَكَة) باتّجاه الذرّة التي لها قيمة سالبيّة كهربائيّة أكبر. يمكن القول إنّ الاحتمال لإيجاد الإلكترونات الرابطة في منطقة الذرّة ذات السالبيّة الكهربائيّة الأعلى، هو الأكبر.
في لغة الكيميائيّين، نقول إنّ الذرّة ذات السالبيّة الكهربائيّة الأعلى، أيّ تلك التي تجذب الإلكترونات المشتركة بقوّة أكبر، ستكون ذات قطب سالب. بالمقابل، الذرّة ذات السالبيّة الكهربائيّة الأصغر، أيّ تلك التي تجذب الإلكترونات المشتركة بقوّة أقلّ، ستكون ذات قطب موجب.
في حالة الرابط بين ذرّة الهيدروجين وذرّة الكلور، H — Cℓ، ذرّة الكلور هي ذات سالبيّة كهربائيّة أعلى. لذلك، ستجذب إليها الإلكترونات الرابطة بقوّة أكبر، وستحمل شحنة جزئيّة سالبة. ذرّة الهيدروجين، التي لها قيمة سالبيّة كهربائيّة أقلّ، ستجذب الإلكترونات الرابطة بقوّة أقلّ، ونتيجةً لذلك، ستكون مشحونة بشحنة جزئيّة موجبة.
نقارن الآن بين الرابطَين اللذَين تشارك فيهما ذرّة الكلور.
في الرابط F— Cℓ ذرّة الفلور (F) هي ذات سالبيّة كهربائيّة أعلى، لذلك ستحمل الشحنة الجزئيّة السالبة. ذرّة الكلور (Cℓ) بالمقابل، ستكون مشحونة بشحنة جزئيّة موجبة.
بينما في الرابط H — Cℓ ذرّة الكلور مشحونة بشحنة جزئيّة سالبة، وذرّة الهيدروجين مشحونة بشحنة جزئيّة موجبة.
بحسب قيَم السالبيّة الكهربائيّة، يمكننا أن نُحدِّد أيٌّ من الذرّات المشارِكة في الرابط التساهميّ ستكون مشحونة بشحنة جزئيّة موجبة أو شحنة جزئيّة سالبة.
الرابط بين ذرّتَيّ الهيدروجين االذي فيه توزيع الشحنة متساوٍ، ولا يوجد فيه طرف مُسَيطر سالب أو موجب، يُسمّى رابط تساهميّ (كوفالنتيّ) غير قطبيّ أو رابط نقيّ أو رابط ذو شحنة جزئيّة لحظيّة.
نعرّف الرابط التساهميّ النقيّ كرابط تساهميّ (كوفالنتيّ) بين ذرّتَين متطابقتَين.
نعرّف الرابط التساهميّ غير القطبيّ كرابط تساهميّ (كوفالنتيّ)، فيه الفرق بين قيَم السالبيّة الكهربائيّة للذرّتَين مساوٍ لـ 0، وهما ليستا ذرّتَين متطابقتَين.
الرابط بين ذرّة الهيدروجين وذرّة الكلور هو رابط تساهميّ قطبيّ أو رابط ذو شحنة جزئيّة ثابتة.
يمكن تعريف الرابط التساهميّ القطبيّ على النحو التالي أيضًا: إذا كان الفرق في قيَم السالبيّة الكهربائيّة بين ذرّتَيْن أكبر من صفر، إذًا الرابط قطبيّ. نذكّر هنا أنّه يجب دائمًا طرح القيمة الأصغر من القيمة الأكبر، أيّ القيمة الأكبر ناقص القيمة الأصغر.
عندما يكون الرابط قطبيًّا، تكون هناك ذرّة مشحونة بشحنة جزئيّة سالبة، وذرّة أخرى مشحونة بشحنة جزئيّة موجبة (شحنة الذرّة تُحدَّد بحسب قيَم السالبيّة الكهربائيّة).
من المتّبع الإشارة إلى الرابط القطبيّة على النحو التالي:
δ – هذا الحرف يسمّى دلتا.
-δ (دلتا ناقص): شحنة جزئيّة سالبة.
+δ (دلتا زائد): شحنة جزئيّة موجبة.
لماذا تكون الشحنة جزئيّة؟
إذا كانت ذرّة الكلور أيونًا سالبًا –، لكان لديها إلكترون واحد إضافيّ وكانت شحنتها الكهربائية 1-. لكن في الرابط التساهميّ، لا يحتفظ الكلور بإلكترونات الرابطة بشكل حصريّ له فقط. بكلمات أخرى، الإلكترون الذي تعطيه ذرّة الهيدروجين لتكوين الرابط التساهميّ، لا ينتقل إلى مدار ذرّة الكلور. عمليًّا، يتواجد مع إلكترون ذرة الكلور في مدار مشترك/في المدار الجُزَيئيّ. لهذا السبب، الشحنة الكهربائيّة على ذرّة الكلور هي جزئيّة وليست كاملة.
في جُزَيء الـ HCℓ ، توزيع الحالات المختلفة للإلكترونات في المدار الجُزَيئيّ ليس متماثلًا. عمليًّا، يحدث تشويه في المدار الجُزَيئيّ، واحتمال إيجاد الإلكترونات الرابطة بالقرب من نواة ذرّة الكلور، يصبح أكبر لأنها أكثر ذات سالبيّة كهربائيّة أعلى. يوضّح الرسم التالي حالة كهذه من بين حالات كثيرة لتوزيع الإلكترونات في المدار.
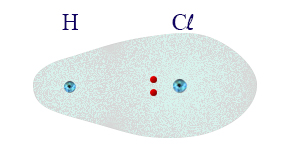
فيما بعد، سنتعلّم أنه في الرابط الذي يسمّى الرابط الأيونيّ، يحدُث انتقال للإلكترون من ذرّة إلى أخرى. نتيجةً لهذا الانتقال، تتكوّن حالة جديدة، حيث تصبح الذرّة التي أعطت الإلكترون مشحونة بشحنة موجبة كاملة (وليست جزئيّة)، بينما الذرّة التي استقبلت الإلكترون تصبح مشحونة بشحنة سالبة كاملة. عمليًّا، في الرابط الأيونيّ، تتكوّن أيونات، أيّ أنيون وكاتيون.
في الرابط التساهميّ، لا تتكوّن شحنات كاملة (أيونات) لأنّه لا يحدُث انتقال كامل للإلكترون من ذرّة إلى أخرى. كما تعلّمنا، في الرابط التساهميّ، تحدُث فقط مشاركة إلكترونات. لكن، بما أنّ هناك قوّة تجاذُب مختلفة للإلكترونات المشتركة، فإنّ الذرّة التي تجذب الإلكترونات بقوّة أكبر، تكون مشحونة بشحنة سالبة جزئيّة.
يمكننا مقارنة درجة القطبيّة في الروابط المختلفة بحسب الفرق في السالبيّة الكهربائيّة للذرّات المشاركة في الرابط.
- كلّما كان الفرق في قيمة السالبيّة الكهربائيّة أكبر، كان الرابط أكثر قطبيّةً.
- كلما كان الرابط أكثر قطبيّةً، تكون الشحنات الجزئيّة على الذرّات أكبر.
درجة قطبيّة الرابط هي عامل واحد من عوامل كثيرة تؤثّر على قوّة الرابط التساهميّ. سنتوسّع في هذا الموضوع في الدرس القادم.
لكي نفهم بشكل ملموس وواضح معنى الشحنات الجزئيّة في الرابط التساهميّ، نمعن النظر في المثال التالي.
تجدر الإشارة إلى أنّ الأرقام التي تمثّل السالبيّة الكهربائيّة هي قيَم حقيقيّة، لكن الشحنات هي لغرض التوضيح فقط وليست قيمًا حقيقيّة.
نقارن بين الرابطَين H — Cℓ و- H — F
أوّلًا، أيّ رابط أكثر قطبيّةً؟
لكي نجيب عن هذا السؤال، نحن بحاجة إلى قيَم السالبيّة الكهربائيّة للذرّات المختلفة. سنرى فيما بعد أنه في بعض الحالات يمكننا أن نستعين بقائمة العناصر الدوريّة، وأن نفهم من موقع الذرّات أين يكون الفرق في قيم السالبية الكهربائية أكبر.
فيما يلي قيَم السالبيّة الكهربائيّة:
H – 2.1
Cℓ – 3.0
F – 4.0
الفرق في السالبيّة الكهربائيّة في الرابط H — Cℓ هو 0.9 بينما في الرابط H — F الفرق هو 1.9. نستنتج من ذلك أنّ الرابط H—F هو أكثر قطبيّةً. يمكن القول إنّ الشحنات الجزئيّة على ذرّات الهيدروجين (H) والفلور (F) في الرابط H—F أكبر من الشحنات الجزئيّة في الرابط H—Cℓ. ذرّة الفلور وذرّة الكلور ستحملان الشحنة السالبة الجزئيّة، بينما ذرّة الهيدروجين في كلتا الحالتَين، ستكون مشحونة بشحنة جزئيّة موجبة لأنها ذات سالبيّة كهربائيّة أقلّ.
إذا أردنا أن نُعبِّر عن مقدار الشحنة الجزئيّة وأن نفهم معنى أن تكون أكبر، نوضح ذلك على النحو التالي. نُشير مرّة أخرى إلى أنّ الأرقام التي سنراها الآن هي لأغراض التوضيح وليست قيمًا حقيقية.
لنفترض أنه في الرابط H—Cℓ الشحنة النسبيّة للهيدروجين هي 0.4+ بينما للكلور 0.4-. نلاحظ أنّ الشحنة جزئيّة وليست كاملة. في الرابط H—F، وهو رابط أكثر قطبيّةً/الفرق في السالبيّة الكهربائيّة فيه أكبر، ستكون الشحنة النسبيّة للهيدروجين 0.6+ وللفلور 0.6-.
نرى في المثال أنّ مقدار الشحنات الجزئيّة في الرابط H—F أكبر من تلك الموجودة في الرابط H—Cℓ. وذلك بسبب الفرق الأكبر في السالبيّة الكهربائيّة في الرابط H—F.
نذكر مرّة أخرى أنّ الأرقام التي تشير إلى الشحنة في المثال السابق، هي لغرض التوضيح وليست القيم الحقيقيّة.
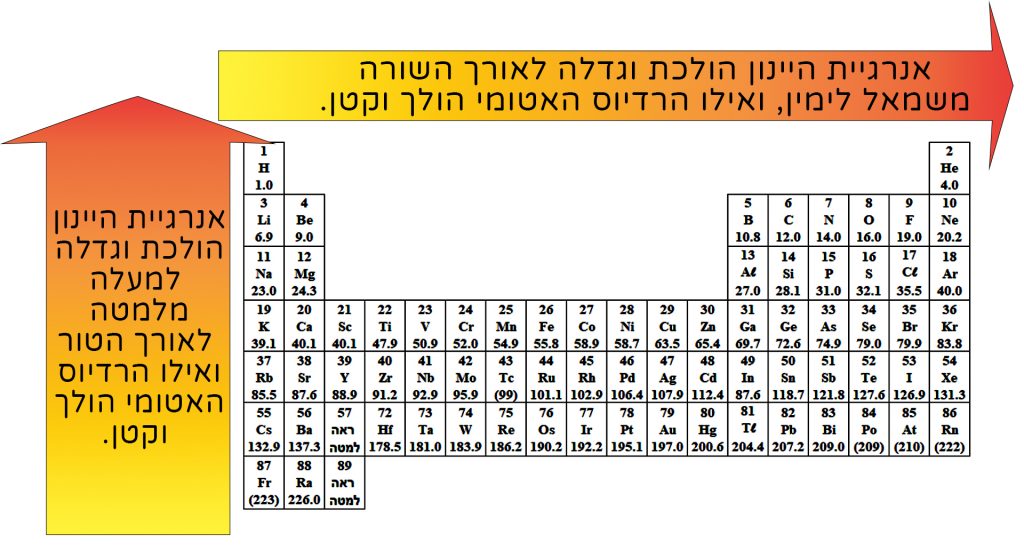
فيما يلي جزء من قائمة العناصر الدوريّة، التي تظهر فيها قيَم السالبيّة الكهربائيّة للذرّات المختلفة:

يمكننا أن نرى أنّه في قائمة العناصر الدوريّة، قيَم السالبيّة الكهربائيّة تزداد من اليسار إلى اليمين على امتداد السطر، ومن الأسفل للأعلى على امتداد العمود.
لا حاجة لحفظ قيَم السالبيّة الكهربائيّة عن ظهر قلب، لكن من المهمّ أن نتذكّر أنّ العنصر الذي لديه أعلى سالبيّة كهربائيّة هو ذرة الفلور (F). لهذا السبب، في جميع مركّباتها، ستكون ذات شحنة جزئيّة سالبة (-δ). تليها في القائمة ذرّة الأكسجين (O). من بين اللافلزّات، من المفضّل أن نتذكّر أنّ للهيدروجين (H) قيمة سالبيّة كهربائيّة منخفضة، لذلك في معظم مركّباته التي تتكوّن فيها روابط تساهميّة (باستثناء الحالات التي يرتبط فيها بالفوسفور (P) الذي له قيمة سالبيّة كهربائيّة مساوية للهيدروجين)، يكون الهيدروجين الذرّة الأقلّ سالبيّة كهربائيّة. لذلك شحنته النسبيّة الجزئيّة ستكون (+δ).
من الجدير بالذكر أيضًا أنّ الشحنات الجزئيّة لا تتعلّق ولا تتأثّر من رتبة الرابط. رتبة الرابط تُعبّر عن عدد أزواج الإلكترونات الرابطة في رابط تساهميّ معيّن بين ذرّتَيْن. الفرق في السالبيّة الكهربائيّة لا يتأثّر من رتبة الرابط.
لو نظرنا مثلًا إلى الرابط S—O مقارنةً بالرابط S ═ O سنكتشف أنّ كليهما قطبيّان بنفس المقدار. وذلك لأنّ الفرق في السالبيّة الكهربائيّة بينهما متساوٍ. في مرحلة لاحقة، سنتعلّم أنّ هناك فرقًا في قوّة الرابط فيهما.
فيما يلي بعض الأمثلة عن أسئلة حول قطبيّة الرابط:
- معطى الرابط التالي S ═ O. حدِّدوا ما إذا كان الرابط قطبيًّا أو نقيًّا. إذ كان الراب قطبيًّا، حدِّدوا على أيّ ذرّة ستكون الشحنة الجزئيّة السالبة.
الرابط S ═ O هو رابط قطبيّ. نلاحظ من قيَم السالبيّة الكهربائيّة في القائمة أنّ السالبيّة الكهربائيّة لذرّة الأكسجين (O) تختلف عن الكبريت (S). هذا يعني أنّ هناك فرقًا في السالبيّة الكهربائيّة بين الذرّتَيْن في الرابط. الفرق هو 1 = 2.5 – 3.5. لذلك، الرابط قطبيّ.
ذرّة الأكسجين ستكون مشحونة بشحنة سالبة جزئيّة لأنّه ذات سالبيّة كهربائيّة أعلى، لذلك فإنّ قوّة جذبها لأزواج الإلكترونات الرابطة أكبر.
نشير –δ على ذرّة الأكسجين، ونشير +δ على ذرّة الكبريت على النحو التالي:
يمكن أن نحدّد أنّ ذرّة الأكسجين هي ذات سالبيّة كهربائيّة أكبر، حتى بدون قيَم السالبيّة الكهربائيّة للذّرات المشاركة في الرابط. وذلك لأنّ ذرّة الأكسجين موجودة فوق ذرّة الكبريت في نفس العمود في قائمة العناصر الدوريّة. كما نعلم، كلّما ارتفعنا للأعلى في العمود، تكبر قيمة السالبيّة الكهربائيّة.
![]()
لذلك، قيمة السالبيّة الكهربائيّة لذرّة الأكسجين أكبر.
- أيّ رابط هو أكثر قطبيّةً: الرابط H—S أم H—N؟
لكي نحدّد أيّ رابط هو الأكثر قطبيّةً، علينا أن نفحص الفرق في قيَم السالبيّة الكهربائيّة للذرّات المختلفة في الروابط. نستعين بجدول السالبيّة الكهربائيّة. نلاحظ أنّ الفرق في السالبيّة الكهربائيّة في الرابط H — S هو 0.4 (2.1-2.5) بينما في الرابط N—H الفرق هو 0.9 (2.1-3.0). لذلك الرابط N—H أكثر قطبيّةً.
هناك حالات لا نحتاج فيها للاستعانة بقيَم السالبيّة الكهربائيّة لتحديد الرابط الأكثر قطبيّةً. يمكننا تحديد ذلك بحسب مكان العناصر في قائمة العناصر الدوريّة.
- بدون استخدام قيَم السالبيّة الكهربائيّة، حدِّدوا أيّ رابط هو الأكثر قطبيّةً H—O أم H—N.
الرابط الأكثر قطبيّةً هو H—O لأنّ ذرّة الأكسجين (O) وذرّة النيتروجين (N) موجودتان في نفس السطر في قائمة العناصر الدوريّة، لكنّ ذرّة الأكسجين موجودة إلى اليمين أكثر في السطر. على امتداد السطر، كلّما تواجدَ العنصر إلى اليمين أكثر، تكبر قيمة سالبيّته الكهربائيّة.
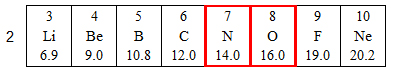
قيمة السالبيّة الكهربائيّة لذرّة الأكسجين أكبر، بحسب سلوك قيَم السالبيّة الكهربائيّة على امتداد السطر في قائمة العناصر الدوريّة. لذلك الفرق في السالبيّة الكهربائيّة بينتها وبين ذرّة الهيدروجين، أكبر من الفرق في السالبيّة الكهربائيّة بين ذرّة النيتروجين وذرّة الهيدروجين. الرابط H—O أكثر قطبيّةً.
هناك حالات تكون فيها لذرّات العناصر المختلفة نفس قيمة السالبيّة الكهربائيّة. في هذه الحالات، الفرق في السالبيّة الكهربائيّة سيكون مساويًا لـ 0 والرابط لن يكون قطبيًّا. مثلًا، الرابط B-As. في هذا الرابط، توجد للذرّتَين نفس قيمة السالبيّة الكهربائيّة، وهي 2.0، لذلك الفرق في السالبيّة الكهربائيّة مساوٍ لـ 0، والرابط هو رابط تساهميّ (كوفالنتيّ) غير قطبيّ.
عند حلّ التمارين المرفقة للدرس، يجب الاستعانة بجدول السالبيّة الكهربائيّة، الظاهر على الموقع في درس السالبيّة الكهربائيّة وقطبيّة الرابط.