صيغة التمثيل الإلكترونيّ للأيونات
قبل أن نتابع في موضوع الرابط التساهميّ (الكوفالنتيّ)، نتوقّف للحظة ونتعرّف على المزيد من التمثيل الإلكترونيّ.
هذه المرّة، صيغة التمثيل الإلكترونيّ ليست بالضرورة لموادّ متعادلة من حيث الشحنة الكهربائيّة، بل لأيونات.
سنتعلّم كيفيّة كتابة صيغة التمثيل الإلكترونيّ لأيون أحاديّ الذرّة، وهو أيون مكوّن من ذرّة واحدة فقط (هذا هو المطلوب في المنهاج التعليميّ في موضوع الكيمياء).
سنتعلّم كيفيّة تحديد ما إذا كانت صيغة تمثيل إلكترونيّ معيّنة تصِف مادّة متعادلة من حيث الشحنة الكهربائيّة أو أنّها تصف أيونًا موجبًا أو أيونًا سالبًا.
لنتذكّر أوّلًا ما هو الأيون.
الأيون هو ذرّة أو مجموعة ذرّات، مجموع الإلكترونات فيها غير مساوٍ لمجموع البروتونات. هذا الجُسَيم يكون مشحونًا بشحنة كهربائيّة.
كيف نكتب التمثيل الإلكترونيّ للأيون؟
نذكّركم أنّ صيغة التمثيل الإلكترونيّ تصف الإلكترونات في مستوى الطاقة الأخير.
فيما يلي بعض الأمثلة لصيغة التمثيل الإلكترونيّ لذرّات مختلفة ولأيوناتها أحاديّة الذرّة.
اكتبوا صيغة التمثيل الإلكترونيّ لذرّة الكلور (Cℓ) ولأيون الكلور (¯ Cℓ) .
صيغة التمثيل الإلكترونيّ لذرّة الكلور تُكتَب على النحو التالي:
 لأنّ ذرّة الكلور لديها 7 إلكترونات في مستوى الطاقة الأخير.
لأنّ ذرّة الكلور لديها 7 إلكترونات في مستوى الطاقة الأخير.
تعلّمنا ذلك في الدرس السابق.
بماذا تختلف صيغة التمثيل الإلكترونيّ للأيون عن الذرّة؟ ولماذا؟
أيون الكلور يحمل شحنة سالبة، “-“.
في درس الأيونات، ذكرنا أنّه إذا كان الحديث يدور عن أيون شحنته سالبة (“-“)، هذا يعني أنّ لديه إلكترونات أكثر من البروتونات، أيّ أنّه تضاف للذرّة إلكترونات.
بما أنّنا نتحدّث عن أيون شحنته 1- (لا حاجة لكتابة الـ 1 في الأيون)، يمكن الاستنتاج بأنّه أضيف له إلكترون واحد. لذلك، لديه فائض شحنة سالبة واحدة أكثر من الشحنات الموجبة.
لذلك، في صيغة التمثيل الإلكترونيّ تظهر 8 إلكترونات (نقاط) وليس 7 إلكترونات.
من المهمّ أن نتذكّر أنّه في صيغة التمثيل الإلكترونيّ للأيون، يجب كتابة الأيون بين قوسَيْن مربّعَيْن [ ]، وكتابة شحنة الأيون خارج القوسَيْن.
تعالوا نرى مثالًا آخر.
اكتبوا صيغة التمثيل الإلكترونيّ لذرّة أكسجين (O) وأيون أكسجين (O2-).
ذرّة الأكسجين

أيون الأكسجين

عند الحديث عن أيون موجب أحاديّ الذرّة، يجب الانتباه إلى أنّه عند تسجيل الذرّة، يجب أن يظهر عدد الإلكترونات كما يظهر في مستوى الطاقة الأخير، لكن عندما يدور الحديث عن أيون موجب، لا تكون هناك إلكترونات في مستوى الطاقة الأخير الذي كان معبّأً بالإلكترونات. لذلك، في صيغة التمثيل الإلكترونيّ للأيون الموجب أحاديّ الذرّة، لا نكتب الإلكترونات بين أقواس.
على سبيل المثال، اكتبوا التمثيل الإلكترونيّ للصوديوم (Na) ولأيون الصوديوم (Na+).
ذرّة الصوديوم

في الأيون الموجب، عدد الإلكترونات أصغر من عدد البروتونات، لأنّ الذرّة تخسر إلكترونًا. بما أنّ الحديث عن أيون شحنته 1+، هذا يعني أنّه خسِرَ إلكترونًا واحدًا. لذلك، صيغة التمثيل الإلكترونيّ للأيون هي:
[Na]+
فيما يلي مثال آخر
اكتبوا صيغة التمثيل الإلكترونيّ للألومنيوم (Aℓ) ولأيون الألومنيوم (Aℓ3+)
ذرّة الألومنيوم:

أيون الألومنيوم:
[Aℓ]3+
القسم التالي من الدرس هو إثراء
سنرى الآن تمارين تتمحور حول تحديد شحنة التركيبات الكيميائيّة التي فيها أكثر من ذرّة واحدة.
سنرى كيف يمكننا من خلال صيَغ التمثيل الإلكترونيّ أن نحدّد ما إذا كان الحديث يدور عن مادة متعادلة من الناحية الكهربائيّة أم أيون موجب أو سالب.
يمكننا القول إنه في صيغة التمثيل الإلكترونيّ، إذا كان عدد الإلكترونات مساويًا لعدد الإلكترونات الكلّيّ في المستويات الأخيرة فقط لكلّ واحدة من الذرّات، تكون المادّة متعادلة من الناحية الكهربائيّة.
وإذا كان عدد الإلكترونات أكبر من عدد الإلكترونات الكلّيّ لكلّ واحدة من الذرّات المشارِكة في التمثيل الإلكترونيّ، فإنّ الحديث يدور عن أيون سالب.
إذا كان عد الإلكترونات أقلّ من عدد الإلكترونات الكلّيّ لكلّ واحدة من الذرّات المشارِكة في التمثيل الإلكترونيّ، فإنّ الحديث يدور عن أيون موجب.
لننظر إلى المثال التالي:
معطاة صيغة التمثيل الإلكترونيّ التالية. هل تصف مادّة متعادلة من الناحية الكهربائيّة أم أيون؟
إذا كانت تصف أيونًا، هل شحنته موجبة أم سالبة؟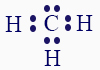 نتذكّر أنّه في صيغة التمثيل الإلكترونيّ، نصف مستوى الطاقة الأخير.
نتذكّر أنّه في صيغة التمثيل الإلكترونيّ، نصف مستوى الطاقة الأخير.
ذرّة الكربون (C) موجودة في العمود الرابع في قائمة العناصر الدوريّة. في مستوى الإلكترونات الأخير، لديها 4 إلكترونات. لذرّة الهيدروجين يوجد إلكترون واحد فقط في مستوى الطاقة الأخير.
لذلك، عندما نصف التركيبة الكيميائيّة CH3 من المفترض أن نمثّل 7 إلكترونات: 4 إلكترونات لذرّة الكربون وإلكترون واحد من كلّ واحدة من ذرّات الهيدروجين الثلاث أيّ 3، وبالمجمل 7 إلكترونات.
أيّ أنّنا عمليًّا نعدّ الإلكترونات الموجودة لكلّ ذرّة في المستوى الأخير في التمثيل، ونجمعها.
بما أنّه في صيغة التمثيل الإلكترونيّ المعطاة تظهر 8 إلكترونات (توجد 8 نقاط)، يمكن القول إنّه في صيغة التمثيل الإلكترونيّ المعطاة، يوجد فائض إلكترون واحد بالمقارنة مع الحالة المتعادلة. نذكّركم أنّه في الحالة المتعادلة، قمنا بجمع إلكترونات الذرّة بدون إضافة أو تقليل إلكترونات.
لذلك، صيغة التمثيل الإلكترونيّ المعطاة تصف أيونًا سالبًا، ويمكن كتابتها الآن على النحو التالي:
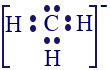
تعالوا نرى مثالًا آخر.
معطاة صيغة التمثيل الإلكترونيّ التالية. هل تصف مادّة متعادلة من الناحية الكهربائيّة أم أيون؟
إذا كانت تصف أيونًا، هل شحنته موجبة أم سالبة؟

لذرّة الكربون (C) الموجودة في العمود الرابع في قائمة العناصر الدوريّة، يوجد في مستوى الطاقة الأخير 4 إلكترونات، بينما لذرّة الهيدروجين يوجد إلكترون واحد فقط في مستوى الطاقة الأخير.
لذلك، عندما نصِف التركيبة الكيميائيّة CH3 من المفترض أن نُمثّل 7 إلكترونات. 4 إلكترونات لذرّة الكربون وإلكترون واحد من كل ذرّة من ذرّات الهيدروجين، أي 3، وبالمجمل 7 إلكترونات. بما أنّه في صيغة التمثيل الإلكترونيّ المعطاة تظهر 6 إلكترونات (توجد 6 نقاط)، يمكن القول إنّه في صيغة التمثيل الإلكترونيّ المعطاة، يوجد نقص إلكترون واحد بالمقارنة مع الحالة المتعادلة. نذكّركم أنّه في الحالة المتعادلة، قمنا بجمع الإلكترونات بدون إضافة أو تقليل إلكترونات.
لك، صيغة التمثيل الإلكترونيّ المعطاة تصِف أيونًا موجبًا. نكتب الأيون على النحو التالي:
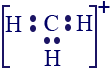
ننتقل الآن إلى مثال آخر.
معطاة صيغة التمثيل الإلكترونيّ التالية. هل تصِف مادّة متعادلة من الناحية الكهربائيّة أم أيون؟
إذا كانت تصِف أيونًا، هل شحنته موجبة أم سالبة؟
![]()
نستعين مرّة أخرى بقائمة العناصر الدوريّة.
ذرّة النيتروجين (N) موجودة في العمود الخامس، أيّ لديها 5 إلكترونات في مستوى الطاقة الأخير.
ذرّة الكربون (C) موجودة في العمود الرابع، أيّ لديها 4 إلكترونات في مستوى الطاقة الأخير.
ذرّة الأكسجين (O) موجودة في العمود السادس، أيّ لديها 6 إلكترونات في مستوى الطاقة الأخير.
بالمجمل، كان يجب أن يكون في صيغة التمثيل الإلكترونيّ المعطاة 15 إلكترونًا (6+5+4). هذه هي الحالة المتعادلة.
لو قمنا بعَدّ الإلكترونات في صيغة التمثيل الإلكترونيّ، سنجد 16 إلكترونًا، أيّ أنّ هناك “فائض” إلكترون واحد، بالمقارنة مع الحالة المتعادلة. لذلك، هذا أيون سالب.
![]()
معطاة صيغة التمثيل الإلكترونيّ التالية. هل تصف مادّة متعادلة من الناحية الكهربائيّة أم أيون؟
إذا كانت تصف أيونًا، هل شحنته موجبة أم سالبة؟
![]()
ذرّة النيتروجين (H) موجودة في العمود الأوّل، أيّ لديها إلكترون واحد في مستوى الطاقة الأخير.
ذرّة الكلور (Cℓ) موجودة في العمود السابع، أيّ لديها 7 إلكترونات في مستوى الطاقة الأخير.
ذرّة الأكسجين (O) موجودة في العمود السادس، أيّ لديها 6 إلكترونات في مستوى الطاقة الأخير.
بالمجمل، كان يجب أن يكون في صيغة التمثيل الإلكترونيّ المعطاة 14 إلكترونًا (6+7+1). هذه هي الحالة المتعادلة.
لو قمنا بعَدّ الإلكترونات في صيغة التمثيل الإلكترونيّ، سنجد 14 إلكترونًا، مثل عدد الإلكترونات بحسب الموجود لكلّ عنصر في مستوى الطاقة الأخير. لذلك المادّة متعادلة.
الاستبيان المرفق لهذا الدرس هو بمثابة إثراء، وهو ليس جزءًا من المنهاج التعليميّ.

