قائمة العناصر الدوريّة
قائمة العناصر الدوريّة هي القائمة التي تُركّز كلّ العناصر في جدول واحد مرتب ومنظّم. في الدرس السابق تحدّثنا عن ترتيب الإلكترونات. في هذا الدرس سنتعلّم عن مبنى قائمة العناصر الدوريّة وعن العلاقة بين ترتيب الإلكترونات والعدد الذرّيّ للعناصر المختلفة وبين قائمة العناصر الدوريّة وموقع العناصر المختلفة فيها. قائمة العناصر الدوريّة مبنيّة من أعمدة وأسطر:
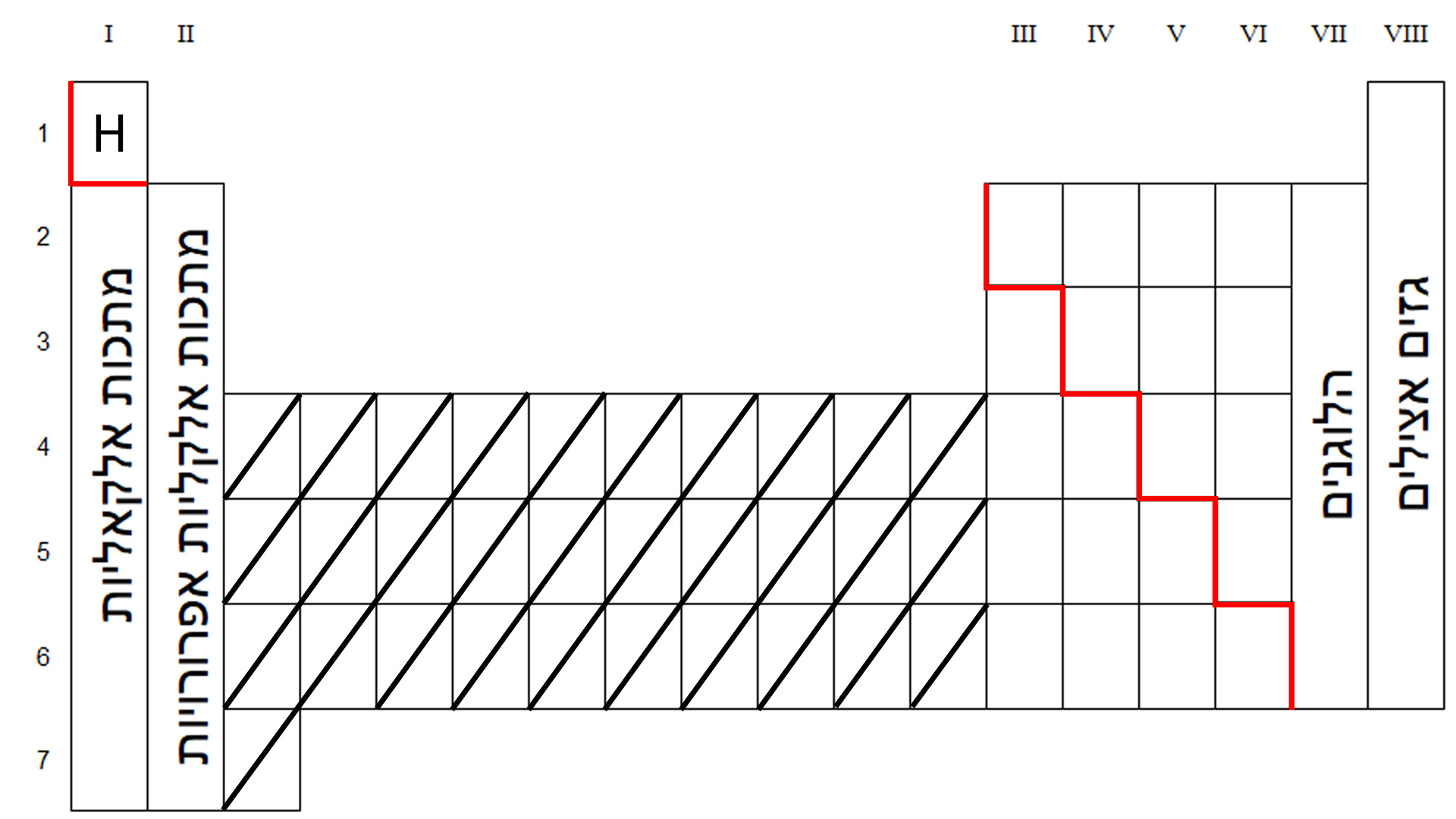
- العمود ↨ (من الأعلى إلى الأسفل) يُسمّى أيضًا عائلة.
في قائمة العناصر الدوريّة توجد ثمانية أعمدة، مُرقّمة من 1 حتى I – VIII) 8). في مركز القائمة، الجزء المخطّط غير مرقّم.
- السطر ↔ (من اليسار إلى اليمين) يُسمّى أيضًا دورة. في قائمة العناصر الدوريّة توجد 7 دورات (7-1).
سنرى في دروس الكيمياء التالية، أنّ للعناصر الواقعة في نفس العمود في القائمة الدوريّة تصرُّفًا كيميائيًّا متشابهًا، لذلك فهي تتصرّف كعائلة. بينما في الدورة (السطر)، سنرى أنّ هناك تغييرات تطرأ على صفات العناصر والقيَم التي تُقاس، مثل حجم الذرّة (نصف قُطرها). يمكن تصنيف العناصر في القائمة الدوريّة إلى فلزّات، لا فلزّات وغازات خاملة. في الرسم التوضيحيّ غير الدقيق للقائمة الدوريّة، الذي يظهر أدناه، نرى خطًّا أحمر مشدّدًا. هذا الخطّ غير موجود في كلّ القوائم طبعًا. في هذه القائمة، يفصل هذا الخطّ بين مجموعة الفلزّات، الواقعة على يسار الخطّ، وبين مجموعة اللا فلزّات الواقعة على يمين الخطّ. ذرّة الهيدروجين أيضًا، الواقعة في العمود الأوّل، تنتمي إلى مجموعة اللا فلزّات. انتبِهوا إلى أنّه في ترتيب الإلكترونات للهيدروجين، يوجد إلكترون واحد في مستوى الطاقة الأخير.
في المنطقة المُخطّطة، تقع فلزّات تسمّى فلزّات انتقاليّة. هذه مجموعة عناصر لا نحتاج إلى كتابة ترتيب الإلكترونات لذرّاتها.
نعود إلى الأعمدة في القائمة الدوريّة. لبعض الأعمدة اسم يميّزها.
- فلزّات العمود الأوّل تُسمّى فلزّات قلويّة.
- فلزّات العمود الثاني تُسمّى فلزّات قلويّة ترابيّة.
- مجموعة اللا فلزّات في العمود السابع تُسمّى هالوجينات.
- مجموعة العناصر في العمود الثامن تُسمّى غازات خاملة.
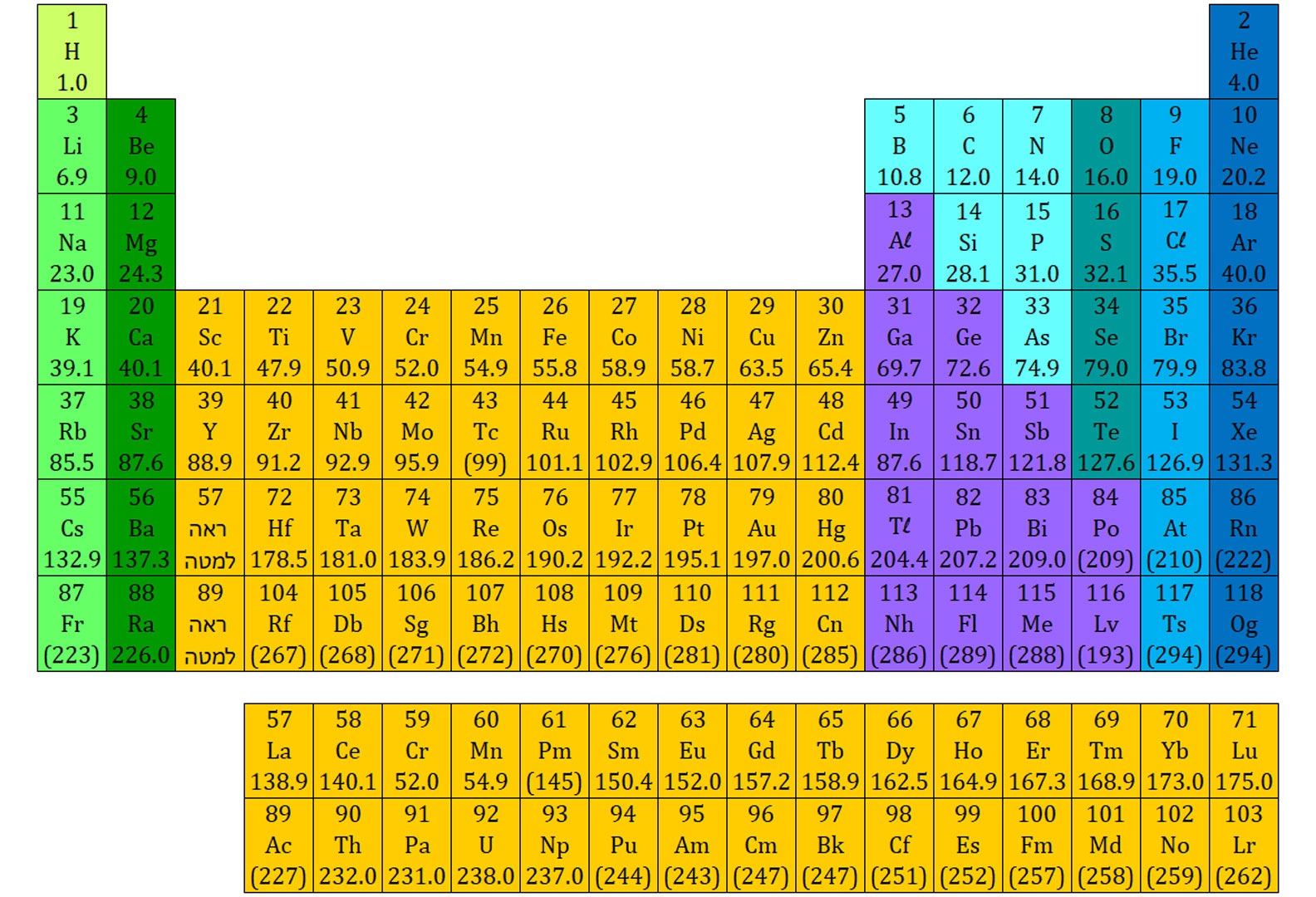
في قائمة العناصر الدوريّة يوجد سطران يقعان خارج القائمة: العناصر 71-57 والعناصر 103-89.
هذه مجموعة عناصر تنتمي إلى الفلزّات. هذه الفلزّات تظهر في سطرَين منفردَين خارج القائمة، وإلّا كانت القائمة ستبدو هكذا:
مبنى القائمة في هذه الحالة طويل وغير مريح للعمل. لذل، تمّ تغيير القائمة للمبنى المعروف، كما يظهر في القائمة العلويّة.
في القائمة الدوريّة، العناصر مرتّبة على امتداد السطر من اليسار إلى اليمين بترتيب تصاعديّ ومتتالٍ، بحسب عددها الذرّيّ. هناك علاقة بين ترتيب الإلكترونات لذرّات العناصر، وبين موقع العناصر في القائمة الدوريّة.
ما طبيعة هذه العلاقة؟
- عدد الإلكترونات في المستوى الخارجيّ للعنصر، يُشير إلى رقم العمود الذي يقع فيه العنصر في القائمة (I-VIII).
- عدد مستويات الطاقة المُعبّأة بالإلكترونات هو رقم السطر. (7-1).
على سبيل المثال: لننظر إلى عنصر البوتاسيوم، الذي عدده الذرّيّ 19.
ترتيب الإلكترونات في هذا العنصر هو:
K )2e‾ )8e‾ )8e‾ )1e‾
يمكن أن نُحدِّد أنّ البوتاسيوم يقع في العمود الأوّل، في السطر الرابع من القائمة الدوريّة.
يقع البوتاسيوم في العمود الأوّل لأنّ لديه إلكترونًا واحدًا في مستوى الطاقة الخارجيّ، وفي السطر الرابع لأنّ لديه أربعة مستويات طاقة مُعبّأة.

كلّ عاصر العمود الأوّل تتميّز بأنّ لديها إلكترون واحد في مستوى الطاقة الخارجيّ. وبشكل عام أكثر، لكلّ العناصر الواقعة في عمود معيّن، يوجد عدد إلكترونات متشابه في المستوى الخارجيّ.
لو أخذنا عناصر من دورة معيّنة، أيّ من سطر معيّنة، سنرى أنّ لجميعها نفس عدد مستويات الطاقة.
الإلكترونات الموجودة في مستوى الطاقة الخارجيّ تسمّى إلكترونات التكافؤ أو الإلكترونات الفالنتيّة.
فيما يلي مثال آخر.
ترتيب الإلكترونات في مستويات الطاقة لعنصر اليود:
I )2e‾ )8e‾ )18e‾ )18e‾ )7e‾
لديه 7 إلكترونات تكافؤ، أيّ 7 إلكترونات في المستوى الخارجيّ، لذلك يقع عنصر اليود في العمود السابع من القائمة الدوريّة. توجد لليود 5 مستويات طاقة مُعبّأة، لذلك يقع في السطر الخامس من القائمة الدوريّة.