الصيغة الجُزَيئيّة وصيغة التمثيل الإلكترونيّ
كما ذكرنا، سنتعرّف خلال هذا الفصل على عدّة طرق لوصف/كتابة/تمثيل الناتج الذي يتمّ الحصول عليه في العمليّة. في هذا الدرس، سنتحدّث عن الصيغة الجُزَيئيّة وصيغة التمثيل الإلكترونيّ.
ما هي الصيغة الجُزَيئيّة؟
تصِف الصيغة الجُزَيئيّة تركيبة تركيبة الجُزَيء بواسطة الرمز الكيميائيّ للعناصر التي تكوّنه. إلى جانب الرموز الكيميائيّة، يظهر عدد الذرّات من كلّ نوع. عدد الذرّات يُكتَب على يمين الرمز الكيميائيّ، بخطّ صغير من الأسفل، كما تعلّمنا في درس لغة الكيميائيّين.
في حالة جُزَيء الهيدروجين، الصيغة الجُزَيئيّة هي H2.
هناك طريقة أخرى لتمثيل الجُزَيء، وهي بواسطة صيغة التمثيل الإلكترونيّ، المُسّمى أيضًا مبنى لويس/صيغة لويس.
ما هي صيغة التمثيل الإلكترونيّ؟
صيغة التمثيل الإلكترونيّ هي طريقة كتابة تصِف ترتيب إلكترونات التكافؤ في الجُزَيء أو في الذرّة. في هذه الطريقة، يتمّ تمثيل الذرّة بواسطة الرمز الكيميائيّ للعنصر. تظهر حولها نقاط تمثّل إلكترونات التكافؤ، أيّ الإلكترونات التي تتواجد في مستوى الطاقة الأخير المعبّأ بالإلكترونات.
سنرى الآن بعض الأمثلة، ونعود للرابط التساهميّ (الكوفالنتيّ)
سنبدأ بالتمثيل الإلكترونيّ للذرّات المنفردة:
بما أنّ ذرّة الهيدروجين لها إلكترون تكافؤ واحد، صيغة تمثيلها الإلكترونيّ هي:
النقطة تمثّل إلكترون ذرّة الهيدروجين في مستوى الإلكترونات الأخير. هذا هو إلكترون التكافؤ لذرّة الهيدروجين.
كان من الممكن أن تكون النقطة من الجهة الأخرى، أو من الأعلى، أو من الأسفل. من المتّبع كتابة الإلكترون الواحد بهذه الطريقة.
بدلًا من النقطة، يمكن الإشارة إلى الإلكترون بـ x
H ×
لذرّة البورون 3 إلكترونات تكافؤ، لذلك صيغة تمثيلها الإلكترونيّ هي:
![]()
للنيتروجين5 (N) إلكترونات تكافؤ. لذلك صيغة تمثيله الإلكترونيّ ستكون على النحو التالي:
![]()
هناك مصطلح آخر يجب معرفته في هذا الدرس، وهو إلكترون غير مُزدوَج (إلكترون فرديّ او إلكترون بدون زوج).
لذرّة النيتروجين ثلاثة إلكترونات غير مُزدوَجة، مشار إليها بالسهم كما يظهر أدناه:
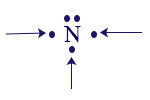
في تكملة الدرس، سنرى أنّ هناك أهميّة لعدد الإلكترونات غير المُزدوَجة في ذرّات اللافلزّات المختلفة.
أكبر عدد من الإلكترونات في صيغة التمثيل الإلكترونيّ للذرّة، هو عندما تكون للذرّة 8 إلكترونات تكافؤ، غاز خامل. دعونا نرى ذلك في المثال التالي:
للأرغون 8 إلكترونات تكافؤ أو إلكترونات فالنتيّة. لذلك، صيغة تمثيله الإلكترونيّ ستكون على النحو التالي:
![]()
هناك حالة استثنائيّة في التمثيل الإلكترونيّ في الذرّات المنفردة، وهي ذرّة الهيليوم (He).
لذرّة الهيليوم إلكترونا (2) تكافؤ. بما أنّ للهيليوم يوجد مستوى طاقة واحدًا معبّأً، وهو المستوى الأوّل الذي يمكن أن يتّسع حتى إلكترونَيْن، صيغة تمثيله الإلكترونيّ ستكون على النحو التالي:
![]()
![]()
نعود الآن لجُزَيء الهيدروجين، الذي يحتوي على ذرّتَيْن كوّنتا رابطًا تساهميًّا وشاركتا إلكترونات التكافؤ لتكوين جُزَيء الهيدروجين H2. نكتب صيغة التمثيل الإلكترونيّ (صيغة لويس) لهذا الجُزَيء.
إلكترونات التكافؤ لكلّ واحدة من ذرّتَيْ الهيدروجين، تكوِّن الرابط التساهميّ. يجب وصف زوج الإلكترونات المشترك الذي تكوّنَ نتيجة الرابط التساهميّ) كزوج إلكترونات رابط بين ذرّتَيْ الهيدروجين. صيغة التمثيل الإلكترونيّ ستكون على النحو التالي:
![]()
نُعرِّف زوج الإلكترونات الرابط أو المشترك.
زوج الإلكترونات المشترك/الرابط هو زوج الإلكترونات الذي يتكوّن نتيجة مشاركة الإلكترونات، لذلك بهو يتواجد في مدار جُزَيئيّ. زوج الإلكترونات ينتمي للذرّتَيْن اللتَيْن شاركتا الإلكترونات بينهما.
الرابط بين ذرّتَيْ الهيدروجين يسمّى أيضًا رابط تساهميّ (كوافالنتيّ) فرديّ.
الرابط التساهميّ الفرديّ هو رابط تساهميّ (كوفالنتيّ) فيه زوج مشترك واحد فقط من الإلكترونات الرابطة بين ذرّتَيْن في الجُزَيء.
يمكن كتابة كلّ زوج إلكترونات، رابط أو غير رابط، بواسطة خطّ. سنرى أمثلة على ذلك في الدروس القادمة. في هذه الموقع، سنتّبع بشكل عام طريقة كتابة الإلكترونات في صيغة التمثيل الإلكتروني بواسطة نقاط.
نعود الآن إلى تكوُّن الرابط التساهميّ بين ذرّتَيْن، ونفحص ما يحدُث عندما تلتقي ذرّتا كلور ببعضهما البعض.
لذرّة الكلور توجد 7 إلكترونات في مستوى الإلكترونات الأخير. نذكّركم بأنّ الكلور يقع في العمود السابع، عمود الهالوجينات في قائمة العناصر الدوريّة. صيغة التمثيل الإلكترونيّ لذرّة الكلور، هي على النحو التالي:
![]()
في جُزَيء الكلور، يوجد رابط تساهميّ بين ذرّتَيّ الكلور. كلّ واحدة من ذرّتَيّ الكلور ستشارك الإلكترون الفرديّ، الإلكترون غير المُزدوَج، لتكوين الرابط.
سنحصل على حالة جديدة تبدو على النحو التالي:
![]()
نلاحظ الآن أنّه حول كلّ ذرّة، توجد 8 إلكترونات. حول كلّ ذرّة كلور توجد 3 أزواج إلكترونات غير رابطة (6 إلكترونات)، ويوجد أيضًا زوج إلكترونات رابط واحد، وهو مشترك للذرّتَيْن معًا. حول كلّ ذرّة في هذه الحالة، توجد 8 إلكترونات. يمكن القول أيضًا إنّه بين ذرّتَيّ الكلور يوجد رابط تساهميّ فرديّ، كما في ذرّتَيّ الهيدروجين، أيّ أنّه بين ذرّتَيّ الكلور يوجد زوج إلكترونات رابط (مشترك) واحد.
ننتقل إلى مثال آخر عن ذرّة الأكسجين (O).
صيغة التمثيل الإلكترونيّ لذرّة الأكسجين هي على النحو التالي:
![]()
لذرّة الأكسجين يوجد إلكترونان غير مُزدوَجَين، أيّ إلكترونان ليس لهما زوج.
لنرى الآن ما يحدُث عندما “تلتقي” ذرّتا أكسجين ببعضهما البعض:
![]()
إذا شاركَت ذرّتا الأكسجين إلكترونًا واحدًا فقط بينهما، سنحصل على الحالة التالية:
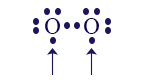
في هذه الحالة، لكلّ ذرّة أكسجين توجد 7 إلكترونات، لكن ما زال لكلّ واحدة منهما إلكترون واحد غير مُزدوَج، مشار إليه بسهم. لذلك، بين هاتَيْن الذرّتَيْن ستحدُث مشاركة إلكترونات إضافيّة، والحالة الجديدة ستبدو على النحو التالي:
![]()
الآن، حول كلّ ذرّة أكسجين توجد 8 إلكترونات. حول كلّ ذرّة أكسجين يوجد زوجان من الإلكترونات غير الرابطة، وبين ذرّتَيّ الأكسجين يوجد الآن زوجان من الإلكترونات الرابطة أو المشتركة.
الرابط بين ذرّتَيّ الأكسجين يسمّى رابط تساهميّ (كوفالنتيّ) زوجيّ.
الرابط التساهميّ الزوجيّ هو رابط فيه زوجان من الإلكترونات الرابطة بين ذرّتَيْن في جُزَيء له روابط تساهميّة (كوفالنتيّة).
المثال التالي هو بين ذرّتَيْ نيتروجين. صيغة التمثيل الإلكترونيّ للنيتروجين هي:
![]()
لذرّة النيتروجين 3 إلكترونات غير مُزدوَجة (فرديّة). عندما تكوِّن ذرّتا النيتروجين جُزَيء النيتروجين، سنحصل على الحالة التالية:
![]()
بين ذرّتَيّ النيتروجين سيتكوّن رابط ثلاثيّ، أيّ أنّه ستكون بين ذرّتَيّ النيتروجين 3 أزواج إلكترونات مشتركة. نلاحظ الآن أنّه حول كلّ ذرّة نيتروجين توجد 8 إلكترونات، وذلك نتيجة تكوُّن الروابط التساهميّة (الكوفالنتيّة) بين ذرّتَيّ النيتروجين.
يمكن القول إنّه خلال تكوُّن الروابط التساهميّة (الكوفالنتيّة) بين ذرّات اللافلزّات، فإنّ كلّ ذرّة من اللافلزّ تشارك عدد إلكترونات مساويًا لعدد الإلكترونات التي تنقصها في مستوى الطاقة الأخير للوصول إلى المستوى المليء. بكلمات أخرى، كلّ ذرّة لافلزّ ستشارك عدد إلكترونات مساويًا لعدد الإلكترونات غير المُزدوَجة/الفرديّة التي لديها.
ذرّة الهيدروجين وذرّة الكلور شاركتا إلكترونًا واحدًا لأنّه كان ينقصهما إلكترون واحد في مستوى الطاقة الأخير لإكماله لمستوى مليء.
ذرّة الأكسجين التي لديها 6 إلكترونات في المستوى الأخير، شاركَت إلكترونَيْن، لأنّه كان ينقصها إلكترونان في مستوى الطاقة الأخير لإكماله لمستوى مليء.
ذرّة النيتروجين التي لديها 5 إلكترونات في المستوى الأخير، شاركَت 3 إلكترونات لأنّه كان ينقصها 3 إلكترونات في مستوى الطاقة الأخير لإكماله لمستوى مليء.
رأينا أنّه من الممكن أن يتكوّن رابط فرديّ، زوجيّ أو ثلاثيّ. لا يمكن لذرّتَيْن أن تكوِّنا بينهما رابطًا رباعيًّا، ، أيّ رابط فيه 4 أزواج إلكترونات مشتركة.
لنعمّم القاعدة على الجُزَيْئات البسيطة:
- الذرّة التي ينقصها إلكترون واحد، تكوِّن في أغلب الحالات روابط فرديّة فقط، أيّ أنّها ستشارك إلكترونًا واحدًا فقط. هناك ذرّات شاذّة، لن نتطرّق إليها في هذه المرحلة.
- الذرّة التي ينقصها إلكترونان، يمكن أن تكوِّن رابطًا زوجيًّا، أو رابطَيْن فرديَّيْن. هناك شواذ في هذه الحالة أيضًا، ولن نتطرّق إليها في هذه المرحلة.
- الذرّة التي ينقصها 3 إلكترونات، يمكن أن تكوِّن 3 روابط فرديّة، أو رابطًا فرديًّا ورابطًا زوجيًّا ، أو رابطًا واحدًا ثلاثيًّا. هناك شواذ في هذه الحالة أيضًا، ولن نتطرّق إليها في هذه المرحلة.
- الذرّة التي ينقصها 4 إلكترونات، يمكن أن تكوِّن رابطًا ثلاثيًّا ورابطًا فرديًّا، أو رابطَيْن زوجيَّيْن، أو رابطًا زوجيًّا ورابطَيْن فرديَّيْن، أو أربعة روابط فرديّة مع الذرّات المختلفة. هناك شواذ في هذه الحالة أيضًا، ولن نتطرّق إليها في هذه المرحلة.
