صِفات الموادّ الجُزَيئيّة
في الدروس الثلاثة الأخيرة، تعلّمنا كيفيّة التعرّف على الموادّ الجُزَيئيّة. نذكّركم بأنّ هذه الموادّ مكوّنة من جُزَيئات. تعلّمنا أيضًا عن التأثيرات المتبادلة بين الجُزَيئات.
رأينا أنّ قوّة التأثيرات المتبادلة بين الجُزَيئات تؤثّر على درجات انصهار وغليان الموادّ، وكذلك على حالة المادّة في درجة حرارة الغرفة. هناك صفات أخرى لهذه الموادّ، وسنناقشها هنا. سنبدأ بذائبيّة الموادّ الجُزَيئيّة في بعضها البعض.
سنشاهد فيديو قصيرًا يوضّح عمليّة الإذابة بين موادّ جُزَيئيّة مختلفة:
سنعرض هنا مجموعة من التجارب الأخرى لكي نشرح عمليّة الإذابة بين الموادّ الجُزَيئيّة.
تجربة رقم 1
نضع في الدورق ماء (H2O) ونضيف إليه سيكلوهكسان (C6H12). النتيجة التي نحصل عليها تبدو كالتالي:
لاحِظوا أنّنا حصلنا على طبقتَين من الموادّ التي لا تختلط معًا، وكأنّنا وضعنا حاجزًا بينهما، بحيث لا يسمح باختلاطهما. في الواقع، لا يوجد أيّ حاجز بين السائلَين، وهناك تفسير آخر لعدم ذوبان سيكلوهكسان في الماء.
التفسير له علاقة بالروابط لبين جُزيئيّة بين جُزَيئات الماء والسيكلوهكسان.
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة، بينما سيكلوهكسان هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. لذلك، لا تتكوّن روابط أو تأثيرات متبادلة بين جُزَيئات الماء وجُزَيئات السيكلوهكسان. وبالتالي، لا يذوب السيكلوهكسان في الماء.
حتى لو حاولنا خلط السائلَين، سنحصل على محلول مُعكّر (غير صافٍ). هذه إحدى العلامات على أنّ المادّتَين لا تذوبان ببعضهما البعض. إذا توقفنا عن خلط المحلول، ستنفصل الطبقات عن بعضها وتعود الحالة إلى ما كانت عليه في الصورة. المادّة التي تطفو في الطبقة العلويّة هي المادّة التي كثافتها أصغر، مثل الفلّين (الكلكر) الذي يطفو على وجه الماء.
يمكن القول إنّ الخلط بين الماء والسيكلوهكسان لا يحدُث لأنّ الروابط الهيدروجينيّة بين جُزَيئات الماء أقوى، لذلك فإنّ جُزَيئات السيكلوهكسان لا تنجح في تفكيكها من أجل تكوين تأثيرات متبادلة ڤان در ڤالس.
لنوسّع الشرح قليلًا بخصوص عمليّة الإذابة.
لكي يتكوّن محلول يحتوي على مُذيب ومُذاب، فإنّ جُزء من التأثيرات المتبادلة بين جُزَيئات المُذيب يجب أن تتفكّك، وكذلك أيضًا جُزء من التأثيرات المتبادلة بين جُزَيئات المُذاب. في نفس الوقت، يجب أن تتكوّن تأثيرات متبادلة بين جُزَيئات المُذيب وجُزَيئات المُذاب.
لا يمكن أن تتكوّن دائمًا تأثيرات متبادلة بين جُزَيئات المُذيب وجُزَيئات المُذاب. أحيانًا، تكون تأثيرات المتبادلة التي تتكوّن بين جُزَيئات المُذيب وجُزَيئات المُذاب ضعيفة جدًا. لذلك، جُزَيئات المُذيب لا تنفصل عن بعضها البعض، وكذلك جُزَيئات المُذاب لا تنفصل عن بعضها البعض. النتيجة هي أنّ المادّتَين لا تذوبان ببعضهما البعض.
هناك تفسير آخر لعدم حدوث عمليّة الإذابة بين المُذيب والمُذاب، وهو أنّ التأثيرات المتبادلة بين جُزَيئات المُذيب قويّة، لذلك لا تنفصل الجُزَيئات، والتأثيرات المتبادلة بين جُزَيئات المُذاب قويّة وهي لا تنفصل عن بعضها البعض. أحيانًا، التأثيرات المتبادلة بين جُزَيئات المُذيب وكذلك التأثيرات المتبادلة بين جُزَيئات المُذاب تكون قويّة، لذلك لا تنفصل عن بعضها البعض. النتيجة هي عدم تكوُّن تأثيرات متبادلة بين جُزَيئات المُذيب وجُزَيئات المُذاب.
كلّ هذه التفسيرات مرتبطة أيضًا بتغييرات الطاقة التي تحدُث في عمليّة الإذابة من نوع إنثالبيا وإنتروبيا. سنتطرّق لها في الفصول القادمة.
تجربة رقم 2
في التجربة التالية سنرى ماذا يحدُث عندما نحاول إذابة اليود (I2) في السيكلوهكسان (C6H12).
نحصل على محلول باللون البنفسجيّ. المحلول صافٍ ومتجانس. إذًا حصلنا بعد خلط مادّة معيّنة في سائل على خليط متجانس وصافٍ، هذا يعني أنّ المادّة قد ذابت في السائل.
يمكن أن نلاحظ أنّ اليود قد ذاب في السيكلوهكسان. لماذا؟
اليود والسيكلوهكسان هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس. لذلك، عندما نخلطهما، تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان وبين جُزَيئات اليود، وتذوب المادّتان ببعضهما البعض.
يمكن تيمكن تمثيل عمليّة الإذابة بصياغة تفاعل كيميائيّ. صياغة العمليّة تنتمي لمستوى الرمز. قبل أن نقوم بصياغة التفاعل، نذكّركم بمستويات الفهم (الشرح) الثلاثة التي نعرف كيفيّة التعامل معها:
- المستوى الميكروسكوبيّ: على المستوى الميكروسكوبيّ، نَصِف الجُسَيمات المشاركة في العمليّة، التأثيرات المتبادلة بينها بما في ذلك الشرح المفصّل (مثلًا: ما إذا كانت بينها روابط هيدروجينيّة)، طريقة تحرُّك الجُسَيمات (إزاحة، دوران، ذبذبة) ومدى ترتيب الجُسَيمات في المادّة نسبةً للحالة الصلبة.
- المستوى الماكروسكوبيّ: على المستوى الماكروسكوبيّ، نَصِف ما نراه، نسمعه، نشمّه أو نقيسه (مشاهَدة).
- مستوى الرمز: على مستوى الرمز، نرسم، نرمز ونصيغ ما يحدُث بالطريقة المتّبعة.
نعود لصياغة التفاعل التي حدثت ونَصِف فيها مستويات الفهم (الشرح) الثلاثة التي نعرفها.
- المستوى الماكروسكوبيّ: كما ذكرنا، عندما أضفنا حبيبات اليود الصلب، باللون البنفسجيّ الغامق جدًا، إلى السيكلوهكسان السائل الشفّاف، “اختفى” اليود الصلب وتحوّل من شفّاف (عديم اللون) إلى سائل بنفسجيّ صافٍ (غير معكّر).
- المستوى الميكروسكوبيّ: نكتب الشرح لذوبان المادّتَين ببعضهما، لكن نُفصّل أكثر ونتطرّق إلى الجُسَيْمات والتأثيرات المتبادلة بينها:
اليود والسيكلوهكسان هما مادّتان جُزَيئيّتان. توجد بين جُزَيئاتهما تأثيرات متبادلة ڤان در ڤالس، الناجمة عن التقاطُبات اللحظيّة التي تتكوّن بسبب حركة الإلكترونات. عندما نخلط المادّتَين، فإنّ بعض التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات اليود تتفكّك، وكذلك أيضًا بعض التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان. في نفس الوقت، هناك تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان وجُزَيئات اليود. في هذه الحالة، - أنماط حركة جُسَيمات المادّة هي ذبذبة ودوران.
- مستوى الرمز: صياغة العمليّة
العمليّة التي سنصيغها تسمّى عمليّة إذابة. هذه صياغة تصف العمليّة التي حدثت في التجربة. عند صياغة عمليّة الإذابة، من المُتّبع أن نكتب في المتفاعِلات المادّة المُذابة، أيّ اليود في هذه الحالة I2(s).
نكتب فوق السهم المادّة المُذيبة، السيكلوهكسان في هذه الحالة (C6H12).
نكتب في الناتج ما نحصل عليه. في هذه الحالة، حصلنا على جُزَيئات يود وحولها جُزَيئات سيكلوهكسان. نكتب ذلك على النحو التالي:I2(C6H12)
- الآن، نصيغ عمليّة إذابة اليود في السيكلوهكسان. سنكتب ذلك بطريقة تعليمات تظهر كجزء من سؤال.
صيغوا عمليّة إذابة اليود في السيكلوهكسان.
سننتقل الآن إلى أمثلة إضافيّة وإلى تجارب إضافيّة.
لنأخذ الإيثانول (C2H5OH) الذي ينتمي لعائلة الموادّ الجُزَيئيّة. نذكّر أنّ الإيثانول مكوّن فقط من ذرّات لافلزّات توجد بينها روابط تساهميّة.
يمكن أن ينتمي الإيثانول أيضًا لعائلة موادّ أخرى تسمّى الموادّ الكحوليّة. الموادّ الكحوليّة هي موادّ تحتوي على مجموعة وظيفيّة OH. مجموعة الـ OH مرتبطة بجزء هيدروكربونيّ. فيما يلي بعض الأمثلة لموادّ كحوليّة مختلفة: C3H7OH ،C4H9OH. هناك موادّ كحوليّة كثيرة أخرى. فيما بعد سنعود إلى عائلة الموادّ الكحوليّة وعائلات كيميائيّة أخرى لها مجموعة وظيفيّة.
نعود إلى الإيثانول. انتبِهوا إلى أنّه يمكن أن نتحدّث عن جزأين منفردين في الإيثانول: الجزء الهيدروكربونيّ والجزء الذي يحتوي على مجموعة الـ OH.
التمثيل الكامل للصيغة البنائيّة لجُزَيء الإيثانول يبدو كالتالي:
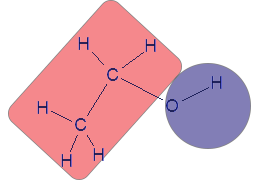
الجزء الأزرق، OH، هو المنطقة التي تتواجد فيها ذرّة هيدروجين مكشوفة من الإلكترونات، وهي مرتبطة بذرّة أكسجين ذات سالبيّة كهربائيّة كبيرة. ذرّة الهيدروجين هذه يمكن أن تُكوّن روابط هيدروجينيّة. من المُتّبع تسمية المنطقة الزرقاء منطقة هيدروفيليّة (تحبّ الماء)، لأنّها قادرة على تكوين روابط هيدروجينيّة مع الماء، وبالتالي تذوب في الماء. ليست كلّ مادّة توجد في جُزَيئاتها منطقة هيدروفيليّة تذوب في الماء. سنشرح عن ذلك بتوسّع لاحقًا.
المنطقة الحمراء هي الجزء الهيدروكربونيّ، CH3—CH2. هذه منطقة في الجُزَيء ليس فيها ذرّات هيدروجين مكشوفة من الإلكترونات أو ذرّات أكسجين، نيتروجين أو فلور. لذلك، لا يمكنها تكوين روابط هيدروجينيّة، لكنّها تكوّن تأثيرات متبادلة ڤان در ڤالس، بسبب حركة سحابة الإلكترونات فيها. من المتّبع تسمية هذه المنطقة هيدروفوبيّة (تخاف من الماء/كارهة للماء).
بالتالي، أمامنا مادّة يمكنها أن تكوّن تأثيرات متبادلة ڤان در ڤالس وأيضًا روابط هيدروجينيّة بين جُزَيئاتها. وهذا يمنح المادّة قدرة ذائبيّة كبيرة.
أوّلًا، نصف التجربة التي سننفّذها.
تجربة رقم 3
نأخذ وعاءَين. نضع في الوعاء الأول ماء (H2O) وفي الوعاء الثاني سيكلوهكسان (C6H12). نضيف للوعاءَين إيثانول (C2H5OH).
والنتيجة أمامكم هنا:

اشرحوا لماذا يذوب الإيثانول (C2H5OH(ℓ)) جيدًا في الماء (H2O(ℓ)) وأيضًا في السيكلوهكسان (C6H12(ℓ)). صيغوا عمليّات الإذابة في الحالتين.
نتطرّق لكلّ عمليّة على حدة.
- في البداية، نفحص ذائبيّة الإيثانول في الماء.
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة.
الإيثانول هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وأيضًا تأثيرات متبادلة ڤان در ڤالس.
لذلك عندما نخلط الماء والإيثانول تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وبين جُزَيئات الإيثانول وتذوب المادّتان ببعضهما البعض.
المادّة المُذابة هي C2H5OH(ℓ) والمادّة المُذيبة هي الماء، لذلك في صياغة العمليّة، يظهر الماء فوق السهم.
الناتج هو جُزَيئات إيثانول مرتبطة بجُزَيئات ماء بروابط هيدروجينيّة، ومُحاطة بجُزيئات ماء.
الإشارة aq تعني مُميّأ، أيّ مُذاب في الماء. المادّة المُذابة مُحاطة بجُزَيئات ماء ويوجد بينهما تجاذُب كهربائيّ، في هذه الحالة، روابط هيدروجينيّة.
نكتب الناتج على النحو التالي: C2H5OH(aq)
صيغة العمليّة تبدو كالتالي:
- الآن، سنشرح ذائبيّة الإيثانول في السيكلوهكسان.
السيكلوهكسان هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
الإيثانول هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وأيضًا تأثيرات متبادلة ڤان در ڤالس.
عندما نخلط السيكلوهكسان والإيثانول تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان وبين جُزَيئات الإيثانول وتذوب المادّتان ببعضهما البعض.
المادّة المُذابة هي الإيثانول C2H5OH(ℓ)
والمادّة المُذيبة هي السيكلوهكسان C6H12(ℓ)، الظاهرة فوق السهم.
الناتج هو إيثانول مُحاط بجُزَيئات سيكلوهكسان، وبينهما تأثيرات متبادلة ڤان در ڤالس. نكتب الناتج على النحو التالي:
C2H5OH(C6H12)
صيغة عمليّة إذابة الإيثانول في السيكلوهكسان تُكتَب كالتالي:
يمكن شرح العمليّة على النحو التالي: الإيثانول هو مادّة جُزَيئيّة فيها منطقة هيدروفيليّة (OH—) وسلسلة هيدروكربونيّة هيدروفوبيّة (C2H5—). المنطقة الهيدروفيليّة يمكن أن تكوّن روابط هيدروجينيّة مع جُزَيئات أخرى. بين جُزَيئات الماء أيضًا توجد روابط هيدروجينيّة، لذلك يمكن أن تتكوّن روابط هيدروجينيّة بين جُزيئات الماء وبين المنطقة الهيدروفيليّة في جُزَيئات الإيثانول.
بين جُزَيئات السيكلوهكسان توجد تأثيرات متبادلة ڤان در ڤالس لذلك يمكن أن تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان وبين المنطقة الهيدروفوبيّة في جُزَيئات الإيثانول.
لهذا السبب، يذوب الإيثانول في الماء وأيضًا في السيكلوهكسان.
نشير إلى أنّه كلّما كانت جُزَيئات المادّة الكحوليّة تحتوي على جزء هيدروفوبيّ، أيّ سلسلة هيدروكربونيّة أكبر، فإنّ قدرة ذائبيّتها في الماء تقلّ. قدرة جُزَيئات المادّة الكحوليّة على تكوين روابط هيدروجينيّة مع جُزَيئات الماء تقلّ. تفسير ذلك هو وجود التأثيرات المتبادلة ڤان در ڤالس التي تصبح أقوى كلّما كبرَ الجزء الهيدروفوبيّ (الهيدروكربونيّ). وذلك لأنّ سحابة الإلكترونات للجزء الهيدروفوبيّ ستكون أكبر، وبالتالي التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها تصبح أقوى.
علينا أن نتذكّر أنّ المواد الكحوليّة التي تحتوي على 5 ذرّات كربون لها قدرة ذائبيّة ضئيلة وتكاد لا تُذكَر في الماء، ويمكن القول إنّها لا تذوب في الماء بتاتًا.
فيما يلي مثال.
للمادّة الكحوليّة بنتانول C5H11OH ذائبيّة منخفضة (ضئيلة جدًا) في الماء. اشرحوا السبب.
الالمادّة الكحوليّة بنتانول هي مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. للمادّة الكحوليّة سلسلة هيدروكربونيّة كبيرة نسبيًّا، أيّ، سحابة إلكترونات كبيرة. نذكّر أنّ قوّة التأثيرات المتبادلة ڤان در ڤالس متعلّقة بكِبَر سحابة الإلكترونات. كلّما كانت سحابة الإلكترونات أكبر، تكون التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى. التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات البنتانول قويّة نسبيًّا، ولديه جزء هيدروفيليّ صغير نسبيًّا. بين جُزَيئات الماء توجد روابط هيدروجينيّة قويّة. بسبب الروابط الهيدروجينيّة القويّة بين جُزَيئات الماء والتأثيرات المتبادلة ڤان در ڤالس القويّة بين الأجزاء الهيدروفوبيّة في جُزَيئات البنتانول، فإنّ جُزَيئات البنتانول غير قادرة على الاندماج بين الروابط الهيدروجينيّة الموجودة بين جُزَيئات الماء. بكلمات أخرى، لا تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات البنتانول. لهذا السبب، البنتانول لا يذوب في الماء. عند خلط المادّتَين، فإنّهما تكوِّنان طبقتين، مثل الماء والزيت، أو الماء والسيكلوهكسان.
رأينا لغاية الآن أنّه لكي تذوب مادّتان جُزَيئيّتان ببعضهما البعض، يجب أن تكوِّنا بينهما روابط بين الجُزَيئات أو تأثيرات متبادلة بين الجُزَيئات. لكي تتمكّن المادّتان من تكوين هذه الروابط أو التأثيرات المتبادلة، يجب أن يكون فيهما بشكل عام نفس نوع الروابط أو التأثيرات المتبادلة بين الجُزَيئات. مع ذلك، انتبِهوا إلى أنّ البنتانول لم يذُب في الماء.
عندما نخلط مادّتين جُزَيئيّتين، يجب أن نفحص كلّ إمكانيّات التأثيرات المتبادلة بين الجُزَيئات: هل توجد فقط روابط هيدروجينيّة (بالأساس روابط هيدروجينيّة كما في جُزَيئات الماء H2O أو الأمونيا NH3)؟ هل توجد فقط تأثيرات متبادلة ڤان در ڤالس؟ أم أنّ هناك روابط هيدروجينيّة وأيضًا تأثيرات متبادلة ڤان در ڤالس؟
التجربة التالية هي ذائبيّة الأستون في الماء وفي السيكلوهكسان.
سنحاول أن نفهم ما المُميّز في هذه الحالة، وكيف نفسّر ذلك.
تجربة رقم 4
نضع في الدورق الأوّل ماء (H2O) وفي الدورق الثاني سيكلوهكسان C6H12(ℓ). بعد ذلك، نضع الأستون (CH3COCH3) في الدورقَين. النتيجة أمامكم هنا:

في كِلا الدورقَين، حصلنا على محلول صافٍ ومتجانس. لاحِظوا أنّ المحلول غير متعكّر، ولا يمكن أن نلاحظ فيه وجود طبقتَين منفصلتَين. يمكن أن نحدّد أنّ الأستون يذوب في الماء وفي السيكلوهكسان.
- من السهل أن نفسّر سبب ذوبان الأستون في السيكلوهكسان. المادّتان هما مادّتان جُزَيئيّتان. بين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس، لذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات الأستون وجُزَيئات السيكلوهكسان أيضًا.
صيغة عمليّة الإذابة تُكتَب كالتالي:
- كيف نفسّر حقيقة ذوبان الأستون في الماء، وما الإشكاليّة في هذه الحالة؟
أوّلًا، نُمعن النظر في مبنى جُزَيء الأستون، لكي نفهم ما هي القوى التي تعمل بين جُزَيئات الأستون.
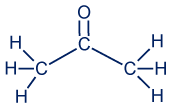
في جُزَيء الأستون، لا توجد ذرّات هيدروجين مكشوفة من الإلكترونات، ولا توجد ذرّات هدروجين مرتبطة بذرّات ذات سالبيّة كهربائيّة كبيرة جدًا. لذلك، جُزَيئات الأستون لا تكوّن روابط هيدروجينيّة مع بعضها البعض بل فقط تأثيرات متبادلة ڤان در ڤالس. لكن، رأينا أنّه عند خلط الأستون والماء حصلنا على محلول صافٍ أيّ أنّ المادّتَين تذوبان ببعضهما البعض. وذلك بالرغم من وجود تأثيرات متبادلة ڤان در ڤالس فقط بين جُزَيئات الأستون، ووجود روابط هيدروجينيّة بالأساس بين جُزَيئات الماء.
هناك حالات لا تكون فيها المادّة قادرة على تكوين روابط هيدروجينيّة بين جُزَيئاتها (مثل الأستون)، لكنها تحتوي على ذرّة ذات سالبيّة كهربائيّة كبيرة جدًا (أكسجين أو فلور أو نيتروجين) ولها زوج أو أزواج إلكترونات غير رابطة. هذه الإلكترونات يمكن أن تُشكّل مركز تجاذُب للهيدروجين المكشوف من الإلكترونات في جُزَيء آخر، مثلًا في جُزَيء الماء. لا تحدُث هذه الظاهرة دائمًا، ولا يمكننا أن نعرف متى تحدُث ومتى لا. برغم ذلك، يمكننا أن نحلّل تجربة من خلال وصفها المعطى لنا، كما في حالة الأستون والماء، أو أن نحصل على نتيجة التجربة ونحاول فهم سبب حدوث العمليّة.
رأينا لغاية الآن أنّ الموادّ الجُزَيئيّة تذوب ببعضها البعض عندما تكون قوة التجاذُب (الروابط/التأثيرات المتبادلة) بين جُزَيئاتها متشابهة، بحيث يحدُث تجاذُب بين جُزَيئات المادّة الأولى وجُزَيئات المادّة الثانية، لكنّ حالة الأستون استثنائيّة. هناك حالات استثنائيّة أخرى طبعًا. سنرى لاحقًا مثالًا إضافيًّا.
نعود للأستون ونشرح العمليّة.
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة
الأستون هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
بما أنّه في جُزَيئات الأستون توجد ذرّة أكسجين يمكن أن تكون مركزًا لتكوين رابط هيدروجينيّة مع ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء الماء، يتكوّن تجاذُب بين ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء الماء وبين زوج إلكترونات غير رابط في ذرّة الأكسجين في جُزَيء الأستون. في هذه الحالة، تتكوّن روابط هيدروجينيّة بين جُزَيئات الأستون وجُزَيئات الماء.
ارسموا رابطًا هيدروجينيًّا بين جُزَيء الأستون وجُزَيء الماء.
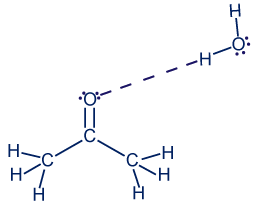
اكتبوا صيغة عمليّة إذابة الأستون في الماء.
تعالوا نرى مثالًا آخر.
اشرحوا لماذا يذوب ثنائي مثيل الأثير CH3OCH3 في الماء. صيغوا عمليّة الإذابة وارسموا رابطًا هيدروجينيًّا بين جُزَيء الماء وجُزَيء ثنائي ميثيل الإيثر.
انتبهوا إلى أنّه معطى في السؤال أنّ ثنائي مثيل الأثير يذوب في الماء. علينا أن نشرح السبب.
الشرح: الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة.
ثنائي مثيل الأثير هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
لسنا بحاجة أن نشرح هاتَين المعلومتَين.
الأكسجين في جُزَيء ثنائي مثيل الأثير هو مركز للتجاذُب وتكوين رابط هيدروجينيّ مع ذرّات الهيدروجين المكشوفة من الإلكترونات في جُزَيء الماء. لذلك، تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات ثنائي مثيل الأثير.
صيغة العمليّة
المادّة المُذابة هي CH3OCH3(ℓ)؛
المادّة المُذيبة هي الماء H2O(ℓ) وتظهر فوق السهم؛
الناتج هو CH3OCH3(aq);
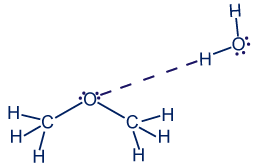
فيما يلي مثال آخر، وسنرى هذه المرّة أنّه ليس في كلّ مرّة يكون فيها مركز لتكوين روابط هيدروجينيّة، تكون هناك ذائبيّة في الماء.
المادّة CF4 لا تذوب في الماء. اشرحوا السبب.
المادّة CF4 هي مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
لماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة.
لذلك لا تتكوّن تأثيرات متبادلة بين جُزَيئات CF4 وجُزَيئات الماء.
انتبِهوا إلى أنّه بالرغم أنّه للمادّة CF4 توجد مراكز لتكوين روابط هيدروجينيّة في ذرّة الفلور (F)، لا تتكوّن روابط هيدروجينيّة بين جُزَيئات الماء وجُزَيئات CF4. لذلك، CF4 لا يذوب في الماء.
بكلمات أخرى، لا يحدُث الذوبان في الماء في كلّ حالة فيها مراكز لتكوير روابط هيدروجينيّة. في مستوى تعليم الكيمياء في المرحلة الثانويّة، لا تتوفّر لنا الأدوات لتحديد ما إذا كان سيحدُث ذوبان أم لا في كلّ حالة.
ننتقل إلى صفة أخرى يجب علينا أن نعرفها، وهي التوصيل الكهربائيّ أو توصيل التيّار الكهربائيّ.
لكي يكون هناك توصيل كهربائيّ، نحتاج إلى مصدر طاقة مثل البطاريّة الكهربائيّة أو قابس كهربائيّ، وكذلك إلى مادّة موصلة للتيّار، التي تتيح المجال للتوصيل الكهربائيّ. الجهاز الذي يمكن بواسطته أن نفحص في المختبر ما إذا كان هناك توصيل للتيّار، يُسمّى “مقياس التيار” أو “أمبيرمتر”. الأمبيرمتر يقيس الأمبير، وهي وحدة قياس للتيّار الكهربائيّ. لكن هناك طريقة أبسط لفحص التوصيل الكهربائيّ، والتي تمكّننا من رؤية النتيجة بشكل بصري… الأمر بسيط. نوصل مصباحًا ببطاريّة تحتوي على قُطبَين كهربائيَّين.

عندما يلامس القطبان مادّة موصلة للتيّار الكهربائيّ، تُغلق الدائرة الكهربائيّة ويضيء المصباح. نوضّح ذلك أدناه.

لكي تكون للمادّة صفة التوصيل الكهربائيّ، يجب أن تكون فيها شحنات كهربائيّة مُتنقِّلة. سنرى فيما بعد أنّه إذا كان المحلول يحتوي على أيونات حرّة الحركة، يكون موصلًا للتيّار الكهربائيّ.
لمن لا يذكُر، الأيون هو ذرّة أو مجموعة ذرّات لا يتساوى فيها عدد الإلكترونات مع عدد البروتونات، لذلك تكون جُسَيْمًا مشحونًا بشحنة كهربائيّة.
في كلّ محاليل الموادّ الجُزَيئيّة التي ذكرناها لغاية الآن، لم تتكوّن جُسَيْمات مشحونة بشحنة كهربائيّة، أيّ أنّها ليست أيونات حرّة الحركة وليست إلكترونات غير مُتَمَرْكِزة مُتنقِّلة (سنتعلّم عنها لاحقًا). لذلك، محاليل هذه الموادّ غير موصلة للتيّار الكهربائيّ. يمكن القول أيضًا إنّ هذه المحاليل غير موصلة للكهرباء.
في الصورة الأخيرة، رأينا أنّ المصباح المغمور في المحلول يضيء. تفسير ذلك هو: لأنّ المحلول يحتوي على جُسَيْمات مشحونة تسمّى أيونات، وهي مُتنقِّلة. محاليل الموادّ الجُزَيئيّة التي تعلّمنا عنها حتى هذا الدرس، تحتوي على جُزَيئات مادّة مُذابة تكوّن روابط/تأثيرات متبادلة هيدروجينيّة أو ڤان در ڤالس، أو هيدروجينيّة وأيضًا ڤان در ڤالس، مع جُزَيئات المادّة المُذيبة، لكنّها لا تكوِّن خلال عمليّة الإذابة شحنات كهربائيّة مُتنقِّلة في المحلول. لذلك، هذه المحاليل غير موصلة للكهرباء.
الفلزّ أيضًا يسمح بإغلاق الدائرة وتوصيل التيّار الكهربائيّ كما نرى في الصورة في الأعلى.
نمعن النظر في صور التجارب التالية:
 |  |
 | فيما يلي ثلاث صور تبيّن المحاليل التي حصلنا عليها في ثلاث تجارب مختلفة. تجربة 1 تكوين محلول سكّر الجلوكوز (C6H12O6) في الماء (H2O)؛ تجربة 2 تكوين محلول اليود (I2) في السيكلوهكسان (C6H12)؛ تجربة 3 تكوين محلول إيثانول (C2H5OH) في السيكلوهكسان (C6H12). سنشرح لاحقًا، لكلّ حالة على حِدة، لماذا ذابت الموادّ ببعضها البعض. نلاحظ في الحالات الثلاث أنّه لا يوجد توصيل للتيّار الكهربائيّ، لأنّ المصباح في الجهاز الذي يمكّننا من فحص ذلك، لا يضيء. هذا يعني أنّه في المحاليل الثلاثة لا توجد شحنات كهربائيّة مُتنقِّلة (لا توجد أيونات حرّة الحركة). لذلك لا يوجد توصيل كهربائيّ. ذكرنا سابقًا أنّه في محاليل الموادّ الجُزَيئيّة (باستثناء حالات سنتحدّث عنها لاحقًا للموادّ الجُزَيئيّة التي تنتمي لعائلة الموادّ: الحوامض والقواعد)، لن نحصل على أيونات حرّة الحركة في المحلول، لذلك لن يكون المحلول موصلًا للكهرباء. |
نعود ونشرح لكلّ حالة، لماذا حصل ذوبان بين الموادّ في المحاليل.
تجربة 1
لكي نفهم لماذا ذاب السكّر (الجلوكوز) في الماء، نمعن النظر في صيغته الجُزَيئيّة: C6H12O6. الصيغة البنائيّة للجلوكوز هي:
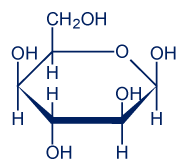
الجلوكوز والماء أيضًا هما مادّتان جُزَيئيّتان.
نلاحظ أنّه في جُزَيء الجلوكوز هناك مراكز كثيرة لتكوين روابط هيدروجينيّة. بين جُزَيئات الماء أيضًا توجد روابط هيدروجينيّة، لذلك تتكوّن روابط هيدروجينيّة بين جُزَيئات الجلوكوز وجُزَيئات الماء.
تجربة 2
اليود والسيكلوهكسان هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس. لذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات السيكلوهكسان وجُزَيئات اليود.
تجربة 3
الإيثانول هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. تذكّروا أنّ للإيثانول توجد منطقة هيدروفوبيّة ومنطقة هيدروفيليّة.
السيكلوهكسان هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس.
لذلك بين جُزَيئات الإيثانول وجُزَيئات السيكلوهكسان تتكوّن تأثيرات متبادلة ڤان در ڤالس.
- فيما بعد، سنتعرّف على بعض الموادّ الجُزَيئيّة التي تنتمي لعائلة الحوامض والقواعد، وسنفهم سبب توصيل محاليلها للتيّار الكهربائيّ.
- في هذه المرحلة، لا حاجة لمعرفة هذه الموادّ. لا نحتاج أيضًا لشرح سبب توصيلها للتيّار الكهربائيّ.
هناك صفة أخرى مهمّة في تعلّم الكيمياء، وهي التوصيل الكهربائيّ للموادّ في الحالة الصلبة والمنصهرة (السائلة).
ذكرنا سابقًا أنّه لكي يكون هناك توصيل كهربائيّ، نحن بحاجة إلى مصدر طاقة كهربائيّة (بطاريّة مثلًا) وإلى جُسَيْمات مشحونة ومُتنقِّلة.
في الموادّ الجُزَيئيّة المكوّنة من جُزَيئات، لا توجد جُسَيْمات مشحونة مُتنقِّلة في الحالة الصلبة، ولا في الحالة المنصهرة أيضًا. لذلك، الموادّ الجُزَيئيّة غير موصلة للكهرباء في هاتين الحالتين.
بما أنّ هناك إشكالية بين المصطلحين “سائل” و”محلول”، نشير إلى أنّ المحلول ليس سائلًا نقيًّا، بل خليط متجانس من الموادّ. فيما بعد، سنذكر مادّة منصهرة (سائلة) نقيّة، أيّ مادّة صلبة نبذل فيها طاقة ومرّت بعمليّة انصهار وتحوّلت إلى سائل.
سنتذكر مصطلحًا تعلّمناه في فصل مصطلحات أساسيّة/حالات المادّة، والذي سيرافقنا فيما بعد أيضًا: عمليّة الانصهار.
عمليّة الانصهار هي عمليّة الانتقال من الحالة الصلبة إلى الحالة السائلة.
بالنسبة لكلّ الموادّ الجُزَيئيّة، تتمّ صياغة العمليّة على النحو التالي:
A(s) → A(ℓ)
A يمثل مادّة جُزَيئيّة معيّنة.
فيما يلي مثال.
صيغوا عمليّة انصهار الماء (H2O(s)).
H2O(s) → H2O(ℓ)
صيغوا عمليّة انصهار السيكلوهكسان (C6H12(s)).
C6H12(s) → C6H12(ℓ)
نلاحظ من طريقة صياغة عمليّة الانصهار، أنّه في في الحالة الصلبة وفي الحالة المنصهرة (السائلة) أيضًا، لا توجد في المادّة الجُزَيئيّة شحنات كهربائيّة مُتنقِّلة. الموادّ غير موصلة للتيّار الكهربائيّ في الحالة الصلبة وفي الحالة المنصهرة (السائلة).


