التأثيرات المتبادلة ڤان در ڤالس
التأثيرات المتبادلة ڤان در ڤالس هي قوى التجاذُب بين الجُزَيئات، الناتجة عن مبنى الجُزَيء والتقاطُبات اللحظيّة أو الدائمة التي تتكوّن نتيجة حركة الإلكترونات في الجُزَيء.
تعلّمنا أنّه في الجُزَيء هناك إلكترونات رابطة وغير رابطة، وهناك أيضًا إلكترونات لا تظهر في التمثيل الإلكترونيّ وهي موجودة في مستويات الطاقة الداخليّة.
كلّ الإلكترونات الموجودة في الجُزَيء تكوّن سحابة إلكترونات حول أنوية الذرّات في الجُزَيء. سنستخدم هذا المصطلح في هذا الدرس ولاحقًا أيضًا.
سحابة الإلكترونات هي اسم لكلّ الإلكترونات الموجودة في الجُزَيء.
نبدأ بمثال. نأخذ على سبيل المثال عمود الهالوجينات في قائمة العناصر الدوريّة، والذي يشمل الفلور (F، الكلور (Cℓ)، البروم (Br) واليود (I).
هذه العناصر الأربعة تظهر في الطبيعة كجُزَيئات ثنائيّة الذرّة F2, Cℓ2, Br2, I2. الفلور والكلور غازيّان بدرجة حرارة الغرفة، البروم سائل واليود صلب. كيف نشرح الفرق في حالة المادّة بين هذه الموادّ الأربع؟
أوّلًا نشير إلى أنّ هذه الموادّ الأربع هي موادّ جُزَيئيّة. أيّ أنّها مكوّنة من جُزَيئات. الجُزَيئات مكوّنة من لافلزّات توجد بينها روابط تساهميّة (كوفالنتيّة).
ثانيًا، نتطرّق إلى حالات المادّة. الحقيقة بأنّ إحدى الموادّ صلبة، الثانية سائلة والمادّتان الأخريان غازيّتان بدرجة حرارة الغرفة، تشير إلى أنّ المادّة التي حالتها صلبة تتميّز بمبنى تكون فيه الجُزَيئات أكثر كثافةً، بالمقارنة مع المادّة السائلة والمادّتان الغازيّتان. في الحالة الغازيّة، جُزَيئات المادّة بعيدة عن بعضها البعض، وكثافة المادّة أقلّ بالمقارنة مع الحالة الصلبة والسائلة.
يمكن أن نستنتج بشكل عام أنّ المادّة التي جُزَيئاتها قريبة من بعضها البعض أكثر، هي مادّة تعمل بين جُسَيماتها أو جُزَيئاتها قوى تجاذُب أقوى. يمكن القول أيضًا إنّه بين جُزَيئات المادّة توجد تأثيرات متبادلة أقوى.
سنحاول أن نعرف سبب الفرق بين الموادّ الأربع التي ذكرناها.
تعلّمنا في درس السالبيّة الكهربائيّة وقُطبيّة الرابط أنّه كلّما كان عدد الإلكترونات أكبر، هناك إمكانيّات أكثر لتوزيعها في مداراتها. لذلك تتكوّن تقاطُبات لحظيّة أكثر.
نعود إلى المثال المذكور في ذلك الدرس.
في الرسم التوضيحيّ التالي، نأخذ أداة مقسّمة إلى أربع خانات، ونفحص عدد الحالات المختلفة لمكان الكرة الفرديّة:
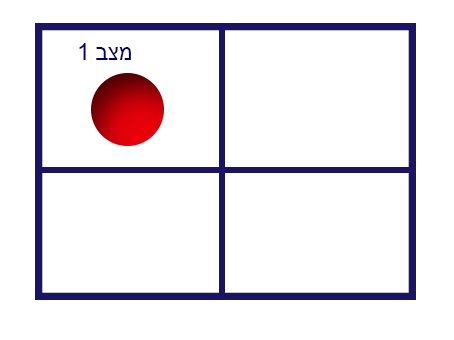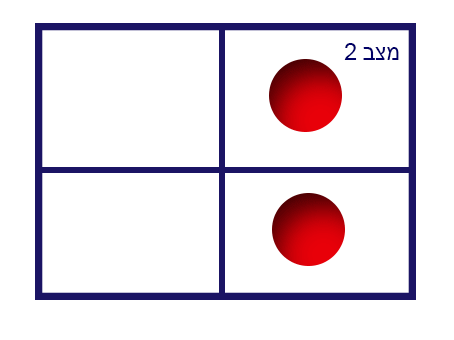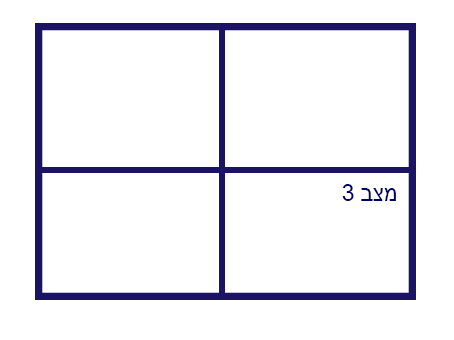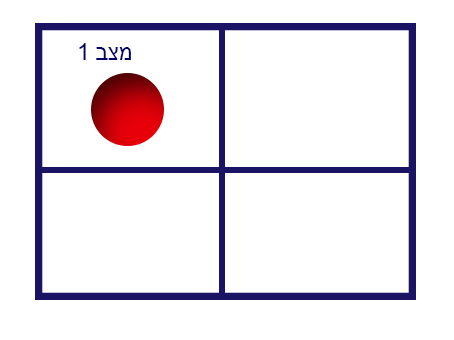
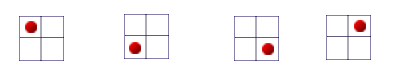
كما نلاحظ في الرسم، يمكن وضع الكرة في 4 أماكن مختلفة، ممّا يكوّن 4 حالات مختلفة.
الآن، نحاول وضع كرتَين في نفس الأداة، ونرى ما هي الحالات المختلفة التي يمكن تكوينها:
هذه المرّة، نلاحظ أنّ هناك 10 حالات مُختلفة ممكنة.
يمكن القول أنّه كلّما كبرَ عدد الكرات، يكبر أيضًا عدد الإمكانيّات التي يمكن ترتيبها فيها داخل الخانات الأربع. كذلك الأمر عندما تكبر سحابة الإلكترونات (مجمل عدد الإلكترونات الموجودة في الجُزَيء).
كلّما كان عدد الإلكترونات في سحابة الإلكترونات أكبر، يكون عدد الحالات الميكروسكوبيّة لسحابة الإلكترونات أكبر. هذا يعني أنّه ستكون هناك إمكانيّات أكثر للتقاطُبات اللحظيّة في الجُزَيء، وهذه التقاطُبات ستتأثّر من جُزَيئات أخرى.
التقاطُب اللحظيّ هو حالة تكون فيها الكثافة الإلكترونيّة أكبر في منطقة واحدة في الجُزَيء (أو في الذرّة). هذه المنطقة تكون مشحونة في تلك اللحظة بشحنة نسبيّة سالبة، بينما المنطقة الأخرى بالنسبة لها تكون موجبة أكثر.
اضغطوا لمشاهدة الفيديو التوضيحيّ التالي عن موضوع التقاطُب اللحظيّ.
في نهاية الفيديو التوضيحيّ، نرى المنطقة السالبة التي تتركّز فيها الإلكترونات (-)، وهي مشار إليها بـ -δ. المنطقة الموجبة، نسبيًا، مشار إليها بـ +δ.
نعود الآن إلى الموادّ الأربع: الفلور، الكلور، البروم واليود. سحابة الإلكترونات في ذرّة اليود هي الأكبر، لذلك تتكوّن في جُزَيء اليود تقاطُبات لحظيّة أكثر. هذه التقاطُبات تكوّن حالات تجاذُب كهربائيّ أكثر وقوّة تجاذُب بين جُزَيئات اليود. يمكن قول ذلك على النحو التالي أيضًا:
بما أنّ سحابة الإلكترونات في جُزَيئات اليود أكبر، تتكوّن فيها تقاطُبات لحظيّة أكثر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات اليود أقوى. بالتالي، التجاذُب بين جُزَيئات اليود هو الأقوى. بدرجة حرارة الغرفة، لا توجد طاقة كافية لتفكيك هذه التأثيرات المتبادلة. لذلك، بدرجة حرارة الغرفة يكون اليود صلبًا.
العوامل التي تؤثر على قوّة التأثيرات المتبادلة ڤان در ڤالس
كما ذكرنا، كلّما كان عدد الإلكترونات أكبر، تكون سحابة الإلكترونات أكبر. كلّما كانت سحابة الإلكترونات أكبر، تكون التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى، والعكس صحيح.
التأثيرات المتبادلة ڤان در ڤالس ناتجة عن التقاطُبات في الجُزَيء، التي تؤدّي إلى التجاذُب والتنافُر بين الجُزَيئات. يمكن أن تكون التقاطُبات لحظيّة ويمكن أن تكون دائمة. التقاطُب الدائم ناتج عن كون الجُزَيء قطبيًّا كما شرحنا في درس قُطبيّة الجُزَيء.
إذا كان هناك تقاطُب دائم في جُزَيء معيّن، تصبح التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة أقوى.
قبل أن ننتقل إلى أمثلة توضّح كيف تؤثر العوامل المختلفة على قوّة التأثيرات المتبادلة ڤان در ڤالس، نشير إلى أنّ هناك علاقة مباشرة بين قوّة التأثيرات المتبادلة ڤان در ڤالس وبين كمّيّة الطاقة اللازمة لتفكيك الرابط ودرجة الغليان. هناك علاقة بين قوّة التأثيرات المتبادلة ڤان در ڤالس وحالة المادّة، كما شرحنا في بداية الدرس.
لننظر إلى المثال التالي:
معطى المادّتان بروم (Br2) كلوريد اليود (ICℓ).
معلوم أنّ درجة غليان كلوريد اليود أعلى من درجة غليان البروم.
كيف يمكن تفسير هذه الحقيقة؟
درجة غليان المادّة هي درجة الحرارة التي تتفكّك فيها الروابط بين جُسَيمات المادّة، وفي هذه الحالة جُزَيئات المادّتَين بروم أو كلوريد اليود. كلّما احتجنا إلى درجة حرارة أعلى لتحويل المادّة من سائل إلى غاز، يمكن القول إنّ قوى التجاذُب التي تعمل بين جُزَيئات المادّة أقوى.
المادّتان في المثال هما مادّتان جُزَيئيّتان. توجد في كليهما تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات (لم نتعلّم بعد عن النوع الثاني من التأثيرات المتبادلة). نفحص أوّلًا كِبَر سحابة الإلكترونات في المادّتَين.
لللقيام بذلك، نستعين بقائمة العناصر الدوريّة وبالعدد الذرّيّ الذي يُعبّر عن عدد البروتونات في النواة، وكذلك عن عدد الإلكترونات الموجودة في الذرّة في الحالة المتعادلة كهربائيًّا.
العدد الذرّيّ لذرّة البروم هو 35، لذلك يوجد لديها 35 إلكترونًا. في جُزَيء البروم (Br2) سيكون 70 إلكترونًا (2×35=70).
لذرّة اليود عدد ذرّيّ 53 بينما لذرّة الكلور عدد ذرّيّ 17. معًا لديهما 70 إلكترونًا.
للمادّتَين سحابة إلكترونات متطابقة، لكن مع ذلك، درجة غليان كلوريد اليود أعلى. هذا يعني أنّ قوى التجاذُب بين جُزَيئاته أقوى من قوى التجاذُب بين جُزَيئات البروم. توجد في المادّتَين تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات، لكن بما أنّ سحابة الإلكترونات متطابقة في كلتيهما، هناك عامل آخر يزيد من قوّة التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات كلوريد اليود.
السبب في ذلك هو أنّ البروم هو جُزَيء غير قطبيّ، بينما كلوريد اليود هو جُزَيء قطبيّ. لنتذكّر كيف نحدّد ذلك:
للجُللجُزَيئَين مبنى خطّيّ. هذا هو النموذج السادس من بين نماذج المباني التي تعلّمناها في درس قُطبيّة الجُزَيء. بما أنّ جُزَيء البروم مكوّن من ذرّتَيْن متطابقتَين، لا يحدُث فيه عدم تماثُل دائم في سحابة الإلكترونات، لذلك فهو غير قطبيّ. جُزَيء كلوريد اليود له مبنى خطّيّ أيضًا، لكنّه مكوّن من ذرّتَيْن مختلفتَين. لذلك، سيتكوّن عدم تماثُل في سحابة الإلكترونات فيه، لذلك فهو قطبيّ.
يوجد ثنائيّ تقاطُب دائم في جُزَيء كلوريد اليود، ممّا يزيد من قوّة التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات، لذلك التجاذُب بين الجُزَيئات أقوى ودرجة غليان المادّة أعلى.
للإجابة عن السؤال أعلاه بشكل دقيق، يمكننا أن نقول ما يلي:
المادّتان، البروم وكلوريد اليود، هما مادّتان جُزَيئيّتان. في كِلا المادّتَين تعمل تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات (لا حاجة لكتابة ذلك، لكن يجب أن نفحص: للمادّتَين سحابة إلكترونات متطابقة). بما أنّ جُزَيئات كلوريد اليود قطبيّة (لها ثنائيّ تقاطُب دائم) وجُزَيئات البروم ليست قطبيّة (ليس لها ثنائيّ تقاطُب دائم)، فإنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات كلوريد اليود أقوى، لذلك درجة غليان كلوريد اليود أعلى.
لنلخّص ما تعلّمناه لغاية الآن:
- كلّما كانت سحابة الإلكترونات أكبر، تكون التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى.
- إذا كانت الجُزَيئات التي تكوّن المادّة قُطبيّة، تكون التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات أقوى.
تجدر الإشارة إلى أنّه لا يمكننا تحديد العامل الذي له تأثير أكبر بالتأكيد، لكن يمكن القول بشكل عام إنّه عندما لا تكون الفروقات في كِبَر سُحُب الإلكترونات كبيرة، فإنّ قُطبيّة الجُزَيء تؤثّر أكثر. كلّما كان الفرق في كِبَر سُحُب الإلكترونات بين الجُزَيئات أكبر، يكون تأثير سحابة الإلكترونات على التأثيرات المتبادلة ڤان در ڤالس أكبر من تأثير قُطبيّة الجُزَيء.
في جميع الأحوال، يجب فحص كلّ حالة على حِدة، وفحص جميع العوامل.
العامل الأخير الذي يؤثّر على قوّة التأثيرات المتبادلة ڤان در ڤالس، هو:
مساحة السطح/مساحة سطح التلامُس بين الجُزَيئات
كلّما كانت مساحة السطح/التلامُس بين الجُزَيئات أكبر، تكون التأثيرات المتبادلة ڤان در ڤالس أقوى.
لنتخيّل أنّنا نحاول إلصاق قطعتَيّ خشب ببضعهما البعض:

في أيّ حالة سيكون من الصعب الفصل بين قطعتَيّ الخشب الملتصقتَين؟
الإجابة هي: في الحالة “ب”، لأنّه في هذه الحالة، مساحة سطح التلامُس (الإلصاق) أكبر، لذلك سيكون من الصعب فصل القطعتَين عن بعضهما.
كذلك الأمر في الجُزَيئات أيضًا. يمكن تشبيه التجاذُب بين الجُزَيئات بصمغ يقرّبها من بعضها البعض. كلّما كانت مساحة سطح التلامُس بين الجُزَيئات أكبر، ستتكوّن تقاطُبات لحظيّة أكثر في الجُزَيء الأوّل، والتي ستنجذب إلى تقاطُبات لحظيّة في الجُزَيء الآخر. نتيجةً لذلك، ستكون التجاذُب بين الجُزَيئات أقوى.
على سبيل المثال، جُزَيء الأوكتان C8H18. لهذه المادّة درجة غليان أعلى من رباعيّ كلوريد الكربون (CCℓ4).
ما تفسير ذلك؟
المادّتان هما مادّتان جُزَيئيّتان. توجد في المادّتَين تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات، لذلك نفحص أوّلًا حجم سحابة الإلكترونات فيهما.
للأوكتان يوجد 66 إلكترونًا (8×6 + 18×1) بينما لرباعيّ كلوريد الكربون 74 إلكترونًا (17×4 +6×1).
بحسب كِبَر سحابة الإلكترونات، قوى ڤان در ڤالس بين جُزَيئات رباعيّ كلوريد الكربون من المفترض أن تكون أقوى من قوى ڤان در ڤالس بين جُزَيئات الأوكتان. مع ذلك، درجة غليان الأوكتان أعلى. هذا يعني أنّ قوى التجاذُب بين جُزَيئات الأوكتان أقوى.
من حيث قُطبيّة الجُزَيء نشير إلى أنّ رباعيّ كلوريد الكربون هو جُزَيء له مبنى تتراهيدر (هرم رباعيّ)، لذلك فهو غير قُطبيّ. الأوكتان بالمقابل، مثل كلّ الهيدروكربونات، غير قطبيّ أو له تقاطُب ضئيل جدًا لا يُذكر.
العامل الذي يفسّر الفرق في درجة الغليان بين المادّتَين هو الفرق في قوّة التأثيرات المتبادلة ڤان در ڤالس الموجودة بين جُزَيئات المادّتَين. الفرق في قوّة التأثيرات المتبادلة ڤان در ڤالس في هذه الحالة ناتج عن الفرق في مساحة السطح سطح التلامُس بين الجُزَيئات.
فيما يلي رسم لجُزَيئات الأوكتان:

مساحة السطح الكبيرة تُتيح المجال لوجود مساحة سطح تلامُس أكبر بين الجُزَيئات.
جُزَيئات رباعيّ كلوريد الكربون ستبدو على النحو التالي:

مساحة السطح الصغيرة تتيح المجال لوجود مساحة سطح تلامُس أصغر بين الجُزَيئات.
مساحة سطح تلامُس جُزيئات الأوكتان أكبر، لذلك، مساحة سطح التلامُس بين الجُزَيئات أكبر. تتكوّن تأثيرات متبادلة ڤان در ڤالس أقوى بين الجُزَيئات، لذلك درجة غليان الأوكتان أعلى من درجة غليان رباعيّ كلوريد الكربون.
تجدر الإشارة إلى أنّ الهدف من عمليّة الفحص هو من التوصّل للإجابة النهائيّة، التي تتطرّق فقط إلى العامل الذي أدّى إلى الفرق في درجة الغليان.
نشير أيضا شيرأيضًا إلى أنّه لا يمكن أن نحدّد لكلّ حالة ما هو العامل الذي يؤثّر أكثر. هل تؤثّر سحابة الإلكترونات أكثر من قُطبيّة الجُزَيء؟ هل تؤثّر قطبيّة الجُزَيء أكثر من مساحة سطح التلامُس؟ وما إلى ذلك. بشكل عام، سنتطرّق إلى الحالات التي فيها الإجابة قطعيّة. لكن في الحالات التي لا تكون فيها الإجابة قطعيّة، نتطرّق في كلّ واحدة من الموادّ إلى العوامل التي تفسّر لماذا يجب أن تكون في المادّة القوى الأقوى بين الجُزَيئات، ونقول إنّه لا يمكن أن نُحدّد بالتأكيد ما هو العامل الأكثر تأثيرًا.
لكي نفهم ما المقصد، ننظر إلى المثال التالي:
معطى المادّتان: هكسان CH3CH2CH2CH2CH2CH3 وبروم Br2. لأيّ مادّة درجة غليان أعلى؟
بعد أن حدّدنا أنّ المادّتَين جُزَيئيّتان لأنّهما مكوّنتان من لافلزّات وتوجد بين جُزَيئاتهما تأثيرات متبادلة ڤان در ڤالس، نفحص كِبَر سحابة الإلكترونات في كلتيهما.
للهكسان يوجد 50 إلكترونًا (6×6 + 14×1) وللبروم 70 إلكترونًا (35×2).
بحبحسب كِبَرسحابة الإلكترونات، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات البروم أقوى، لذلك من المفترض أن تكون درجة غليان البروم أعلى.
قُطبيّة الجُزَيء: المادّتان غير قطبيّتَين.
العامل الثالث هو مساحة سطح التلامُس. للهكسان مساحة سطح تلامُس أكبر من جُزَيء البروم، لذلك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الهكسان من المفترض أن تكون أقوى. درجة غليان الهكسان من المفترض أن تكون أعلى.
ما الذي يؤثر أكثر؟
لا تتوفّر لدينا الأدوات لتحديد العامل الذي له تأثير أكبر، لذلك يمكننا قول ما يلي:
المادّتالمادّتان جُزَيئيّتان. هناك تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات في كلتا المادّتَين. لا يمكن أن نحدد بالتأكيد لأيّ مادّة درجة غليان أعلى. من جهة، للبروم سحابة إلكترونات أكبر؛ ومن جهة أخرى، للهكسان مساحة سطح تلامُس أكبر. كلّ واحد من هذه العوامل يزيد من قوّة التأثيرات المتبادلة ڤان در ڤالس بين الجُزَيئات، لذلك لا يمكن أن نحدد بالتأكيد لأيّ مادّة درجة غليان أعلى.
لكن، لو قلنا لكم إنّ درجة غليان الهكسان هي 68ºC بينما درجة غليان البروم هي 58°C، ستستنتجون أنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الهكسان أقوى، لأنّ درجة غليانه أعلى. لذلك، نحتاج إلى طاقة أكبر لتفكيك الروابط بين الجُزَيئات، لذلك درجة الغليان أعلى. الآن، يمكننا أن نشرح السبب في أنّ درجة غليان الهكسان أعلى.
بحسب الفحوصات التي أجريناها، لاحظنا أنّ مساحة سطح جُزَيء الهكسان أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الهكسان أقوى، ودرجة غليانه أعلى.
انتبهوا إلى أنّنا لم نتطرّق في إجاباتنا إلى عدد الإلكترونات، لأنّ الفرق في عدد الإلكترونات لا يفسّر الحقيقة بأنّ درجة غليان الهكسان أعلى، بل يناقض هذه الحقيقة.
