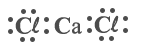اقتراح حلّ المتحان البچروت في الكيمياء 2020
- أيّة صيغة تمثيل إلكترونيّة تمثّل صحيحًا جسيمات المركَّب CaCℓ2(s)?
- طاقة التأيُّن الأولى لذرّة الأوكسجين، O ، هي أعلى من طاقة التأيُّن الأولى لذرّة الكبريت، S.
ما هو سبب ذلك؟- في ذرّة الأوكسجين يوجد عدد أقلّ من مستويات الطاقة المسكونة بالإلكترونات بالمقارنة مع ذرّة الكبريت.
- السالبيّة الكهربائيّة لذرّة الأوكسجين أعلى من السالبيّة الكهربائيّة لذرّة الكبريت.
- عدد البروتونات في ذرّة الأوكسجين أصغر من عدد البروتونات في ذرّة الكبريت.
- في الترتيب الدوريّ، يقع الأوكسجين فوق الكبريت.
הסבר
בגלל שלאטום החמצן פחות רמות אנרגייה מאוכלסות באלקטרונים המרחק בין הגרעין לאלקטרון שרוצים לנתק קטן יותר ולכן המשיכה החשמלית ביניהם חזקה יותר ויש להשקיע יותר אנרגייה כדי לנתק את האלקטרון. - معطاة الصِّيَغ الجزيئيّة لأربعة جزيئات: CF4 , CH2FCℓ , CCℓ4 , CH4.
لجميع الجزيئات مبنى فراغيّ رباعيّ السطوح.
أمامك أربعة أقوال، “أ-د”، تتعلّق بالأربطة التساهميّة )الكوڤلنتيّة( في الجزيء وبقطبيّة الجزيء.
ما هو القول الصحيح؟- في جزيء CF4 جميع الأربطة التساهميّة ليست قطبيّة والجزيء ليس قطبيًّا.
- في جزيء CH4 جميع الأربطة التساهميّة ليست قطبيّة والجزيء قطبيّ.
- في جزيء CCℓ4 جميع الأربطة التساهميّة قطبيّة والجزيء ليس قطبيًّا.
- في جزيء CH2FCℓ جميع الأربطة التساهميّة قطبيّة والجزيء ليس قطبيًّا.
הסבר
הקשר בין אטום הפחמן C לבין אטום הכלור ℓC הוא קשר קוטבי כי יש הפרש בערכי האלקטרושליליות בין אטומי הפחמן לאטומי הכלור. המולקולה לא קוטבית כי לא קיים בה עיוות קבוע בענן האלקטרונים (המולקולה בעלת מבנה סימטרי). - في الوعاء A يوجد 22 غرامًا من غاز ثاني أكسيد الكربون، CO2(g).
في الوعاء B يوجد 22 غرامًا من غاز الپروپان، C3H8(g).
درجة الحرارة في الوعاءين متساوية، لكنّ الضغط في الوعاء A أقلّ من الضغط في الوعاء B.
ما هو التحديد الصحيح؟- عدد مولات الغاز في الوعاء A أكبر من عدد مولات الغاز في الوعاء B.
- عدد مولات الغاز في الوعاء A أصغر من عدد مولات الغاز في الوعاء B.
- حجم الوعاء A أصغر من حجم الوعاء B.
- حجم الوعاء A أكبر من حجم الوعاء B.
הסבר
CO2(g) 22 m (גרם) 44 Mw (גרם / מול) 0.5 n (מול) C3H8(g) 22 m (גרם) 44 Mw (גרם / מול) 0.5 n (מול) ניתן לראות שמספר המולים בשני הכלים שווה.
היות שהטמפרטורה זהה בשני הכלים והלחץ בכלי A קטן מזה שבכלי B פירוש הדבר שמולקולות הגז בכלי A מתפשטות על פני נפח גדול יותר ולכן הנפח של כלי A גדול יותר ( יש יחס הפוך בין הנפח ללחץ). - إلى كأس كيميائيّة (دورق) تحوي 400 ملل من محلول بروميد البوتاسيوم،, KBr(aq)، بتركيز 0.2M، أضافوا 400 ملل من محلول بروميد المغنيسيوم، MgBr2(aq)، بتركيز 0.1M، وخلطوا المحلولين.
أمامك أربعة أقوال IV-I ، تتطرّق إلى المعطيات في الكأس بعد الخلط.- عدد مولات أيونات البروميد، Br‾(aq)، في الكأس هو 0.12 مول.
- عدد مولات أيونات البروميد، Br‾(aq)، في الكأس هو 0.16 مول.
- تركيز أيونات البروميد، Br‾(aq)، في الكأس هو 0.3M.
- ריכוז יוני ברומיד, Br‾(aq)، في الكأس هو 0.2M.
מהם שני ההיגדים הנכונים?
- القولان I وَ III.
- القولان I وَ IV.
- القولان II وَ IV.
- القولان II وَ III.
הסבר
Br–(aq) KBr(aq) 1 1 יחס מולים 0.2 0.2 (M) C 0.4 0.4 V (ליטר) 0.08 n (מול) Br–(aq) MgBr2(aq) 2 : 1 יחס מולים 0.2 0.1 (M) C 0.4 0.4 V (ליטר) 0.08 0.04 n (מול) כדי לחשב את הריכוז הכולל נסכום את המולים של יוני הברום משתי התמיסות (0.08 + 0.08) ונסכום את הנפח ונחלק.
- معطاة ثلاثة فلزّات، خارصين Zn(s)، قصدير Sn(s)، نحاس Cu(s)، مرتَّبة حسب قدرتها النسبيّة على
الاختزال:Zn(s) > Sn(s) > Cu(s)
في ثلاثة أوعية منفردة C ، B ، A ، معطاة ثلاثة محاليل تحوي، بالإضافة إلى موادّ أخرى، أيونات الفلزّات.
في كلّ واحد من الأوعية يوجد محلول مختلف، كما هو معروضفي الجدول.الوعاء A الوعاء B الوعاء C أيونات موجبة في المحلول أيونات خارصين
Zn2+(aq)
أيونات قصدير
Sn2+(aq)
أيونات نحاس
Cu2+(aq)
أَدخلوا أحد الفلزّات، الخارصين Zn(s)، أو القصدير Sn(s)، أو النحاس Cu(s) إلى أحد الأوعية A أو B أو C.
حدث تفاعل نتج فيه، من ضمن نواتج أخرى، الفلزّ قصدير Sn(s) .
ما هو الفلزّ وما هو المحلول اللذان تفاعَلا؟- فلزّ النحاس، Cu(s)، تفاعَلَ مع المحلول الذي في الوعاء B.
- فلزّ الخارصين، Zn(s)، تفاعَلَ مع المحلول الذي في الوعاء C.
- فلزّ النحاس، Cu(s)، تفاعَلَ مع المحلول الذي في الوعاء A.
- فلزّ الخارصين، Zn(s)، تفاعَلَ مع المحلول الذي في الوعاء B.
הסבר
המתכת אבץ Zn(s) היא מחזרת טובה יותר מהמתכת בדיל Sn(s) ולכן היא תגיב עם יוני הבדיל Sn2+(aq) ותמסור להם אלקטרונים.
- أمامك معادلة تفاعل مثيل أمين، CH3NH2(g)، مع الماء.
CH3NH2(g) + H2O(ℓ) → CH3NH3+(aq) + OH‾(aq)
ما هو التحديد الصحيح؟- في التفاعل المعطى، يتفاعل الماء، H2O(ℓ)، كقاعدة.
- في التفاعل المعطى، يتفاعل مثيل أمين، CH3NH2(g)، كقاعدة.
- في نهاية التفاعل يَنتُج محلول حامضيّ (pH<7).
- في التفاعل، يحدث انتقال إلكترونات من جزيئات مثيل أمين، CH3NH2، إلى جزيئات الماء.
הסבר
החומר CH3NH2(g) מגיב כבסיס כי הוא מקבל פרוטון +H. - أمامك مخطّط لتغيّرات إنتالبيا.
ما هي قيمة إنتالبيا التبخير للبروم ؟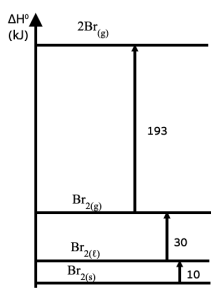
הסבר
תשובה: ב
תהליך אידוי הוא מעבר מנוזל לגז.Br2(ℓ) → Br2(g)
ניתוח קטע ממאמר מדעי – חובה
- קרא את הקטע שלפניך, וענה על כל הסעיפים א-ה שאחריו (שאלת חובה – 20 נקודות).
خطوة صغيرة على القمر، خطوة كبيرة للكيمياء
المرّة الأولى التي هبط فيها روّاد فضاء على القمر وعادوا إلى الكرة الأرضيّة بسلام، كانت في تاريخ 20 تمّوز 1969
في مهمّة أپولو 11 . ومنذئذ هبطت خمس سفن فضائيّة مع روّاد فضاء على سطح القمر في مهمّة أپولو. وكالة الفضاء
الأمريكيّة ناسا ( NASA ) أعلنت عن نيّتها إرسال روّاد فضاء مرّة أخرى إلى القمر في سنة 2024 .
من أجل الإقلاع من القمر في طريق العودة إلى الكرة الأرضيّة، يجبالتغلّبعلى قوّة جاذبيّة القمر. يستعملون في محرّك
السفينة الفضائيّة وقودًا تلقائيَّ الاشتعالِ (هيپرچوليًّا). الوقود التلقائيُّ الاشتعالِ هو وقود سائليّ يتفاعل فيما بينه في درجة
حرارة الغرفة بالتلامس فقط، دون حاجة للتسخين أو إِحداث شرارة لبدء التفاعل.
في مشروع أپولو كان الوقود التلقائيّ الاشتعال خليطًا سائليًّا من الهيدريزين، N2H4(ℓ)، ومثيل الهيدريزين، NH(CH3)NH2(ℓ)، الذي خُزِن في وعاء معيّن، وَ N2O4(ℓ)، الذي حُفِظ في ضغط عالٍ، في وعاء آخر. عندما تَلامَسَت السوائل، حدث تفاعل فوريّ كَوَّن تيّارًا غازيًّا ملتهبًا في ضغط عالٍ، وهو الذي أدّى إلى إقلاع السفينة الفضائيّة من سطح القمر. عندما أقلعت السفينة الفضائيّة انطلقت شرارات وتكوّنت لهبة على منصّة الإطلاق التي بقيت على أرضالقمر.

أثناء المكوث على القمر، أخذ روّاد الفضاء عيّنات من التربة، استُعملت وما زالت تُستعمَل حتّى اليوم لبحث تركيبتها وعمرها وطريقة تكوُّنها.
الموادّ التي تُركِّب تربة القمر تختلف عن الموادّ الشائعة على سطح الكرة الأرضيّة. مثلاً، على سطح الكرة الأرضيّة تمرّ أيوناتי Fe2+ بأكسدة بواسطة الأوكسجين الذي في الهواء وتتحوّل إلى أيونات Fe3+. هذه العمليّة لا تحدث بتاتًا في القمر، لذلكلا يوجد في تربة القمر مركَّباتتحوي أيونات Fe3+ ، وإنّما مركَّباتتحوي أيونات Fe2+ فقط.
ي عيّنات التربة التي أخذها روّاد الفضاء من القمر، وُجدت أيضًا مركَّبات حَوَت النظير النادر . يتكوّن النظير على سطح القمر في عمليّاتانحلال إشعاعيّ للنظير . من المعلوماتالتي كانتلدى روّاد الفضاء عن النظير ، استنتجوا أنّ القمر تكوّن بعد 60 مليون سنة تقريبًا من تكوُّن المجموعة الشمسيّة.
تخطّط دول عديدة في العالَم مهمّات لبحث القمر. رغم أنّه تجمّعت معلومات كثيرة في أيّامنا عن كيمياء القمر، إ لا لّا لّاأّنّه يُتوقّع ظهور اكتشافات جديدة في هذا الموضوع في المستقبل أيضًا.
المصدر: https://www.chemistryworld.com/2128.tag
- أحد مركِّبات الوقود التلقائيّ الاشتعال هو خليط سائليّ للهيدريزين ومثيل الهيدريزين.
اكتب تمثيلاً كاملاً للصيغة البنائيّة لجزيء الهيدريزين، N2H4، وتمثيلاً كاملاً للصيغة البنائيّة لجزيء مثيل الهيدريزين، NH(CH3)NH2.
תשובה
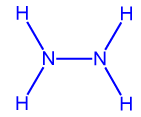
الهيدريزين
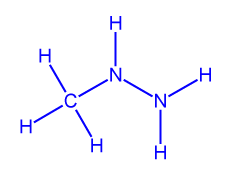 مثيل الهيدريزين
مثيل الهيدريزين - حسب القطعة، عندما تتلامس السوائل N2H4(ℓ) وَ NH(CH3)NH2(ℓ) وَ N2O4(ℓ) يحدث تفاعل فوريّ.
לأمامك قولان i وَ ii يتطرّقان إلى التفاعل الذي حدث. حدِّد بالنسبة لكلّ واحد منهما إذا كان صحيحًا أم غير صحيح. علّل كلّ واحد من التحديدين، حسب ما ورد في القطعة.
- بالنسبة للتفاعل الذي حدث ΔH0<0. נכון. קיימים מספר הסברים אפשריים – כי התגובה המתרחשת יוצרת זרם גז לוהט. – כתוב כי נפלטו גיצים. – נוצרה להבה על כן השיגור. – האנרגייה המשתחררת מאפשרת לחללית להמריא. כל אחת מהתופעות האלו מעידה על אנרגייה שנפלטת. פליטת אנרגייה מעידה על תגובה אקסותרמית ΔH0<0.
- طاقة تنشيط التفاعل الذي حدث عالية. לא נכון. רשום במאמר שהתגובה מתרחשת במגע בלבד בין המגיבים ללא צורך בחימום או מתן ניצוץ.
- في تفاعل N2O4(ℓ) مع N2H4(ℓ) ينتج H2O(g) وَ N2(g).
- اكتب معادلة موازَنة للتفاعل.
N2O4(ℓ) + 2N2H4(ℓ) → 4H2O(g) + 3N2(g)
- في هذا التفاعل، تتفاعل بالكامل 10 كغم N2H4(ℓ). ما هو عدد المولات الكلّيّ للغازات التي تنطلق في التفاعل؟ فصّل حساباتك.
H2O(g) N2H4(ℓ) 4 2 יחס מולים 10000 m (גרם) 32 Mw (גרם/מול) 312.5 n (מול)
ביחד מספר המולים הכולל של הגזים שנפלטים הוא:N2(g) N2H4(ℓ) 3 2 יחס מולים 10000 m (גרם) 32 Mw (גרם/מול) 312.5 n (מול) 468.75 + 625 = 1093.75mol
- اكتب معادلة موازَنة للتفاعل.
- أيّ مركَّب من مركَّبَي الحديد يمكن إيجاده على سطح القمر: FeS(s)، أم Fe2S3(s)؟ علّل حسب ما ورد في القطعة. FeS(s). בקטע כתוב שעל הירח אין יוני ברזל +Fe3 ,רק יוני +Fe2. בתרכובת FeS(s). יש יוני +Fe2. בתרכובת Fe2S3(s) יש יוני +Fe3 .
- النظير يتكوّن من النظير في مرحلتين متتاليتين لانحلال إشعاعيّ – المرحلة 1 والمرحلة 2.النظير A هو ناتج في المرحلة 1 ويتفاعل في المرحلة 2 .
- 1. + أشعّة إشعاعيّة من نوع بيتا
أشعّة إشعاعيّة من نوع ____ + .2
- ما هو العدد الذرّيّ للنظير A؟ היות שבשלב הראשון יש קרינת ביתא β. אז המספר האטומי עולה באחד יחסית ליסוד המגיב Hf ולכן המספר האטומי של יסוד A הוא 73.
- ما هو عدد الكتلة للنظير A؟ בהמשך להסבר מהסעיף הקודם מספר המסה לא משתנה ונשאר 182.
- ما هو رمز العنصر A؟ הסמל של היסוד A הוא .
- ما هو نوع الأشعّة الإشعاعيّة التي تنطلق في المرحلة 2؟ קרינת ביתא β . כי שוב יש עליה במספר האטומי באחד.
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 14-10 (لكلّ سؤال 20 درجة).
10. مصطلحات أساسيّة والمبنى والترابط
يتناول السؤال مبنى وصفات مادّتين جزيئيّتين: A وَ B موجوفي وعاءين منفردين.
أمامك جدول يشمل معطيات عن الجزيئيّتين:
| المادّة | درجة حرارة الانصهار (°C) | درجة حرارة الغليان (°C) |
| A | -45 | 157 |
| B | -114 | 78 |
- ما هي الحالة التراكميّة (حالة المادّة) لكلّ واحدة من المادّتين A وَ B في درجة حرارة الغرفة (25°C)؟ علّل.
מצב הצבירה של חומר A הוא נוזל. כי בטמפרטורת החדר נמצאים מעל לטמפרטורת ההיתוך שלו אבל מתחת לטמפרטורת הרתיחה שלו.
מצב הצבירה של חומר B הוא נוזל. כי בטמפרטורת החדר נמצאים מעל לטמפרטורת ההיתוך שלו אבל מתחת לטמפרטורת הרתיחה שלו. - أمامك رسمان توضيحيّان يصفان بشكل جزئيّ المبنى الميكروسكوبيّ للمادّتين A ו- B في درجة حرارة الغرفة.
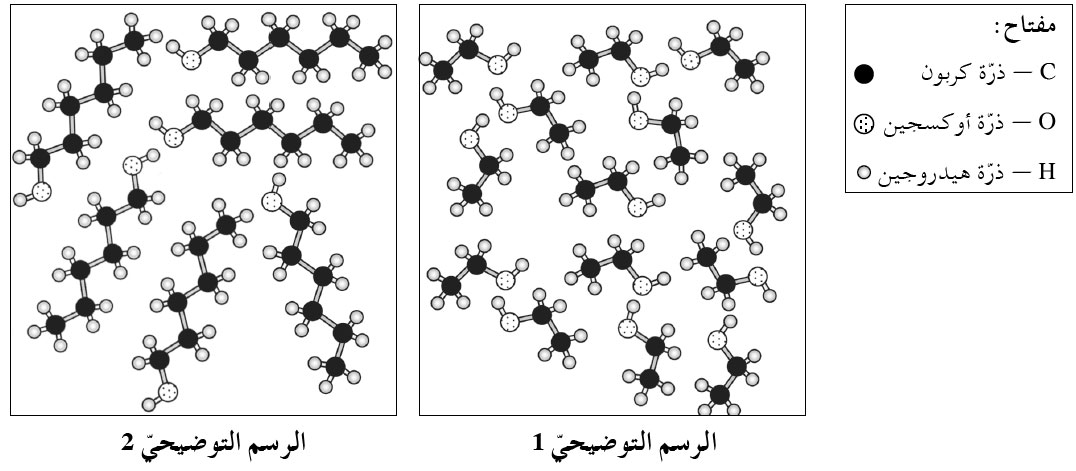
- أمامك أربعة أقوال a-d. بالنسبة لكلّ واحد منها، اذكر إذا كان صحيحًا أم غير صحيح.
- جزيئات المادّتين مركَّبة من نفس أنواع الذرّات.
נכון (בשניהם יש אטומי מימן, פחמן וחמצן) - المجموعة الويفيّة لجزيئات المادة A يختلف عن عدد ذرّات الكربون في جزيئات المادة B.
לא נכון (בשניהם הקבוצה הפונקציונלית היא כוהל). - عدد ذرّات الكربون في جزيئات المادة A يختلف عن عدد ذرّات الكربون في جزيئات المادة B.
נכון (במולקולה של חומר A – איור 2 יש 6 אטומי פחמן ואילו במולקולה של חומר B – איור 1 יש 2 אטומי פחמן) - في المادّتين A وَ B أشكال حركة الجزيئات هي من نوع اهتزاز (ڤيبريشين) فقط.
לא נכון (יש גם סיבוב וגם תנודה).
- جزيئات المادّتين مركَّبة من نفس أنواع الذرّات.
- اعتمادًا على التأثيرات المتبادلة التي تعمل بين الجزيئات، حدِّد أيا من الرسمين التوضيحيّ، التوضيحيّ 1 أم الرسم التوضيحي 2، يصف المبنى الميكروسكوبيّ للمادة A. علّل.
חומר A מיוצג באיור 2. בין המולקולות של שני החומרים יש גם קשרי מימן וגם אינטראקציות ון־דר־ולס. החלק שמאפשר יצירת קשרי מימן זהה בשני החומרים (קבוצה הידרוקסילית או כוהלית). במולקולות של החומר שנמצא באיור 2 יש שייר פחמימני גדול כלומר, חלק הידרופובי גדול יותר. ענן האלקטרונים של המולקולות גדול יותר (וגם שטח פנים גדול יותר) ולכן אינטראקציות הון־דר־ולס בין המולקולות שלו חזקות יותר. נדרשת אנרגייה רבה יותר לניתוק אינטראקציות הון־דר־ולס שבין המולקולות שלו ולכן טמפרטורת הרתיחה שלו גבוהה יותר.
לכן חומר A הוא איור 2.
- أمامك أربعة أقوال a-d. بالنسبة لكلّ واحد منها، اذكر إذا كان صحيحًا أم غير صحيح.
- إلى كلّ واحد من الوعاءين اللذين توجد فيهما المادّتان A وَ B، أضافوا حجمًا متساويًا من الماء وخلطوا. الرسمان التوضيحيّان 3 وَ 4 يصفان المبنى الميكروسكوبيّ لخليط كلّ واحدة من المادّتين مع الماء بعد الخلط.
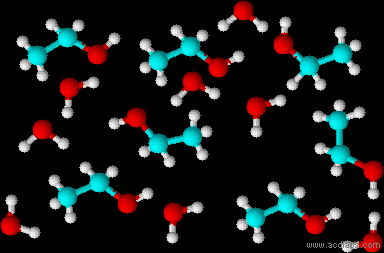
الرسم التوضيحيّ 3
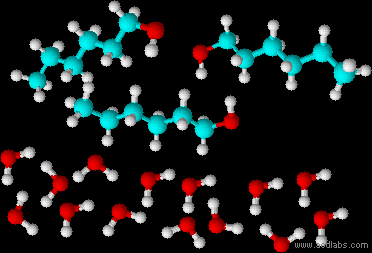
الرسم التوضيحيّ 4
- حدِّد أيًّا من الرسمين التوضيحيّين، الرسم التوضيحي 3 أم الرسم التوضيحي 4، يصف محلولاً بطريقة ميكروسكوبيّة؟ علّل تحديدك.
איור 3 מתאר תמיסה. באיור 3 יש תערובת של מולקולות משני סוגים המפוזרות באופן אחיד כך שנוצרת תערובת אחידה, זו תמיסה כי יש בה מולקולות ממס נוזלי, המים, ומולקולות של מומס. באיור 4 החומרים לא התערבבו (לא התמוססו) מתוארות שתי שכבות של נוזלים אין בתיאור זה פיזור אחיד של המולקולות. - اكتب معادلة تفاعل الإذابة في الماء للمادّة الملائمة للرسم التوضيحيّ الذي اخترتَه في البند الفرعيّ ״جi”.
תשובה - فسّر لماذا المادّة الأخرى لا تذوب في الماء. اعتمد في إجابتك على التأثيرات المتبادلة بين الجسيمات..
חומר A לא מתמוסס במים. החומר שלא התמוסס במים הוא חומר שלמולקולות שלו יש חלק הידרופובי גדול יחסית. לכן בין השיירים הפחמימניים נוצרות אינטראקציות ון־דר־ולס. בין המולקולות שלו יש גם קשרי מימן אבל הם זניחים יחסית. לכן, מולקולות המים לא מצליחות לחדור בין המולקולות של חומר A וליצור איתן קשרי מימן. - ما هو الفرق الماكروسكوبيّ بين الخليطين الموصوفين في الرسمين التوضيحيّين 3 وَ 4؟
באיור 3 נקבל נוזל צלול ואילו באיור 4 נראה 2 שכבות (אולי גם עכירות).
- حدِّد أيًّا من الرسمين التوضيحيّين، الرسم التوضيحي 3 أم الرسم التوضيحي 4، يصف محلولاً بطريقة ميكروسكوبيّة؟ علّل تحديدك.
11. الأكسدة والاختزال والحسابات الكيميائيّة
إسرائيل هي إحدى أكبر المنتِجات في العالم لعنصر البروم، Br2(ℓ) ومركَّباته.
أمامك التفاعل (1) الذي يتفاعل فيه البروم مع الماء لإنتاج محلول HBrO(aq)، الذي يمكن أن يُستعمَل للتعقيم والتبييض.
(1) Br2(ℓ) + H2O(ℓ) → HBrO(aq) + HBr(g)
- א
- حدِّد هل يتفاعل Br2(ℓ) في التفاعل (1) كمؤكسِد فقط، أم كمختزِل فقط، أم كمؤكسِد وكمختزِل أيضًا. علّل تحديدك.
הברום מגיב בתגובה גם כמחמצן וגם כמחזר ניתן לראות על פי השינויים בדרגות החמצון:רואים שאטומי הברום Br גם עולים וגם יורדים בדרגת החמצון מ-0 ל-1+ ומ-0 ל-1-. זה אומר שהם גם מוסרים וגם מקבלים אלקטרונים גם עוברים תגובת חמצון וגם תגובת חיזור. לכן הם משמשים גם כמחמצן וגם כמחזר.
أدخلوا مادّة مختزِلة إلى محلول HBrO(aq). حَدَثَ تفاعُل.
- حدِّد أيّة أيونات تتواجد في المحلول في نهاية التفاعل: أيونات Br‾(aq) أم أيونات BrO3‾(aq). علّل تحديدك.
לאטומי הברום בחומר HBrO דרגת חמצון 1+ : .
היות שהוסיפו חומר מחזר אז אטומי הברום הגיבו כחומר מחמצן ולכן קבלו אלקטרונים (עברו תגובת חיזור). וירדו בדרגת החמצון. לכן, התוצר הוא: Br–(aq) . שבו לברום דרגת חמצון 1- (ביון השני BrO3–(aq) לברום דרגת חמצון של 5+ הוא יהיה תוצר של תהליך חמצון ולא חיזור של אטומי הברום בחומר HBrO(aq)).
- حدِّد هل يتفاعل Br2(ℓ) في التفاعل (1) كمؤكسِد فقط، أم كمختزِل فقط، أم كمؤكسِد وكمختزِل أيضًا. علّل تحديدك.
أمامك التفاعل (2) الذي تَنتُج فيه أيونات BrO3‾(aq).
(2) 3BrO‾(aq) → 2Br‾(aq) + BrO3‾(aq)
- ב
- كم مول إلكترونات مرّت في التفاعل الذي نَتَجَ فيه 1 مول أيونات BrO3‾(aq)؟ علّل.
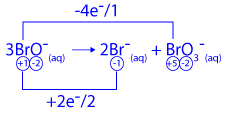
e‾ ב 4 1 יחס מולים 4 1 n (מול) עוברים 4 מול אלקטרונים.
أيونات BrO3‾(aq) سامّة. التركيز الأقصى المسموح به لِ BrO3‾(aq) في الماء هو 0.01 ميكروغرام في اللتر.
معطى أنّ: 1 ميكروغرام = 10-6 × 1 غرام.- ما هو العدد الأقصى المسموح به لأيونات BrO3‾(aq) في 1 لتر من الماء؟ فصّل حساباتك.
معطى أنّه: في مول واحد من الجسيمات يوجد 1023×6.02 جسيم.
נתון: במול אחד של חלקיקים יש 1023×6.02 חלקיקים.N = n × NA = 7.81×10-11 × 6.02×1023 = 4.7×1013יונים
המספר המרבי של יוני ה- BrO3–(aq) הוא 4.7×1013.
- كم مول إلكترونات مرّت في التفاعل الذي نَتَجَ فيه 1 مول أيونات BrO3‾(aq)؟ علّل.
عنصر البروم هو سامّ وخطِر، لذلك يتمّ حفظه في أوعية خزن مغلقة. في حالة وقوع تسرُّب، يُفاعِلون بخار البروم مع الأمونيا، NH3(g). يحدث التفاعل (3).
(3) 3Br2(g) + 8NH3(g) → N2(g) + 6NH4Br(s)
- ג
- حدِّد هل يتفاعل NH3(g) في التفاعل (3) كمؤكسِد فقط، أم كمختزِل فقط، أم كمؤكسِد وكمختزِل أيضًا.
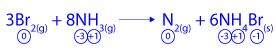 לפי השינויים בדרגות החמצון ניתן לקבוע שהחומר NH3(g) מגיב כמחזר בלבד כי אטומי החנקן N עולים בדרגת החמצון מ-3- ל-0 הם מוסרים אלקטרונים ועוברים תגובת חמצון.
לפי השינויים בדרגות החמצון ניתן לקבוע שהחומר NH3(g) מגיב כמחזר בלבד כי אטומי החנקן N עולים בדרגת החמצון מ-3- ל-0 הם מוסרים אלקטרונים ועוברים תגובת חמצון. - كم كيلوغرام NH4Br(s) يَنتُج عندما تتفاعل 8.0 كغم من بخار البروم مع الأمونيا؟ فصّل حساباتك.
מתקבלים 9.8 קילוגרם של NH4Br(s).NH4Br(s) Br2(g) 6 : 3 יחס מולים 9800 8000 m (גרם) 98 160 Mw (גרם/מול) 100 50 n (מול) - ما هو حجم غاز النيتروجين، N2(g) ،في شروط STP الذي يَنتُج عندما تتفاعل 8.0 كغم من بخار البروم مع الأمونيا؟ فصّل حساباتك.
معطى أنّ: الحجم المولاريّ للغاز في شروط STP هو 22.4 لتر.
נפח גז החנקן המתקבל הוא 373.33 ליטר.N2(g) Br2(g) 1 : 3 יחס מולים 16.66 50 n (מול) 22.4 Vm (ליטר / מול) 373.33 V (ליטר)
- حدِّد هل يتفاعل NH3(g) في التفاعل (3) كمؤكسِد فقط، أم كمختزِل فقط، أم كمؤكسِد وكمختزِل أيضًا.
כימיה של מזון
אצות עשירות ברכיבים תזונתיים רבים. הן מכילות את כל אבות המזון, ויטמינים ומינרלים רבים.
בטבלה שלפניך מוצגים נתונים של שתי חומצות שומן חיוניות שיש באצות:
| שם חומצת השומן | חומצה ארכידונית (ARA) | חומצה אייקוספנטנואית (ESP) |
| טמפרטורת היתוך (ºC) | -49 | -54 |
| ייצוג מקוצר לנוסחת המבנה של המולקולה. | 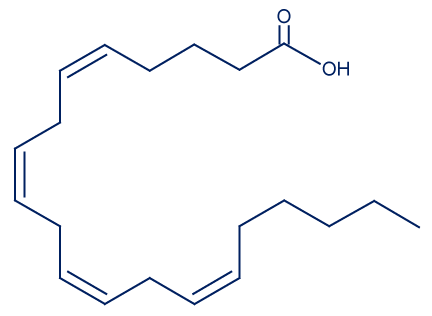 | —————- |
| רישום מקוצר של חומצת השומן | —————— | C20: 5ω3 cis cis cis cis cis |
- i. מה הן חומצות שומן חיוניות?
חומצת שומן שהגוף לא יכול לייצר בעצמו והוא צריך אותה לתפקודים שונים ולכן היא נצרכת ממזונות שונים.
ii. כתוב רישום מקוצר של חומצת השומן ARA.
C20:4 ω 6 all cis
iii. רשום ייצוג מקוצר לנוסחת המבנה של מולקולת חומצת השומן EPA.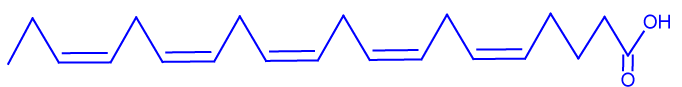
- טמפרטורת ההיתוך של חומצה סטיארית C18:0, (St) , היא 69.6°C.
לחומצה סטיארית טמפרטורת היתוך גבוהה הרבה יותר מטמפרטורות ההיתוך של חומצות השומן הנתונות ARA ו- EPA.
הסבר קביעה זו. בתשובתך התבסס על האינטראקציות הפועלות בין המולקולות.
חומצות השומן ARA ו- EPA הן חומצות שומן לא רוויות. יש בהן קשרים מסוג C=C. קשרים אלה גורמים לכיפוף במבנה המולקולה ולכן המולקולות הללו נארזות באריזה פחות צפופה יחסית למולקולות החומצה הסטארית. לכן אינטראקציות הון־דר־ולס הקיימות בין מולקולות ARA או בין מולקולות EPA חלשות יותר מאינטראקציות הון־דר־ולס הקיימות בין מולקולות החומצה הסטארית ולכן נדרשת פחות אנרגייה לנתק את הקשרים הקיימים ביניהן ולכן טמפרטורת ההיתוך שלהן נמוכה מזו של החומצה הסטארית.
כאשר מייצרים תוסף מזון מאצות , רצוי להוסיף נוגדי חמצון כדי למנוע את חמצון חומצות השומן החיוניות שיש באצות ולשמור עליהן לאורך זמן.
נתונות נוסחאות מבנה מקוצרות של הוויטמינים C ו- E הפועלים כנוגדי חמצון (אנטיאוקסידנטים):
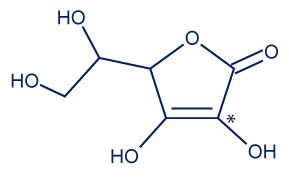 |  |
| ויטמין C | ויטמין E |
- אטום הפחמן המסומן ב- * בנוסחת המבנה המקוצרת של ויטמין C משתתף בתהליך שבו הוויטמין משמש נוגד חמצון.
- מהי דרגת החמצון של אטום הפחמן המסומן ב- * בנוסחת המבנה המקוצרת של ויטמין C?
דרגת החמצון של אטום הפחמן המסומן ב * הוא 1+.
- מבין ההיגדים a-c שלפניך, ציין מה הם ההיגדים המתאימים לתיאור פעילותו של ויטמין C כנוגד חמצון.
- דרגת החמצון של אטום הפחמן המסומן ב-* עולה.
- ויטמין C מגיב כמחמצן בתהליכי חמצון־חיזור.
- ויטמין C מונע תהליכי חמצון בלתי רצויים של חומרים.
- קבע איזה ויטמין, C או E, מתאים פחות לשמש נוגד חמצון שמתמוסס בתערובת של חומצות השומן הנתונות . הסבר את קביעתך.
ויטמין C פחות מתאים לשמש כנוגד חמצון מכיוון שהוא יתמוסס פחות טוב בחומצות השומן. בין מולקולות ויטמין C יש בעיקר קשרי מימן ואילו בין מולקולות חומצות השומן יש בעיקר אינטראקציות ון־דר־ולס. לכן מולקולות ויטמין C לא יצרו קשרי מימן עם מולקולות חומצות השומן.
בין מולקולות ויטמין E יש בעיקר אינטראקציות ון־דר־ולס בין המולקולות (חלק הידרופובי גדול מאוד) ולכן הן יכולות ליצור אינטראקציות ון־דר־ולס עם מולקולות חומצות השומן. לכן ויטמין E יתמוסס בחומצות השומן.
- מהי דרגת החמצון של אטום הפחמן המסומן ב- * בנוסחת המבנה המקוצרת של ויטמין C?
- אחד המינרלים החשובים שיש באצות הוא התרכובת KI. תרכובת זו היא מקור ליוני יודיד ‾ I.
לפי הוראות משרד הבריאות , הצריכה היומית המומלצת של יוד היא 150 מיקרוגרם יוני יודיד.
דפי אצות “נורי” משמשים להכנת סושי ומאכלים אחרים. בדף אצת “נורי”, שמשקלו 2.5 גרם, יש 45 מיקרוגרם יוני יודיד.
קבע אם מנת מרק שהוכנה מ- 10 גרם דפי אצות “נורי” מכילה בדיוק את כמות יוני היודיד המומלצת ליום , יותר מן הכמות המומלצת או פחות ממנה. פרט את חישוביך והסבר.
10 גרם אצות זה 4 דפי אצה (כי כל דף הוא 2.5 גרם)‾ I (מיקרוגרם) דף אצה אחד 45 1 180 4 הכמות יותר גדולה מהכמות המומלצת ליום.
חומצות ובסיסים
בניסוי שערכו תלמידים במעבדה, הם סימנו כוס באות A והמיסו בה 3.6 גרם נתרן הידרוקסידי מוצק, NaOH(s) , במים.
בכוס A התקבלה תמיסה בנפח של 600 מ”ל.
- i. נסח את תהליך ההמסה שהתרחש בעת הכנת התמיסה בכוס A.
ניסוח התהליךii. האם ה- pH של התמיסה בכוס A קטן מ- 7, שווה ל- 7 או גדול מ- 7? נמק.
ה-pH יהיה גדול מ- 7 כי יש בתמיסה עודף יוני הידרוקסיד, OH–(aq).
התלמידים חילקו את התמיסה שבכוס A באופן שווה לשלוש כוסות כימיות I, II, III. בכל כוס 200 מ”ל תמיסה, כפי שמתואר באיור 1.
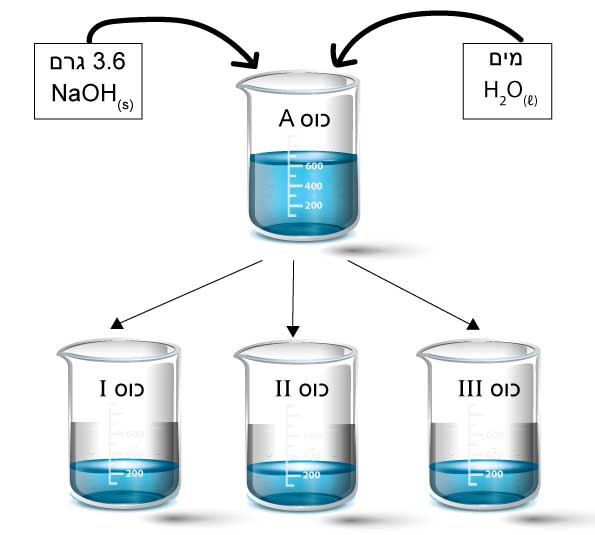
- i. לפניך 4 היגדים a-d, המתייחסים לתמיסות בכוסות I, II, III, כפי שמתואר באיור 1.
ציין מהם ההיגדים הנכונים מן ההיגדים a-d.- מספר המולים של המומס בכל אחת מן הכוסות קטן ממספר המולים של המומס בתמיסה שהייתה בכוס A.
נכון כי מספר המולים של המומס מתחלק לשלוש הכוסות באופן שווה. - מספר המולים של המומס בכל אחת מן הכוסות שווה למספר המולים של המומס בתמיסה שהייתה בכוס A.
לא נכון - ריכוז התמיסה בכל אחת מן הכוסות קטן מריכוז התמיסה שהייתה בכוס A.
לא נכון הריכוז לא משתנה והוא זהה לריכוז התמיסה המקורית. - ריכוז התמיסה בכל אחת מן הכוסות שווה לריכוז התמיסה שהייתה בכוס A. נכון
ii. חשב את מספר המולים של המומס בכל אחת מן הכוסות I, II, III. פרט את חישוביך.
נחשב את מספר המולים של המומס בכל אחת מהכוסות. היות שהמסה הכוללת של המומס NaOH(s) הייתה 3.6 גרם והיא התחלקה ל-3 כוסות אז בכל כוס יש 1.2 גרם של NaOH(s).NaOH(s) 1.2 m (גרם) 40 Mw (גרם/מול) 0.03 n (מול) מספר המולים של המומס בכל אחת מהכוסות הוא 0.03 מול.
*ניתן גם לחלק את המסה למסה המולרית ולמצוא את מספר המולים הכולל ואותו לחלק ל- 3. - מספר המולים של המומס בכל אחת מן הכוסות קטן ממספר המולים של המומס בתמיסה שהייתה בכוס A.
- התלמידים הוסיפו לכל אחת מן הכוסות I, II, III תמיסות שונות זו מזו.
לכוס I הוסיפו התלמידים נפח מסוים של תמיסה של חומצת מימן כלורי, HCℓ(aq) , בריכוז 0.2M, וערבבו היטב. התרחשה תגובה.
בתום התגובה ערך ה- pH היה 7.- נסח ניסוח נטו לתגובה שהתרחשה.
H3O+(aq) + OH–(aq) → 2H2O(ℓ)
- מהו נפח תמיסת HCℓ(aq) שהוסיפו לכוס I? פרט את חישוביך.
ראשית נחשב את מספר המולים של המומס בכל אחת מהכוסות היות שהמסה הכוללת של המומס NaOH(s) הייתה 3.6 גרם והיא התחלקה ל-3 כוסות אז בכל כוס יש 1.2 גרם של NaOH(s).NaOH(s) 1.2 m (גרם) 40 Mw (גרם/מול) 0.03 n (מול) כעת נחשב כמה מול יוני הידרוקסיד OH–(aq) יש בכוס הראשונה:
OH–(aq) NaOH(s) 1 : 1 יחס מולים 0.03 0.03 n (מול) כעת נחשב כמה מול יוני הידרוניום H3O+(aq) נדרשו לסתירה מלאה של התמיסה בכוס I.
H3O+(aq) OH–(aq) 1 : 1 יחס מולים 0.03 0.03 n (מול) וכעת נחשב את מספר המולים של חומצת ה- HCℓ(aq) שנדרשו לסתירה וכן את נפח התמיסה.
HCℓ(aq) H3O+(aq) 1 : 1 יחס מולים 0.03 0.03 n (מול) 0.2 C (מול/ ליטר) 0.15 V (ליטר) נפח תמיסת HCℓ(aq) שהוסיפו לכוס I הוא 0.15 ליטר.
לכוס II הוסיפו התלמידים 150 מ”ל תמיסת חומצה גופרתית, H2SO4(aq) , בריכוז 0.2M, וערבבו היטב. התרחשה תגובה.
- קבע אם בתום התגובה ה- pH בכוס II היה חומצי, בסיסי או ניטרלי.
פרט את חישוביך או נמק באופן מילולי.
ראשית נחשב כמה מול יש מהחומצה H2SO4(aq):H2SO4(aq) 0.2 C (מול / ליטר) 0.15 V (ליטר) 0.03 n (מול) כעת נחשב כמה מול יוני הידרוניום יש בתמיסה הזו:
H3O+(aq) H2SO4(aq) 2 : 1 יחס מולים 0.06 0.03 n (מול) וכעת נבדוק האם יש עודף מאחד מהיונים בתום תגובת הסתירה:
H3O+(aq) OH–(aq) 1 : 1 יחס מולים 0.06 0.03 n (מול) התחלה 0.03 0.03 n (מול) תגובה 0.03 — n (מול) סוף היות שנותר עודף יוני הידרוניום ה-pH בתום התגובה יהיה קטן מ-7.
- נסח ניסוח נטו לתגובה שהתרחשה.
- לכוס III הוסיפו התלמידים 80 מ”ל תמיסת אלומיניום כלורי, AℓCℓ3(aq). צבע התמיסה נהפך ללבן עכור.
לפניך ניסוח נטו לתגובה שהתרחשה.Aℓ3+(aq) + 3OH‾(aq) → Aℓ(OH)3(s)
כל המגיבים הגיבו בשלמות.
חשב את ריכוז תמיסת AℓCℓ3(aq) שהוסיפו לכוס III.
נחשב כמה מול יוני אלומיניום Aℓ3+(aq) מגיבים עם יוני ההידרוקסיד OH–(aq) (נזכיר שכבר מצאנו בסעיפים הקודמים כמה מול יוני הידרוקסיד יש בכל אחת מהכוסות)Aℓ3+(aq) OH–(aq) 1 : 3 יחס מולים 0.01 0.03 n (מול) כעת נחשב כמה מול אלומיניום כלורי AℓCℓ3(aq) יש בתמיסה ונחשב את נפח התמיסה שהשתתפה בתגובה:
AℓCℓ3(aq) Aℓ3+(aq) 1 : 1 יחס מולים 0.01 0.01 n (מול) 0.08 V (ליטר) 0.125 C(M) נפח תמיסת ה- AℓCℓ3(aq) הוא 0.125M .
מבנה וקישור, אנרגייה
שאלה זו עוסקת בחומרים פחמן דו־חמצני, CO2(g) , ופחמן דו-גופרי, CS2(ℓ).
- i. הסבר מדוע, בטמפרטורת החדר, פחמן דו-גופרי הוא נוזל ואילו פחמן דו־חמצני הוא גז.
שני החומרים הם חומרים מולקולריים שבין המולקולות שלהם ישנן אינטראקציות ון־דר־ולס. למולקולות של פחמן דו-גופרי יש ענן אלקטרונים גדול יותר מענן האלקטרונים של מולקולות הפחמן הדו־חמצני ולכן אינטראקציות הון־דר־ולס בין המולקולות שלו חזקות יותר. בטמפרטורת החדר אין מספיק אנרגייה לנתק את הקשרים שיש בין מולקולות הפחמן הדו-גופרי לכן טמפרטורת הרתיחה שלו גבוהה מטמפרטורת החדר ובטמפרטורת החדר הוא נוזל. לעומת זאת יש מספיק אנרגייה לנתק את הקשרים הקיימים בין מולקולות הפחמן הדו־חמצני. לכן טמפרטורת הרתיחה שלו נמוכה מטמפרטורת החדר ובטמפרטורת החדר הוא גז.
בתנאים מתאימים, פחמן דו־חמצני מתמוסס בפחמן דו-גופרי.
- הסבר מדוע פחמן דו־חמצני, CO2(g) , מתמוסס בפחמן דו-גופרי, CS2(ℓ).
פחמן דו־חמצני נמס בפחמן דו גופרי כי בערבוב החומרים נוצרות בין המולקולות שלהם אינטראקציות ון־דר־ולס. - נסח את תהליך ההמסה של פחמן דו־חמצני בפחמן דו-גופרי.
- i. סרטט את נוסחת ייצוג האלקטרונים של מולקולת CO2 ואת נוסחת ייצוג האלקטרונים של מולקולת CS2.


ii. בטבלה שלפניך נתונים ערכי אנתלפיית הקשר של שני סוגי הקשרים המופיעים במולקולות CO2 ו- CS2.
התאם לכל ערך את סוג הקשר המתאים. ציין את הגורמים להבדל בין אנתלפיות הקשר.אנתלפיית הקשר
kJ⁄moℓ (קג’אול למול)הקשר 803 C = O 573 C = S הקשר C = O קוטבי והקשר C = S לא קוטבי.
אטום החמצן O בקשר C = O בעל רדיוס קטן מאטום הגופרית S בקשר C = S . - אנתלפיית האידוי של פחמן דו-גופרי היא 27.6kJ⁄moℓ.
- נסח את התגובה של אידוי פחמן דו-גופרי ורשום את ערכו וסימנו של ΔH0 לתגובה.
CS2(ℓ) → CS2(g) ΔH0=27.6kJ
נתון ניסוח התגובה של שרפת פחמן דו-גופרי נוזלי (1) וכן שינוי האנתלפייה המלווה את התגובה.
(1) CS2(ℓ) + 3O2(g) → CO2(g) + 2SO2(g) ΔH01=-1076.1 kJ
נתון ניסוח התגובה של שרפת פחמן דו-גופרי גז (2).
(2) CS2(g) + 3O2(g) → CO2(g) + 2SO2(g) ΔH02=?
- חשב את הערך של ΔH02. פרט את חישוביך.
נתון:(1) CS2(ℓ) + 3O2(g) → CO2(g) + 2SO2(g) ΔH01=-1076.1 kJ
כדי להגיע לחישוב האנתלפיה של התגובה:
(2) CS2(g) + 3O2(g) → CO2(g) + 2SO2(g) ΔH02=?
נעזר בתגובה שניסחנו בסעיף ג i.
את התגובה הזו נהפוך (נכפול ב- 1-) ונסכום עם תגובה (1).CS2(g) →
CS2(ℓ)ΔH0=-27.6kJ
(1)CS2(ℓ)+ 3O2(g) → CO2(g) + 2SO2(g) ΔH01=-1076.1(2) CS2(g) + 3O2(g) → CO2(g) + 2SO2(g) ΔH02 = -1103.7 kJ
שינוי האנתלפיה עבור עבור תגובה (2) הוא: ΔH02 = -1103.7 kJ
- נסח את התגובה של אידוי פחמן דו-גופרי ורשום את ערכו וסימנו של ΔH0 לתגובה.
- בכל מולקולה של גופרית דו־חמצנית, SO2 , אטום הגופרית קשור לשני אטומי חמצן.
נסמן כל אחד מן הקשרים ב- S–O.
נתון אנתלפיית הקשר של O=O היא 497kJ⁄moℓ.
חשב את ערכה של אנתלפיית הקשר בקשר S–O במולקולת SO2.
היעזר בנתונים שבשאלה, ובתשובותיך בסעיפים הקודמים. פרט את חישוביך.
יש לעבוד עם תגובה מספר (2) שבה כל מרכיבי התגובה נמצאים במצב גז.
| החומר | 2SO2(g) | CO2(g) | 3O2(g) | CS2(g) |
| הקשר | S – O | C = O | O = O | C = S |
| מספר מול קשרים | 4 | 2 | 3 | 2 |
ΔH02 = 2ΔH0(C=S) + 3ΔH0(O = O) – { 2ΔH0(C = O) + 4ΔH0(S – O)}
-1103.7 = 2×573 + 3×497 – ( 2×803 + 4×ΔH0(S – O))
ערכה של אנרגיית הקשר S–O הוא 533.675 קג’אול למול ( ΔH0(S – O) = 533.675kJ⁄moℓ).