اقتراح حلّ المتحان البچروت في الكيمياء 2019
الأسئلة
الفصل الأوّل (40 درجة)
أجب عن ثمانية الأسئلة 8-1 (لكلّ سؤال 2.5 درجة).
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة.
- الجدول الذي أمامك يعرضمعطيات عن تركيبة ثلاثة جسيمات أُشير إليها اعتباطيًّا بالأحرف X وَ Y وَ Z.
الجسيم عدد الپروتونات عدد النيوترونات تنظُّم الإلكترونات X 8 10 2 , 8 Y 9 10 2 , 8 Z 8 8 2 , 6 ما هو التحديد الصحيح؟
- الجسيمان X وَ Y هما نظيران لنفس العنصر.
- للجسيمان X وَ Z نفس الشحنة النوويّة.
יש אותו מספר פרוטונים בגרעין. - ثلاثة الجسيمات X وَ Y وَ Z هي أيونات سالبة.
- الجسيم Y يمثّل ذرّة نيون، Ne.
- الصوديوم، Na(s)، يتفاعل مع الفوسفور، P4(s).
ما هي الصيغة الأمپيريّة للمركَّب الذي يَنتُج في هذا التفاعل؟- NaP4
- NaP3
- Na3P
נתרן Na מתכת מהטור הראשון לכן ליון הנתרן מטען 1+. זרחן אל מתכת מהטור החמישי לכן ליון הזרחן מטען 3-. לכן הנוסחה האמפירית שמתקבלת היא Na3P. (סך כל המטענים החשמליים בנוסחה האמפירית צריך להיות שווה ל-0). - Na4P
- معطاة ثلاث موادّ في الحالة السائلة.
CH3CH2F(ℓ) , CH3CH2OH(ℓ) , CH3CH2NH2(ℓ)
أمامك أربعة أقوال “أ – د” تتعلّق بالقوى التي تعمل بين جزيئات هذه الموادّ.
ما هو القول الصحيح؟- في كلّ واحدة من الموادّ الثلاث توجد أربطة هيدروجينيّة بين الجزيئات.
- الأربطة الهيدروجينيّة التي بين جزيئات CH3CH2NH2(ℓ) أقوى من الأربطة الهيدروجينيّة التي بين جزيئات CH3CH2F(ℓ).
- الأربطة التي بين جزيئات CH3CH2F(ℓ) أقوى من الأربطة التي بين جزيئات CH3CH2OH(ℓ).
- بين جزيئات CH3CH2F(ℓ) توجد تأثيرات متبادلة ڤان در ڤالس فقط.
- معطى الوعاءان، A وَ B ، حجم كلّ واحد منهما هو 1 لتر.
الوعاء A مليء بغاز الميثان، CH4(g).
الوعاء B مليء بغاز الأوكسجين، O2(g).
درجة الحرارة والضغط متساويان في الوعاءين.
ما هو التحديد الصحيح؟- عدد مولات الغاز في الوعاء A يساوي عدد مولات الغاز في الوعاء B.
מכיוון שהגזים נמצאים באותם תנאי טמפרטורה ולחץ, יחס המולים שווה ליחס הנפחים 1:1 ולכן מספר המולים שווה בשני הכלים. - عدد جزيئات الغاز في الوعاء B ضعف عدد جزيئات الغاز في الوعاء A.
- كتلة الغاز في الوعاء A تساوي كتلة الغاز في الوعاء B.
- كتلة الغاز في الوعاء A ضعف كتلة الغاز في الوعاء B.
- عدد مولات الغاز في الوعاء A يساوي عدد مولات الغاز في الوعاء B.
- أمامك معادلة تفاعل أكسدة – اختزال.
4NH3ׂ(g) + 6NO(g) → 5N2(g) + 6H2O(g)
ما هو التحديد الصحيح؟
- الغاز NO(g) هو المختزِل.
- تمرّ الإلكترونات من ذرّات N في جزيئات NO إلى ذرّات N في جزيئات NH3.
- عندما يتفاعل 1 مول NH3ׂ(g)، تمرّ 3 مول إلكترونات.
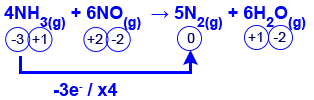
e‾ : NH3ׂ(g) 12 : 4 יחס מולים 3 1 n מול - N2(g) هو ناتج اختزال NH3ׂ(g).
- أمامك معادلات لثلاثة تفاعلات (1)-(3).
1. K2O(s) + H2O(ℓ) → 2K+(aq) + 2OH–(aq)
2. K(s) + H2O(ℓ) → 2K+(aq) + 1⁄2H2(g) + 2OH–(aq)
3. KHSO4(s) + H2O(ℓ) → 2K+(aq) + SO2-4(aq) + H3O+(aq)في أيّ تفاعل/تفاعلين يتفاعل الماء، H2O(ℓ)، كقاعدة؟
- في التفاعل (1) فقط.
- في التفاعل (2) فقط.
- في التفاعل (1) وكذلك في التفاعل (2).
- في التفاعل (3) فقط.
כי רק בתגובה הזו מולקולות המים קלטו פרוטון (+H).
- أمامك مخطّط لتغيّرا ت إنتالبيا.
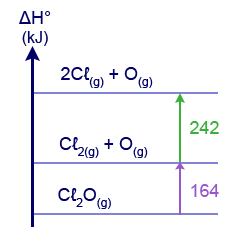 ما هي قيمة إنتالبيا الرباط O–Cℓ في المركَّب Cℓ2O(g)؟
ما هي قيمة إنتالبيا الرباط O–Cℓ في المركَّب Cℓ2O(g)؟- 406kJ⁄moℓ
- 203kJ⁄moℓ
Cℓ2O(g) →2Cℓ(g) + O(g) ΔH0=406kJ
מכיוון שבמולקולה יש שני קשרי O–Cℓ אנרגיית הקשר O–Cℓ היא
. - 164kJ⁄moℓ
- 82kJ⁄moℓ
- عندما يخلطون محلولاً لحامضكلوريد الهيدروجين، HCℓ(aq)، مع محلول ثيوكبريتات الصوديوم، Na2S2O3(aq)، يحدث تفاعل.
أمامك معادلة صافية لهذا التفاعل:2H3O+(aq) + S2O32-(aq) → 3H2O(ℓ) + SO2(g) +1⁄8S8(s)
بحث بعضالط الطُلَّاب التفاعل واقترحوا مقاييس مختلفة لوتيرة التفاعل.
أمامك أربعة اقتراحات IV-I اقترحها الط الطُلَّاب للحصول على معلومات عن وتيرة التفاعل.
I. قياس التوصيل الكهربائيّ للمحلول في نهاية التفاعل.
II. قياس pH المحلول في نهاية التفاعل.
III. قياس التوصيل الكهربائيّ للمحلول في فوارق زمنيّة ثابتة.
IV. قياس pH المحلول في فوارق زمنيّة ثابتة.
ما هما الاقتراحان الأكثر ملاءمة؟- I وَ II
- I وَ IV
- II وَ III
- III وَ IV
רק כאשר מודדים שינוי ליחידת זמן ניתן למדוד קצב.
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – د” التي تليها (سؤال إلزاميّ – 20 درجة).
ثاني أكسيد الكربون: من ناتج غير مرغوب فيه إلى مادّة خامة مستقبليّة
يؤدّي احترار الأرض)ارتفاع درجة الحرارة العالميّة( إلى تغييرات مناخيّة، وهو أحد المشاكل التي تواجهها البشريّة في القرن الحاليّ. أحد عوامل احترار الأرض هو ارتفاع تركيز غاز ثاني أكسيد الكربون، CO2(g)، في الغلاف الجوّيّ، الذي يساهم في ارتفاع معدّل درجات الحرارة على سطح الكرة الأرضيّة. ارتفاع تركيز CO2(g) في الغلاف الجوّيّ هو من ضمن نتائج أخرى، نتيجة حرق الفحم، C(s)، بكمّيّات متزايدة واستعمال الوقود الهيدروكربونيّ لتزويد الطاقة.
يُطالَب العلماء وأرباب الصناعة والحكومات بإيجاد حلول من أجل تقليصكمّيّة CO2(g) التي تنطلق إلى الغلاف الجوّيّ.
أحد الحلول، الذي يُطبَّق في الوقت الحاضر، هو استعمال مصادر طاقة متجدِّدة (كالشمس والرياح) بدلاً من استعمال الفحم والوقود الهيدروكربونيّ.
يُدرَس في السنوات الأخيرة توجّه ثوريّ ورياديّ لا يَعتبر CO2(g) ناتجًا غير مرغوب فيه، وإنّما يَعتبره مادّة خامة ومصدرًا لذرّات الكربون في الصناعة الكيماويّة. الهدف هو استيعاب CO2(g) الذي ينطلق في عمليّات الحرق، خاصّةً في محطّات توليد الكهرباء، واستغلاله لإنتاج مركَّبات كربون متنوّعة تُنتَج اليوم من مركَّبات النفط الخام الآخذ في الفناء.
التخطيط 1 يعرضجزءًا من مركَّبات الكربون التي يمكن إنتاجها من CO2(g):
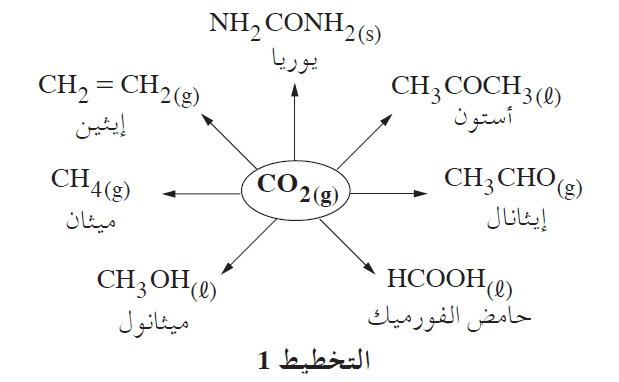
من هذه المركَّبات، يمكن إنتاج موادّ كثيرة تُستعمَل وقودًا أو موادّ خامة في الصناعة الكيماويّة.
استغلال CO2(g) كمادّة خامة يتطلّب مواجهة صعوبتين أساسيّتين:
- فصل CO2(g) عن الغازات الأخرى التي تنطلق من مداخن محطّات توليد الكهرباء.
- بذل طاقة كبيرة تلزم خلال إنتاج هذه المركَّبات.
إيجاد حلول لهاتين الصعوبتين يشكّل تحدّيًا أمام علماء الكيمياء والعلماء الآخرين.
ا لمصدر: Clarke J. (2017), “Carbon dioxide can be a Versatikix feedstock for a variety of undustries” , Chemistry World
- السولار هو وقود هيدروكربونيّ يُستعمَل في محطّات توليد الكهرباء.
الهيدروكربون C12H26(ℓ) هو أحد مركِّبات السولار.- حسب القطعة، حدِّد هل تفاعل إنتاج CO2(g) من وقود هيدروكربونيّ هو إكسوثيرميّ أم إندوثيرميّ. علّل.
תגובה אקסותרמית, משריפת הדלקים הפחמימניים מספקים אנרגייה (על פי המאמר). - اكتب معادلة موازَنة للتفاعل الذي يَنتُج فيه CO2(g) من الهيدروكربون C12H26(ℓ).
C12H26(ℓ) + 18.5O2(g) →12CO2(g) + 13H2O(ℓ)
- حسب القطعة، حدِّد هل تفاعل إنتاج CO2(g) من وقود هيدروكربونيّ هو إكسوثيرميّ أم إندوثيرميّ. علّل.
- ב
- اختر أربعة من المركَّبات التي يمكن إنتاجها من CO2(g)، المعروضة في التخطيط 1.
انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
* השלמנו עבור 6 תרכובות בשאלה צריך לבחור רק 4اسم المركَّب صيغة المجموعة الوظيفيّة اسم المجموعة الوظيفيّة 1 אתן 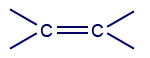
קשר כפול בין אטומי פחמן (אלקן) 2 אצטון 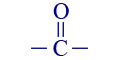
או: –CO–
קטון 3 אתאנאל 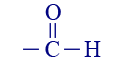
או : CHO–
אלדהיד 4 חומצה מתאנואית 
או: COOH–
חומצה קרבוקסילית 5 מתאנול –OH כוהל
או: הידרוקסיל
6 אוריאה 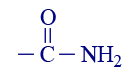
או: CONH2–
אמיד - التخطيط 1 يعرضثلاثة مركَّبات هي في حالة سائلة في درجة حرارة الغرفة.
أحد هذه المركَّبات الثلاثة هو حامضالفورميك.
درجة حرارة غليان حامضالفورميك أعلى من درجة حرارة غليان المركَّبين الآخرين.
فسّر هذه الحقيقة. تطرّق في إجابتك إلى القوى التي تعمل بين الجزيئات في كلّ واحد من المركَّبات
الثلاثة.
שלושת החומרים הם חומרים מולקולריים.
בין מולקולות האצטון ישנו רק אינטראקציות ון־דר־ולס.
בין מולקולות המתאנול ישנן אינטראקציות ון־דר־ולס וקשרי מימן.
בין מולקולות החומצה המתאנואית יש אינטראצקיות ון־דר־ולס וקשרי מימן.
מכיוון שלמולקולת חומצה מתאנואית יש יותר מוקדים ליצירת קשרי מימן בין המולקולות שלה מאשר למולקולת מתאנול, הקשרים הבין מולקולריים בין מולקולות החומצה המתנואית חזקים מהקשרים שבין מולוקולות המתאנול ולכן נדרשת אנרגייה רבה יותר לניתוק הקשרים בין מולקולות החומצה המתאנואית וטמפרטורת הרתיחה שלה גבוהה יותר.
הקשרים הקיימים בין מולקולות החומצה המתאנואית חזקים מאינטראקציות הון־דר־ולס שיישנן בין מולקולות האצטון ולכן טמפרטורת הרתיחה של החומצה האתאנואית גבוהה מזו של האצטון.
- اختر أربعة من المركَّبات التي يمكن إنتاجها من CO2(g)، المعروضة في التخطيط 1.
- ג
- لإنتاج الميثانول، CH3OH(ℓ)، من CO2(g) هناك حاجة لمادّة إضافيّة.
حدِّد هل المادّة الإضافيّة في هذا التفاعل تَتَفاعل كمُؤكسِد أم كمُختزِل. علّل.
יש להוסיף חומר מחזר כי אטומי הפחמן (C) בתגובה זו יורדים בדרגת החמצון מ- 4+ ל- 2-, עוברים תהליך חיזור (הם מקבלים ‾e) ולכן יש להוסיף חומר שיעבור את תהליך חמצון, זאת אומרת חומר מחזר.
אטומי הפחמן (C) בתגובה זו יורדים בדרגת החמצון מ- 4+ ל- 2-, עוברים תהליך חיזור (הם מקבלים ‾e) ולכן יש להוסיף חומר שיעבור את תהליך חמצון, זאת אומרת חומר מחזר. - يحدث هذا التفاعل على سطح محفِّز خاصّمركَّب من معدنَي الپالاديوم، Pd(s)، والنحاس، Cu(s)، في درجة حرارة بين 180°C وَ 250°C.
קوتيرة التفاعل هي أسرع بوجود المحفِّز. فسّر هذه الحقيقة بمساعدة نظريّة التصادمات.
בנוכחות זרז התגובה מתרחשת במנגנון שבו לתגובה יש אנרגיית שפעול קטנה יותר (לעומת תגובה המתרחשת ללא זרז) ולכן ליותר מולקולות מגיבים יש מספיק אנרגייה כדי לעבור בזמן ההתנגשות ביניהם את מחסום אנרגיית השפעול (ליצור יותר תצמידים משופעלים) ליחידת זמן ולכן קצב התגובה גדל.
- لإنتاج الميثانول، CH3OH(ℓ)، من CO2(g) هناك حاجة لمادّة إضافيّة.
- حسب القطعة، اذكر إيجابيّتين لاستغلال CO2(g) الذي ينطلق إلى الغلاف الجوّيّ من أجل إنتاج مركَّبات كربون متنوّعة.
תשובה- הפחתת כמות ה- CO2(g) שקיים באטמוספרה ובכך הקטנת הזיהום ואפקט החממה.
- ניתן לייצר חומרים רבים המשמשים כדלקים.
- ניצול הפחמן הדו־חמצני לייצור מגוון תרכובות פחמן אחרות הנוצרות כיום מנפט גולמי, ובכך להקטין את התלות בנפט הגולמי.
(מספיק 2 מתוך ה-3)
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 14-10 (لكلّ سؤال 20 درجة).
10. مبنى الذرّة، الدوريّة، المبنى والترابط
الهاتف الذكيّ يحوي موادّ فيها أكثر من 70 عنصرًا: فلزّات ولافلزّات وعناصر شائعة وعناصر نادرة.
- المركِّبات الأساسيّة في زجاج شاشة الهاتف الذكيّ هي: ثاني أكسيد السيليكون، SiO2(s)، وأكسيد الصوديوم، Na2O(s) ، وأكسيد الألومنيوم، Aℓ2O3(s).
- انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
SiO2(s) Aℓ2O3(s) نوع الجسيمات في المادّة אטומי O, Si יוני Aℓ3+ ו- O2- نوع الأربطة بين الجسيمات קשר קוולנטי קשר יוני - اكتب صِيَغ تمثيل إلكترونيّة للجسيمات التي يتركّب منها المركَّب Na2O(s).
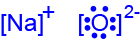
- من أجل تقوية زجاج الشاشة، يستبدلون قسمًا من أيونات الصوديوم بأيونات أكبر.
لهذا الغرضيغمسون زجاج الشاشة في مركَّب أيونيّ منصهر ملائم.
حدِّد أيّ مركَّب يلائم هذه العمليّة: نترات الليثيوم، LiNO3(ℓ)، أم نترات البوتاسيوم، KNO3(ℓ). علّل تحديدك.
אשלגן חנקתי היא התרכובת המתאימה לתהליך זה כי יוני +K גדולים יותר מיוני +Na. ליוני +K יש יותר רמות אנרגייה מאוכלסות באלקטרונים (רדיוס גדול יותר) מאשר ליוני +Na, לכן יוני האשלגן גדולים יותר.
- انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
- شاشة اللَّمس، الموجودة تحت الزجاج، مبنيّة من طبقة شفّافة من أكسيد الإينديوم، In2O3(s) وموادّ إضافيّة.
النظير الشائع للإينديوم هو .ما هو عدد الپروتونات وعدد النيوترونات وعدد الإلكترونات في جسيمات الإينديوم في المركَّب 115In2O3(s)؟
In2O3(s)
מכיוון שהחמצן בחומר היוני הוא O2- אז יון ה- In יהיה בעל מטען In3+.
לכן, ליון זה יש:- 49 פרוטונים.
- 46 אלקטרונים.
- 66 נויטרונים.
- الرقاقة (الشريحة) الإلكترونيّة مبنيّة من سيليكون، Si(s)، بإضافة ذرّات عناصر مثل: الفوسفور، 15P، أو الچاليوم، 31Ga، أو الأرسين، 33As.
- طاقة التأيّن الأولى للسيليكون، Si، هي 789kJ⁄moℓ.
طاقة التأيّن الأولى للفوسفور، P، هي 1012kJ⁄moℓ.
فسّر لماذا طاقة التأيّن الأولى للفوسفور، P، أعلى من طاقة التأيّن الأولى للسيليكون، Si.
שני היסודות נמצאים באותה השורה (מחזור) בטבלה המחזורית. לשניהם אותו מספר של רמות אנרגייה מאוכלסות באלקטרונים.
לאטום הזרחן יותר פרוטונים בגרעין מאשר לאטום הצורן ולכן המשיכה החשמלית בין הגרעין לאלקטרוני הערכיות חזקה יותר ונדרשת אנרגייה רבה יותר להוצאת האלקטרון. - أمامك قيمتان لطاقتَي تأيّن 947kJ⁄moℓ وَ 1251kJ⁄moℓ.
ما هي القيمة التي تلائم طاقة التأيّن الأولى للأرسين، As؟ علّل.
הערך 947kJ⁄moℓ הוא כי לאטום As יש יותר רמות אנרגייה מאוכלסות ב- ‾e (רדיוס גדול יותר).
ככל שהמרחק בין הגרעין לאלקטרוני הערכיות גדול יותר, המשיכה החשמלית קטנה יותר ולכן צריך פחות אנרגייה להוצאת ה- ‾e.
- طاقة التأيّن الأولى للسيليكون، Si، هي 789kJ⁄moℓ.
- بطّاريّة الهواتف الذكيّة تحوي، من ضمن موادّ أخرى، چرافيت، C(s).
- اكتب ثلاثة مميّزات للمبنى الميكروسكوبيّ للچرافيت.
תשובה- לאטומים תנועת תנודה.
- קשרים קוולנטיים חזקים בין האטומים.
- הגרפיט בנוי במבנה ענק של שכבות.
- בכל שכבה, כל אטום פחמן קשור בקשרים קוולנטיים לשלושה אטומי פחמן.
- לכל אטום פחמן נותר אלקטרון אחד לא מזווג, האלקטרונים הלא מזווגים של כל אטומי הפחמן בשכבה נעים בחופשיות בשכבה.
(מספיק לציין 3 מאפיינים)
- الچرافيت موصِل للتيّار الكهربائيّ. فسّر لماذا.
לגרפיט ‾e ניידים ולכן יש לגרפיט מוליכות חשמלית במצב מוצק.
- اكتب ثلاثة مميّزات للمبنى الميكروسكوبيّ للچرافيت.
11. كيمياء الغذاء والطاقة
الزبدة هي منتَج غنيّ بالدهن، تُنتَج من الحليب أو من الشَّمِينِتْ في عمليّة تُسمّى مَخْضًا.
- يُزوِّد الدهن %99.4 من القيمة الكالوريّة (السعريّة) للزبدة..
القيمة الكالوريّة لِ 100 غرام زبدة هي 733 كيلو – كالوري.
معطى أنّ: القيمة الكالوريّة لِ 1 غرام دهن هي 9 كيلو – كالوري.
احسب كم غرام دهن يوجد في 100 غرام زبدة. فصّل حساباتك.
קילו-קלוריות 733 × 99.4⁄100 = 728.602
وجد العلماء أنّ الزبدة تحوي أكثر من 200 نوع من التريچليسيريدات.
أمامك جدول يعرضالأحماضالدهنيّة الأساسيّة التي تُركِّب التريچليسيريدات في الزبدة.
| الحامض الدهنيّ | الرمز | كتابة مختصرة للحامض الدهنيّ | النسبة المئويّة |
| حامضالميريستيك | M | C14:0 | 12% |
| حامضالپلاميتيك | P | C16:0 | 26% |
| حامضالستاريك | S | C18:0 | 11% |
| حامضالأولييك | O | C18:1ω9 , cis | 28% |
- عندما نُخرِج الزبدة من الث لا لاجة، فإنّها تَطْرى في درجة حرارة الغرفة ويمكن دهنها بسهولة.
أمامك قائمة لتريچليسيريدات موجودة في الزبدة:
MOO , SPS , SPM , MPO , SPP , POO
ثلاثة من التريچليسيريدات التي في القائمة تجعل الزبدة تَطْرى في درجة حرارة الغرفة.
حدِّد ما هي هذه التريچليسيريدات الثلاثة. فسّر لماذا تجعل هذه التريچليسيريدات الزبدة تَطْرى.
תשובה:
MOO , MPO , POO
בשלושת הטריגליצרידים הללו יש שרשרת פחמימנית שמקורה בחומצת שומן לא רוויה. קיום קשר כפול גורם לכיפוף במבנה המולקולה ולא מאפשר / מקטין את היכולת ליצור אריזה צפופה בין המולקולות ולכן אינטראקציות הון־דר־ולס בין המולקולות הללו חלשות יותר וצריך פחות אנרגייה כדי להפריד ביניהם. - حامضالبوتيريك، C4:0، هو مركِّب نسبته المئويّة قليلة في تريچليسيريدات الزبدة.
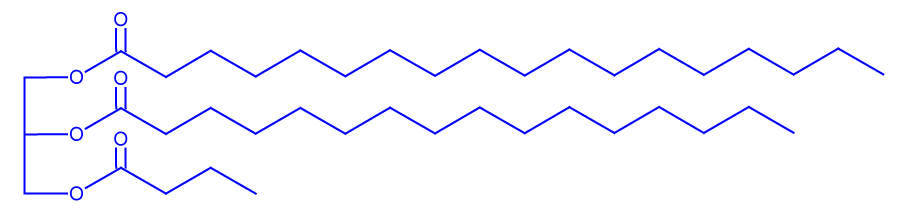
عندما تتلف الزبدة، بسبب حلمأة هذه التريچليسيريدات، يَنتُج حامضالبوتيريك الذي ينشر رائحة كريهة.- التريچليسيريد SPB هو أحد التريچليسيريدات المركَّب من حامضالبوتيريك أيضًا.
الحرف B هو رمز حامضالبوتيريك.
اكتب تمثيلاً مختصرًا للصيغة البنائيّة للتريچليسيريد SPB.
معطى التمثيل المختصر للصيغة البنائيّة لجزيء چليسيرول: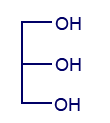
- التأثيرات المتبادلة التي بين جزيئات التريچليسيريد SPB أضعف من التأثيرات المتبادلة التي بين جزيئات التريچليسيريد SPP. اذكر ما هو سبب ذلك.
ענן אלקטרונים קטן יותר בטריגליצריד SPB, כי לחומצה הבוטירית יש פחות אטומי פחמן מאשר לחומצה הפלמיטית, לכן אינטראקציות הון־דר־ולס בין המולקולות של הטריגליצריד SPB חלשות יותר.
- التريچليسيريد SPB هو أحد التريچليسيريدات المركَّب من حامضالبوتيريك أيضًا.
- الأحماضالدهنيّة، التي على شكل تريچليسيريدات، تُخزَن في الجسم في خلايا دهنيّة وتُستعمَل، من ضمن בין استعمالات أخرى، مصدرًا للطاقة.
تمرّ الأحماضالدهنيّة التي في الخلايا بسلسلة عمليّات يَنتُج فيها ثاني أكسيد الكربون، CO2(g)، وماء، H2O(ℓ)، كما يحدث في تفاعل الحرق الكامل لمركَّبات الكربون.
التفاعل (1) الذي أمامك هو تفاعل حرق حامضالبوتيريك:(1) C3H7COOH(ℓ) + 5O2(g) → 4CO2(g) + 4H2O(ℓ) ΔH0(1)=?
معطاة ثلاثة تفاعلات، I-III:
I. C(s) + O2(g) → CO2(g) ΔH0(I)=-393.5kJ
II. H2(g) + 1⁄2O2(g) → H2O(ℓ) ΔH0(II)=-286.0kJ
III. 4C(s) + 4H2(g) + O2(g) → C3H7COOH(ℓ) ΔH0(III)=-534.0kJاستعن بهذه المعطيات، واحسب قيمة ΔH0(1) . فصّل حساباتك.
תשובה
תגובה I כפול 4
תגובה II כפול 4
תגובה III כפול 1-I.
4C(s)+ 4O2(g) → 4CO2(g) ΔH0(I)=-1574kJ
II.4H2(g)+2O2(g) → 4H2O(ℓ) ΔH0(II)=1144kJ
III. C3H7COOH(ℓ) →4C(s)+4H2(g)+O2(g)ΔH0(III)=-534.0kJC3H7COOH(ℓ) + 5O2(g) → 4CO2(g) + 4H2O(ℓ) ΔH0 = -2184kJ
- أجروا في المختبر التفاعل (2) الذي أمامك:
(2) C3H7COOH(g) + 5O2(g) → 4CO2(g) + 4H2O(g) ΔH0(2)=-2,065.6kJ
الجدول الذي أمامك يعرضقيَم إنتالبيات رباط.
الرباط O–H
(في جزيئات H2O)C=O
(في جزيئات CO2)إنتالبيا الرباط (kJ⁄moℓ) 463 803 احسب كمّيّة الطاقة التي يجب بذلها من أجل فكّ جميع الأربطة التساهميّة (الكوڤلنتيّة) في الموادّ المتفاعِلة في تفاعل 1 مول C3H7COOH(g). فصّل حساباتك.
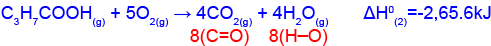
-2065.6 = X – (8×803 + 8×463)
X=8062.4kJ
12. الحسابات الكيميائيّة
معدن المغنيسيوم، Mg(s)، يُستعمَل أساسًا في صناعة السيّارات والطيران. في أغلب الأحيان، يستعملون سبائك لِ Mg(s) مع الألومنيوم، Aℓ(s)، لكنّهم، في بعضالأحيان، يُضيفون إلى السبيكة كمّيّات ضئيلة من معادن أخرى، مثل التيتانيوم، Ti(s) (العدد الذرّيّ للتيتانيوم هو 22).
- في 1 كغم من إحدى سبائك المغنيسيوم يوجد 0.1 غرام Ti(s) .
احسب كم ذرّة Ti توجد في 1 كغم من هذه السبيكة. فصّل حساباتك.
معطى أنّه: في مول واحد جسيمات يوجد 6.02×1023 جسيم.
N = n × NA = 2.08×10-3 × 6.02×1023 = 1.25×1021אטומים
في أواخر القرن العشرين، أُقيم في سْدُوم مصنع لإنتاج المعدن Mg(s)، من أجل استغلال التركيز العالي لأيونات المغنيسيوم، Mg2+(aq)، في مياه البحر الميّت.
- تركيز أيونات Mg2+(aq) تركيز أيونات 39.2 غرام في اللتر.
احسب التركيز المولاريّ لأيونات Mg2+(aq) في مياه البحر الميّت. فصّل حساباتك.
39.2ג’………………..1 ליטר
- يُنتِجون من مياه البحر الميّت خليطًا يُسمّى كرنليت، الذي أحد مركِّباته هو كلوريد المغنيسيوم، MgCℓ2(s).
في إحدى مراحل إنتاج Mg(s) يَصْهَرون الكرنليت في درجة حرارة 700°C ويُمرِّرون عبره تيّارًا
كهربائيًّا.
في هذه الشروط يحدث التفاعل (1):- فسّر لماذا يجب صَهْر الكرنليت قبل تمرير تيّار كهربائيّ عبره.
כדי להפיק את המגנזיום יש להעביר דרכו זרם חשמלי. מכיוון שמגנזיום כלורי הוא חומר יוני, במצב מוצק לא ניתן להעביר זרם חשמלי דרכו כי היונים לא ניידים, לכן יש להתיך את הקרנליט במצב מותך (נוזל) יש לחומר היוני יונים ניידים ולכן ניתן להעביר דרכו זרם חשמלי. - احسب حجم غاز Cℓ2(g) الذي يَنتُج أثناء إنتاج 1 طنّ Mg(s). فصّل حساباتك.
معطى أنّه: في 1 طنّ يوجد 1,000,000 غرام (1×106 غرام).
في شروط التفاعل، حجم 1 مول غاز هو 80 لترًا.Cℓ2(g) Mg(s) 1 : 1 יחס מולים 1000000 m (גרם) 24.3 Mw (גרם למול) 41152 41152 n (מול) 80 Vm (ליטר למול) 3292181 V (ליטר)
- فسّر لماذا يجب صَهْر الكرنليت قبل تمرير تيّار كهربائيّ عبره.
- جزء من Cℓ2(g) الذي يُنتَج في مصنع المغنيسيوم يُستعمَل لإنتاج البروم، Br2(ℓ).
يَدفقون غاز Cℓ2(g) إلى محلول يحوي أيونات بروم Br‾(aq) .
يحدث التفاعل (2).(2) Cℓ2(g) + 2Br‾(aq) → Br2(ℓ) + 2Cℓ ‾(aq)
تركيز أيونات Br‾(aq) في المحلول الذي يُستعمَل لإنتاج Br2(ℓ) هو 0.125M.
احسب حجم المحلول اللازم لإنتاج 1,000 مول Br2(ℓ) . فصّل حساباتك.Br‾(aq) Br2(ℓ) 2 : 1 יחס מולים 2000 1000 n (מול) 0.125 0.5 (M) C 16000 0.05 V (ליטר) - أجروا في المختبر تجربة لإنتاج بروم حسب التفاعل (2).
دَفقوا غاز Cℓ2(g) إلى 100 ملل محلول يحوي أيونات Br‾(aq) بتركيز 0.5M. تفاعلت الموادّ بالكامل.- احسب كتلة Br2(ℓ) الذي نتج. فصّل حساباتك.
Br2(ℓ) Br‾(aq) 1 : 2 יחס מולים 0.1 V (ליטר) 0.5 (M) C 0.025 0.05 n (מול) 159.8 Mw (גרם למול) 3.995 m (גרם) - احسب حجم غاز Cℓ2(g) الذي تَفاعَلَ. فصّل حساباتك.
معطى أنّه: في شروط التجربة، حجم 1 مول غاز هو 25 لترًا.Cℓ2(g) Br2(ℓ) 1 : 1 יחס מולים 0.025 0.025 n (מול) 25 Vm (ליטר למול) 0.625 V (ליטר)
- احسب كتلة Br2(ℓ) الذي نتج. فصّل حساباتك.
13. الأكسدة – الاختزال
يتناول السؤال القدرة النسبيّة لمعادن معيّنة على الاختزال والقدرة النسبيّة لأيونات مميَّئة على الأكسدة.
أمامك قائمة لأيونات معدنيّة مميَّئة:
Cu2+(aq) , Ag+(aq) , Fb2+(aq) , Zn2+(aq)
- أجروا في المختبر تجربة في مرحلتين.
في المرحلة الأولى غمسوا شريط نحاس، Cu(s)، في كأس تحوي محلولاً عديم اللون لنترات الفضّة، AgNO3(aq) .
في التفاعل الذي حدث، تفاعلت كلّ أيونات الفضّة Ag+(aq) .
تغيّر لون المحلول إلى أزرق فاتح، ونتج في قاع الكأس راسب رماديّ.- اكتب معادلة صافية موازَنة للتفاعل الذي حدث في المرحلة الأولى من التجربة.
Cu(s) + 2Ag+(aq) → 2Ag(s) + Cu2+(aq)
في المرحلة الثانية، بعد انتهاء التفاعل الذي حدث في المرحلة الأولى، فصلوا الراسب الرماديّ عن المحلول.
بعد ذلك غمسوا شريط خارصين، Zn(s)، في المحلول. حدث تفاعل.
نتج محلول عديم اللون وراسب لونه بنّيّ – أحمر.- اكتب معادلة صافية موازَنة للتفاعل الذي حدث في المرحلة الثانية من التجربة.
Zn(s) + Cu+2(aq) → Zn2+(aq) + Cu(s)
- رتِّب المعادن: نحاس، Cu(s)، وفضّة، Ag(s)، وخارصين، Zn(s)، حسب قدرتها النسبيّة على الاختزال من العالي إلى المنخفض.
علّل إجابتك حسب نتائج مرحلتَي التجربة.Zn(s) > Cu(s) > Ag(s)
בתגובה הראשונה המתכת Cu(s) העבירה אלקטרונים ליוני Ag+(aq) ולכן ניתן לקבוע שהיא מחזרת טובה יותר מאשר המתכת Ag(s) .
בתגובה השנייה המתכת Zn(s) העבירה אלקטרונים Cu2+(aq) ליוני ולכן ניתן לקבוע שהיא מחזרת טובה יותר מאשר המתכת Cu(s) .
- اكتب معادلة صافية موازَنة للتفاعل الذي حدث في المرحلة الأولى من التجربة.
- المعادن المُعرَّضة للبيئة تمرّ بتآكل أحيانًا. لمنع التآكل يتّخذون وسائل حماية مختلفة.
- من أجل منع التآكل، يَطلون مواسير الحديد، Fe(s)، المطمورة في الأرضبخارصين، Zn(s) .
طَلْي مواسير الحديد بالنحاس، Cu(s)، لا يمنع تآكل الحديد.
حدِّد أيّ معدن، Cu(s) أم Zn(s)، هو مادّة مختزِلة أفضل من Fe(s). علّل تحديدك.
המתכת אבץ Zn(s) היא מחזרת טובה יותר מאשר המתכת ברזל, היא מתחמצנת ולא הברזל ויוצרת שכבת הגנה (שכבת פאסיבציה תוצר החמצון לא מתפורר כמו חלודה) לברזל.
ניתן גם לומר שהמתכת אבץ היא מחזרת טובה יותר כי היא מתחמצנת ומונעת ממתכת הברזל להתחמצן ואילו הנחושת לא מונעת מהברזל להתחמצן. - تمثال الحرّيّة في نيويورك مبنيّ من أعمدة حديديّة موصولة بها ألواح نحاسيّة.
في نقاط التماسّ بين الأعمدة الحديديّة والألواح النحاسيّة يحدث تآكل.
فسّر لماذا يحدث تآكل في نقاط التماسّ هذه.
הנחושת לא מגנה על הברזל מפני קורוזיה, הנחושת היא מחזרת פחות טובה מהברזל, לכן הברזל עובר חמצון/קורוזיה ברווח שקיים ביניהם, שם הוא חשוף לסביבה.
(בנקודת החיבור המבנה המתכתי פגום כתוצאה מהחיבור ולכן שם נוצרת הקורוזיה. מכיוון שהברזל מחזר טוב יותר מהנחושת הוא מתחמצן.)
- من أجل منع التآكل، يَطلون مواسير الحديد، Fe(s)، المطمورة في الأرضبخارصين، Zn(s) .
- رتِّب الأيونات Fe2+(aq) وَ Cu2+(aq) وَ Ag+(aq) وَ Zn2+(aq)، حسب قدرتها النسبيّة على الأكسدة، من العالي إلى المنخفض.
اعتمد على المعلومات التي في البندين “أ” وَ “ب”.
Ag+(aq) > Cu2+(aq) > Fe2+(aq) > Zn2+(aq) - أيونات الهيدرونيوم، H3O+(aq)، يمكنها أن تتفاعل كمُؤكسِد..
عندما يغمسون شريط Fe(s) في محلول لحامضكلوريد الهيدروجين، HCℓ(aq)، يحدث التفاعل (1):(1) Fe(s) + 2H3O+(aq) → Fe2+(aq) + H2(g) + 2H2O(ℓ)
حدِّد أيّ أيون من الأيونَيْن، H3O+(aq) أم Fe2+(aq)، هو مُؤكسِد أفضل. علّل.
(הברזל פעל כמחזר בתגובה ועלה בדרגת החמצון ולכן הוא מחזר טוב יותר, יוני הברזל מחמצנים פחות טובים).
יוני H3O+(aq) הם מחמצן טוב יותר כי בתגובה אטומי H ביון H3O+(aq) קיבלו ‾e מה- Fe(s). אטומי ה- H שביוני ההידרוניום עברו תגובת חיזור ( פעלו כמחמצן).
14. الحوامض والقواعد والحسابات الكيميائيّة
في كلّ واحد من الوعاءين A وَ B يوجد 500 ملل ماء، H2O(ℓ).
إلى الوعاء A دَفقوا 100 ملل غاز بروميد الهيدروجين، HBr(g) .
إلى الوعاء B دَفقوا 100 ملل غاز أمونيا، NH3(g) .
- א
- اكتب معادلة التفاعل الذي حدث في الوعاء A ومعادلة التفاعل الذي حدث في الوعاء B.
HBr(g) + H2O(ℓ) → H3O+(aq) + Br ‾(aq)
NH3(g) + H2O(ℓ) → NH4+(aq) + OH ‾(aq) - حدِّد هل pH المحلول في كلّ واحد من الوعاءين A وَ B في نهاية التفاعل، كان أكبر من 7 أم أصغر من 7 أم يساوي 7. علّل.
ה- pH בתמיסה שבכלי A קטן מ- 7 כי יש עודף יוני H3O+(aq) בתמיסה.
ה- pH בתמיסה שבכלי B גדול מ- 7 כי יש עודף יוני OH‾(aq) בתמיסה. - احسب التركيز المولاريّ للمحلول الذي نتج في الوعاء A . فصّل حساباتك.
معطى أنّه: في شروط التفاعل، حجم 1 مول غاز هو 25 لترًا.HBr 0.1 V (ליטר) גז 25 Vm (ליטר למול) 0.004 n (מול) 0.5 V (ליטר) תמיסה 0.008 (M) C
- اكتب معادلة التفاعل الذي حدث في الوعاء A ومعادلة التفاعل الذي حدث في الوعاء B.
- إلى 100 ملل من المحلول الذي في الوعاء A ، أضافوا بالتدريج 900 ملل ماء، وقاسوا pH المحلول.
حدِّد أيّ رسم بيانيّ من الرسوم البيانيّة IV-I التي أمامك يصف صحيحًا التغيُّر في pH المحلول أثناء إضافة الماء. علّل.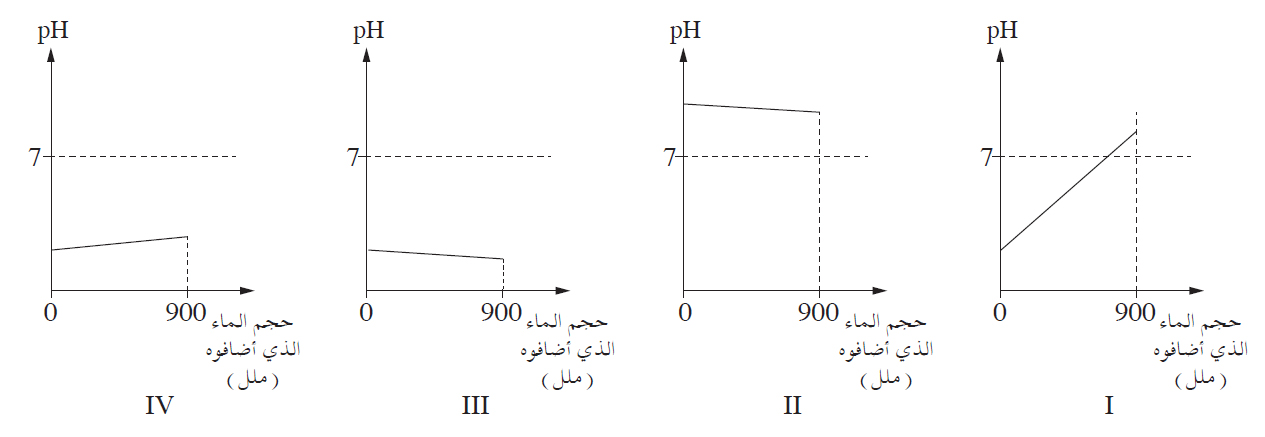
תשובה
גרף IV, כי בהוספת המים ריכוז יוני H3O+(aq) קטן ולכן ה- pH גדל אבל לא עובר את הערך 7 (התמיסה עדיין חומצית). - خلطوا 100 ملل من المحلول الذي في الوعاء A مع 20 ملل من محلول هيدروكسيد البوتاسيوم، KOH(aq).
حدث تفاعل. pH المحلول في نهاية التفاعل كان مساويًا لِ 7.- اكتب معادلة صافية للتفاعل الذي حدث.
H3O+(aq) + OH ‾(aq) → 2H2O(ℓ)
- احسب التركيز المولاريّ لمحلول KOH(aq). فصّل حساباتك وعلّل.
H3O+(aq) HBr(g) 1 : 1 יחס מולים 0.1 V (ליטר) 0.008 (M) C 0.0008 0.0008 n (מול) OH ‾(aq) H3O+(aq) 1 : 1 יחס מולים 0.0008 0.0008 n (מול) KOH(aq) OH ‾(aq) 1 : 1 יחס מולים 0.0008 0.0008 n (מול) 0.02 V (ליטר) 0.04 (M) C
- اكتب معادلة صافية للتفاعل الذي حدث.
- عندما يَتَماسّ غاز HBr(g) مع غاز NH3(g)، يحدث التفاعل:
HBr(g) + NH3(g) → NH4Br(s)
المادّة الصلبة بروميد الأمونيوم، NH4Br(s)، التي تَنتُج في هذا التفاعل تذوب جيّدًا في الماء.
حدِّد بالنسبة لكلّ واحد من القولين i وَ ii اللذين أمامك، إذا كان صحيحًا أم غير صحيح. علّل كلّ تحديد.- التفاعل بين HBr(g) وَ NH3(g) هو تفاعل حامض- قاعدة.
נכון. יש מעבר פרוטון מ- HBr(g) ל- NH3(g). - المحلول المائيّ لِ NH4Br(aq) موصِل للتيّار الكهربائيّ.
נכון. בתמיסה יש יונים ניידים.
- التفاعل بين HBr(g) وَ NH3(g) هو تفاعل حامض- قاعدة.
