التمثيل الكامل والتمثيل المختصر للصيغة البنائيّة
في هذا الدرس سنتعرّف على طريقة أخرى لوصف الجُزَيئات المختلفة التي نحصل عليها بواسطة الروابط التساهميّة (الكوفالنتيّة). سنتعلّم كيفيّة تمثيل الجُزَيئات المختلفة بكلّ الطرق التي تعلّمناها.
ونلخّص بذلك هذا القسم من فصل المبنى والترابط. لغاية الآن، تعرّفنا على التمثيلات التالية:
- الصيغة الجُزَيئيّة: الصيغة التي تشير إلى الذرّات التي تكوّن الجُزَيء وعددها.
- صيغة التمثيل الإلكترونيّ (المبنى/صيغة لويس): تصف ترتيب إلكترونات التكافؤ في مستوى الطاقة الأخير.
- الصيغة البنائيّة: تصف الروابط القائمة بين الذرّات في الجُزَيء.
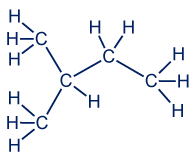
على سبيل المثال، جُزَيء الپروپان C3H8.
- الصيغة الجُزَيئيّة للپروپان هي: C3H8
- صيغة التمثيل الإلكترونيّ ستكون:

- الصيغة البنائيّة
تجدر الإشارة إلى أنّه يمكن كتابة الصيغة البنائيّة بطريقة مختلفة لتعطينا معلومات أكثر عن المبنى الفراغيّ للجُزَيء.
نكتب الصيغة البنائيّة للپروپان على النحو التالي:
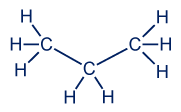
هذا هو التمثيل الكامل للصيغة البنائيّة لهذه المادّة.
نتذكّر ما تعلّمناه عن قطبيّة الجُزَيء. الذرّة المركزيّة التي ترتبط بأربع ذرّات أخرى، تكوّن حولها مبنى تتراهيدر (هرم رباعيّ). لذلك، توجد هنا ثلاثة تتراهدرات مدمجة مع بعضها البعض.
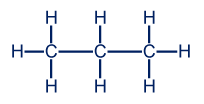
عمليًّا، كلّ تسلسل كربونيّ يبدو وكأنّه خطّ منكسر:
طريقة الكتابة الجديدة التي سنتعلّمها في هذا الدرس تسمّى التمثيل المختصر للصيغة البنائيّة.
نستخدم التمثيل المختصر للصيغة البنائيّة لوصف الجُزَيئات التي تحتوي بالأساس على ذرّات كربون وذرّات هيدروجين. التمثيل المختصر يصف هيكل مبنى المادّة. نمثّل كلّ ذرّة كربون بواسطة رأس أو طرف خطّ خارجيّ، بينما ذرّات الهيدروجين المرتبطة بذرّات الكربون لا تظهر في هذا التمثيل.
إذا أردنا أن نمثّل جُزَيء الپروپان، الذي رسمنا صيغته البنائيّة أعلاه، التمثيل المختصر للصيغة لصيغته البنائيّة سيبدو على النحو التالي: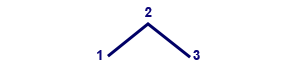 الأرقام تصف مكان ذرّات الكربون. لا حاجة لكتابة الأرقام فيما بعد. نذكّر أنّ الكربون يظهر على شكل رأس أو طرف خطّ خارجيّ في التمثيل المختصر.
الأرقام تصف مكان ذرّات الكربون. لا حاجة لكتابة الأرقام فيما بعد. نذكّر أنّ الكربون يظهر على شكل رأس أو طرف خطّ خارجيّ في التمثيل المختصر.
أمثلة
معطاة مادّة الهكسان: CH3CH2CH2CH2CH2CH3
- الصيغة الجُزَيئيّة للهكسان هي C6H14.
- يمكن كتابة صيغة الهكسان كالتالي:

أوّلًا، نشير إلى أنّه عند وجود مجموعات CH2 التي تظهر واحدةً تلو الأخرى في التركيبة الكيميائيّة، يمكن جمعها بين قوسين، كما فعلنا في مثال الهكسان.
ننتبه إلى وجود خطّ على القوسين، من اليمين ومن اليسار أيضًا. الخطّ يعني أنّ كلّ مجموعة CH2 مرتبطة بمجموعتَين، واحدة قبلها وأخرى بعدها.
يمكن أن نفهم ذلك من أنّ ذرّة الكربون تميل لتكوين أربعة روابط. نذكّر أنّ لديها أربعة إلكترونات في مستوى الطاقة الأخير، وينقصها أربعة إلكترونات، لذلك فهي تكوّن أربعة روابط تساهميّة (كوفالنتيّة). في مجموعة CH2 ذرّة الكربون مرتبطة بذرّتَيّ هيدروجين. لقد كوّنت رابطَين فرديَّين، لذلك ما زال ينقصها رابطَين إضافيَّين.
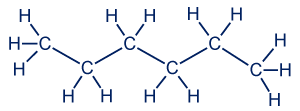
معطاة المادّة ثنائيّ ميثيل بوتان وصيغتها هي:

تجدر الإشارة إلى أنّه في صيغة المادّة تظهر مجموعات CH3 داخل أقواس كما في المثال أعلاه (ثنائيّ ميثيل بوتان)، وكلّ واحدة من مجموعات CH3 مرتبطة بنفس ذرّة الكربون، كما شرحنا بالنسبة لمجموعات CH2.
انتبهوا إلى أنّ هناك خطًّا واحدًا فقط على الأقواس، وهذا يعني أنّ مجموعة CH3 يجب أن تكوّن رابطًا واحدًا إضافيًّا. في مجموعة CH3 الكربون مرتبط بثلاث ذرّات هيدروجين، وينقصه رابط واحد فقط لإكمال المستوى الأخير.
معطى الجُزَيء التالي، بنتان عاديّ، وصيغته هي: CH3CH2CH2CH2CH3
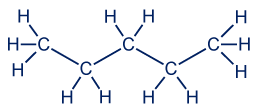
انتبهوا! للمادّتَين الأخيرتَين، ثنائيّ ميثيل بوتان والبنتان العاديّ، نفس الصيغة الجُزَيئيّة. لكن لهما صيغة بنائيّة مختلفة. هاتان المادّتان تسمّيان إيزوميرات.
الإيزوميرات هي موادّ لها نفس الصيغة الجُزَيئيّة لكن صيغتها البنائيّة مختلفة. في الإيزوميرات، الترتيب الذي ترتبط به الذرّات ببضعها مختلف، على الأقلّ في جزء منها.
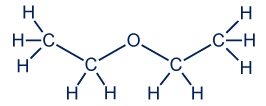
معطاة المادّة ثنائيّ إيثيل الأثير CH3CH2OCH2CH3.
الصيغة البنائيّة في هذا المثال تشمل ذرّة الأكسجين. هذه الذرّة تكوّن رابطَين فرديَّين في هذا الجُزَيء، لذلك فهي تكوّن مبنى زاوية.
الصيغة الجُزَيئيّة هي C4H10O.
الصيغة البنائيّة في هذا المثال تشمل ذرّة الأكسجين. هذه الذرّة تكوّن رابطَين فرديَّين في هذا الجُزَيء، لذلك فهي تكوّن مبنى زاوية.
التمثيل الكامل للصيغة البنائيّة للمادّة هو:
التمثيل المختصر للصيغة البنائيّة هو:
![]()
انتبهوا! في التمثيل المُختصر للصيغة البنائيّة، نكتب ذرّة الأكسجين. كلّ رأس وطرف خطّ خارجيّ يمثّل ذرّة كربون، وذرّات الهيدروجين لا تظهر.
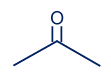
معطاة مادّة الأستون: CH3COCH3
ننتبه إلى أنّه في هذا الجُزَيء يوجد رابط زوجيّ بين الكربون والأكسجين، وإلّا لن تتحقّق قاعدة الأوكتيت لذرّة الكربون الوسطى. بالرغم من أنّ الأكسجين والكربون مكتوبان بالتسلسل، إلّا أنّ الأكسجين لا يرتبط بذرّتَيّ كربون. الأكسجين مرتبط برابط زوجيّ بالذرّة الموجودة على يساره.
ننتبه إلى أنّه في هذا الجُزَيء يوجد رابط زوجيّ بين الكربون والأكسجين، وإلّا لن تتحقّق قاعدة الأوكتيت لذرّة الكربون الوسطى. بالرغم من أنّ الأكسجين والكربون مكتوبان بالتسلسل، الأكسجين غير مرتبط بذرّتَيّ كربون. الأكسجين مرتبط برابط زوجيّ بالذرّة الموجودة على يساره.
لذلك، التمثيل الكامل للصيغة البنائيّة للأستون تبدو كالتالي:
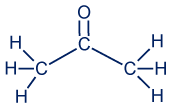
الصيغة الجُزَيئيّة هي: C3H6O
سنرى الآن تمرينًا عكسيًّا
معطى التمثيل المختصر للصيغة البنائيّة للميثيل سيكلو هكسان:
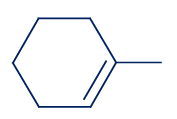
لأوّل مرّة نرى مبنى فيه ذرّات الكربون (الرؤوس) لا تظهر بتسلسل، بل تكوّن مبنى حلقيّ (سيكلو). هناك موادّ كثيرة كهذه.
تبدأ عمليّة البناء بأن تظهر في كلّ رأس في الصيغة البنائيّة المختصرة ذرّة كربون:
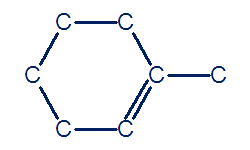
في المرحلة الثانية، يجب أن نضيف لكلّ ذرّة كربون عدّة ذرّات هيدروجين بروابط فرديّة، بحيث تكمل عدد الروابط لكلّ ذرّة كربون إلى أربعة روابط. على النحو التالي:
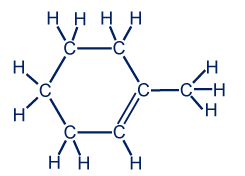
إذا عددنا جيدًا ولم نخطئ، سنكتشف أنّ الصيغة الجُزَيئيّة هي C7H12.
لهذا الجُزَيء مبنى فراغيّ طبعًا، لكن لا يُطلَب منّا أن نرسم مبناه الدقيق.
هذه الطريقة لكتابة الصيغة البنائيّة للجُزَيء توفّر معلومات أكثر عن مبناه الفراغيّ. شاشة الحاسوب أو الأوراق هي ثنائيّة الأبعاد وليست ثلاثيّة الأبعاد/فراغيّة.
الآن، سنرى تمرينًا يشمل ما تعلّمناه في الدروس الأخيرة، من بداية موضوع الرابط التساهميّ (الكوفالنتيّ).
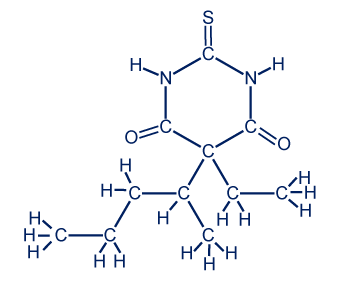
- المادّة ثيوبنتال (Thiopental) تُستخدَم كأساس لصنع مادّة تسمّى مصل الحقيقة.
معطة التمثيل المختصر للصيغة البنائيّة للمادّة: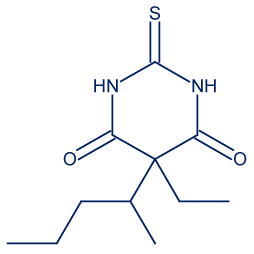 أجيبوا عن الأسئلة التالية:
أجيبوا عن الأسئلة التالية:
C11H18N2O2S
C—C , C—H , C—N , N—H , C═O , C═S

الرابط N—H أقوى من الرابط C—H لأنّ نصف قُطر ذرّة النيتروجين N أصغر من نصف قُطر ذرّة الكربون C، لذلك البُعد بين الأنوية وبين الإلكترونات الرابطة في الرابط N—H أصغر من الرابط C—H. إضافةً لذلك، الرابط أكثر قطبيّةً لأنّ الفرق في قيَم السالبيّة الكهربائيّة في الرابط N—H أكبر.
الرابط C═O أقصر لأنّ نصف قُطر ذرّة الأكسجين (O) أصغر من نصف قُطر ذرّة الكبريت (S). لذرّة الأكسجين عدد أقلّ من مستويات الطاقة المعبّأة بالإلكترونات. كما وأنّ الفرق في قيَم السالبيّة الكهربائيّة في الرابط C═O أكبر، لذلك الرابط أكثر قطبيّةً.