قوّة الرابط التساهميّ (الكوفالنتيّ)
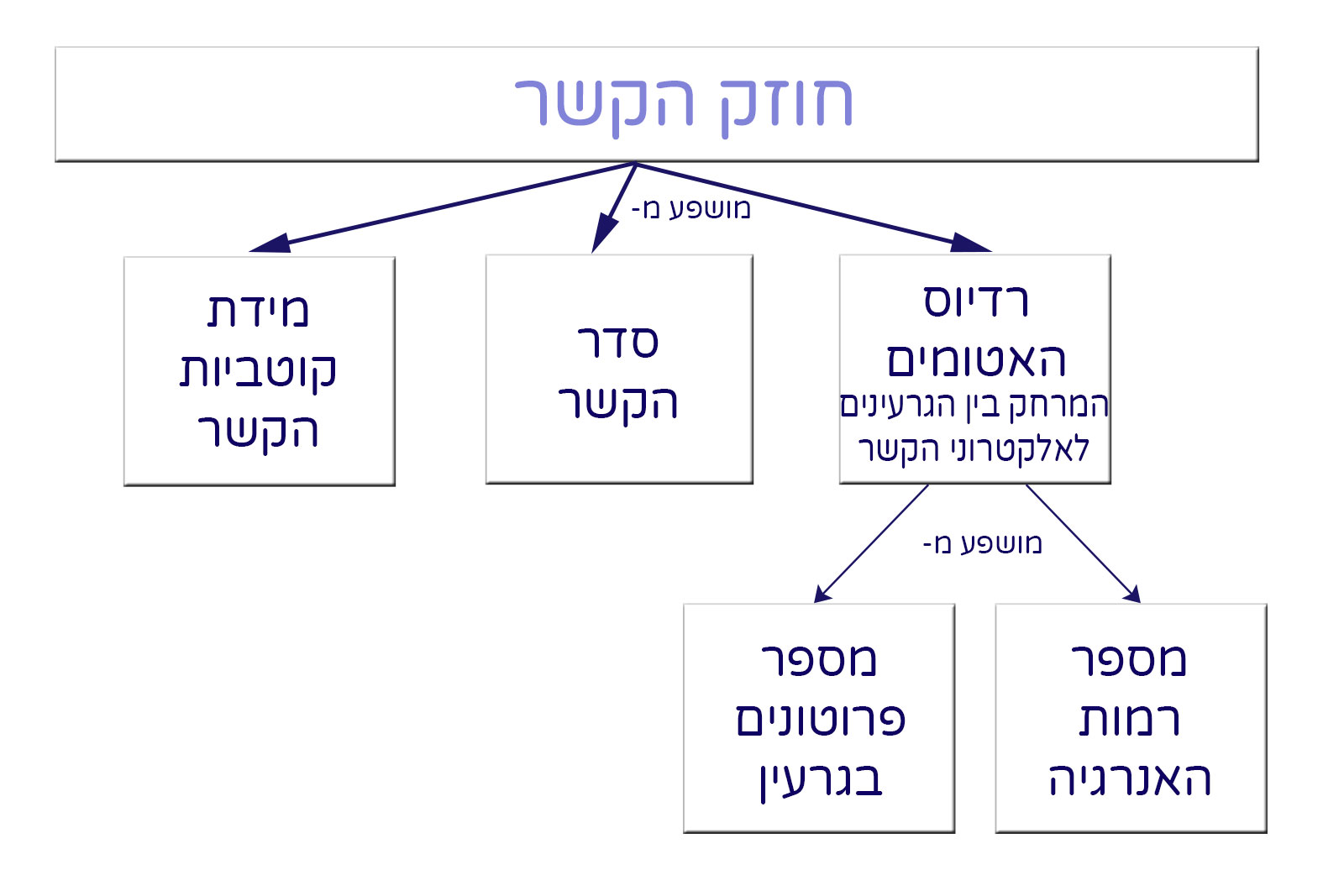
لغاية الآن، تحدّثنا عن تكوين الرابط التساهميّ (الكوفالنتيّ). تعرّفنا على المصطلحات التالية:
الرابط التساهميّ الفرديّ، الزوجيّ والثلاثيّ، زوج/أزاوج الإلكترونات الرابطة (المشتركة)، زوج/أزواج الإلكترونات غير الرابطة (غير المشتركة)، الرابط النقيّ، الرابط غير القطبيّ (ثنائيّ القطب اللحظيّ)، الرابط القطبيّ (ثنائيّ القطب الثابت)، السالبيّة الكهربائيّة، الصيغة الجُزَيئيّة، صيغة التمثيل الإلكترونيّ (صيغة لويس/مبنى لويس)، المدار الذرّيّ (تعريف فقط)، المدار الجُزَيئيّ (تعريف فقط).
الآن، سنتحدّث عن قوّة الرابط التساهميّ وعن طوله. سنتحدّث أيضًا عن العلاقة بين مصطلح قوّة الرابط وطاقة الرابط.
الرابط التساهميّ (الكوفالنتيّ) هو رابط كيميائيّ يتكوّن عندما ينجذب زوج/أزواج إلكترونات مشتركة ذات شحنة سالبة لأنوية الذرّات الموجبة (بسبب البروتونات داخلها) المشاركة في الرابط.
بحسب قانون كولوم، التجاذُب الكهربائيّ متعلّق بـ:
- البُعد بين الشحنات الكهربائيّة؛
- كِبَرالشحنات الكهربائيّة.
كلما كان الرابط التساهميّ أقوى، ازدادت الطاقة المطلوبة لتفكيكه (طاقة الرابط).
العوامل التي تؤثّر على قوّة الرابط التساهميّ
العامل الأول المؤثر هو البُعد بين الإلكترونات الرابطة والأنوية. يتأثر البُعد بنصف قُطر الذرات المرتبطة برابط تساهميّ، ونصف قُطر الذرّات متعلّق بـ:
كلّما زاد عدد مستويات الطاقة، زاد نصف قُطر الذرّة، والعكس صحيح.
كلّما زاد عدد البروتونات في النواة، تكون قوّة جذب النواة أكبر ونصف قُطر الذرّة أصغر، والعكس صحيح (من المفضّل التطرّق إلى عدد البروتونات عندما يكون عدد مستويات الطاقة للذرّات في الرابط التساهميّ متساويًا).
كلّما كان مجموع أنصاف أقطار الذرّات المرتبطة برابط تساهميّ أكبر، تكون قوّة التجاذُب بين الأنوية وزوج أو أزواج الإلكترونات المشتركة أضعف، ويكون الرابط أضعف أيضًا، والعكس صحيح، كلّما كان مجموع أنصاف أقطار الذرّات المرتبطة برابط تساهميّ أصغر، تكون قوّة التجاذُب بين الأنوية والإلكترونات المشتركة أكبر، ويكون الرابط أقوى.
عند فحص البُعد بين الإلكترونات المشتركة، الإلكترونات الرابطة، وبين الأنوية كعامل يؤثّر على قوّة الرابط، نفحص في المرحلة الأولى، عدد مستويات الطاقة.
- إذا كان عدد مستويات الطاقة في الروابط التي نقارن بينها مختلفًا، فعادةً يمكن التحديد بأنّ الذرّة التي لها مستويات طاقة أقل معبّأة بالإلكترونات، يكون نصف قُطرها أصغر، ممّا يكوِّن بُعدًا أصغر بين نواتها والإلكترونات الرابطة، والعكس صحيح طبعًا.
- إذا كان عد مستويات الطاقة للذرّات في الروابط التي نقارن بينها متساويًا، إذًا العامل الذي يحدّد هو عدد البروتونات. في هذه الحالة، إذا كان عدد البروتونات في نواة الذرّة أكبر، يكون نصف القُطر أصغر، والعكس صحيح.
في المرحلة الثانية، نفحص كِبَر الشحنة الكهربائيّة.
العوامل التي تؤثّر على كِبَر الشحنة الكهربائيّة:
رتبة الرابط أيّ، عدد أزواج الإلكترونات المشتركة. كلّما كان عدد أزواج الإلكترونات المشتركة أكبر، أيّ كلّما كانت الشحنة الكهربائيّة أكبر، فإنّ قوّة التجاذُب الكهربائيّ بين الأنوية الموجبة والإلكترونات المشتركة تكون أكبر، والعكس صحيح.
نفحص أوّلًا ما إذا كان الرابط قطبيًّا أم غير قطبيّ. ثانيًا، إذا كان الرابطان قطبيَّين، كلّما كان الرابط أكثر قطبيّةً، أيّ أنّ الفرق بين قيَم السالبيّة الكهربائيّة أكبر، تتكوّن على الذرّات في الرابط شحنات جزئيّة أكبر. بكلمات أخرى، الشحنة الكهربائيّة أكبر، لذلك قوّة التجاذُب الكهربائيّ الإضافيّة بين القطبَين اللذَين يتكوّنا، ستكون أكبر، والعكس صحيح.
عندما نفحص تأثير مقدار الشحنة الكهربائيّة على قوّة الرابط، يجب أن نفحص كلّ واحد من العوامل المؤثِّرة: رتبة الرابط ودرجة القُطبيّة على حِدة. وذلك لأنّه في إطار تعلّم الكيمياء في المرحلة الثانويّة، لا يمكن قياس مدى نسبيّة تأثير كلّ واحد من العوامل على مقدار الشحنة الكهربائيّة. سنرى ذلك في الأمثلة لاحقًا.
طول الرابط يتناسب تناسبًا عكسيًّا مع قوّة الرابط. هذا يعني أنّه كلّما كان الرابط أقوى، يكون أقصر.
تجدر الإشارة إلى أنّ طول الرابط يقاس بوِحدات طول تسمّى أنغستروم 1 .(Å) أنغستروم يساوي 10-10 متر.
طاقة الرابط التي سنتعلّم عنها في مرحلة لاحقة، تتناسب تناسبًا طرديًّا مع قوّة الرابط. هذا يعني أنّه كلّما كان الرابط أقوى، فإنّ الطاقة المطلوبة لتفكيكه تكون أكبر.
نُشير إلى أنّ طاقة الرابط تقاس عادةً بوحدات كيلوجاول للمول (kJ/mol).
أسئلة كمثال
- اذكروا العامل/العوامل التي تشرح الحقيقة بأنّ الرابط S—O أضعف من الرابط S═O.
لكي نُحدّد لماذا الرابط S—O أضعف، يجب أن نفحص كلّ واحد من العوامل الثلاثة التي ذكرناها في المخطّط، وهي: نصف القُطر، رتبة الرابط ودرجة القطبيّة. النقطتان 1 و-2 تمكّناننا من التطرّق إلى نصف قُطر الذرّات المشاركة في الروابط.
- عدد مستويات الطاقة للذرّات المشاركة في الرابط متساوٍ، لأنّه في كِلا الرابطَين، توجد نفس الذرّات.
- عدد البروتونات في الأنوية في الذرّات المشاركة في الرابط، متساوٍ. هذا لا يعني أنّ البُعد بين الأنوية والإلكترونات الرابطة متساوٍ في الحالتَين. على العكس، البُعد ليس متساويًا، وسنشرح فيما بعد سبب ذلك.
- رتبة الرابط ليست متشابهة. للرابط S═O رتبة رابط أكبر.
- الرابطان متشابهان من حيث درجة قُطبيّتهما والفرق في قيَم السالبيّة الكهربائيّة متساويًا.
لهذه الأسباب، يتّضح أنّ العامل الذي يشرح الفرق في قوّة الرابط هو رتبة الرابط. رتبة الرابط S═O أكبر من رتبة الرابط S—O. في S═O الرابط زوجيّ وفي S—O الرابط فرديّ.
الإضافة التالية غير مطلوبة في الإجابة.
يمكن شرح النتائج والاستنتاج على النحو التالي:
بما أنّه في الرابط S═O هناك عدد أكبر من الشحنات السالبة بين أنوية الذرّات المشاركة في الرابط، أيّ أزواج إلكترونات رابطة أكثر، فإنّ قوّة تجاذُب الانوية للإلكترونات المشتركة أكبر، لذلك الرابط أقوى. هذا التجاذُب هو وفقًا لقانون كولوم، الذي ينصّ على أنّه كلّما كانت الشحنة الكهربائيّة أكبر، يكون التجاذُب بين الشحنات أقوى.
كما ذكرنا، كلّ التفسيرات الواردة تعتمد على قانون كولوم. فيما بعد، لن نعتمد على قانون كولوم للتفسير، لأنّ ذلك غير مطلوب في البچروت. يجب أن نعرف فقط ما هي العوامل المؤثّرة.
- ما هو العامل/العوامل التي تفسّر لماذا الرابط H—O أقوى من الرابط H—N؟
–نبني جدولًا بسيطًا يعرض لنا العوامل والروابط التي سنفحصها:
| الرابط/العامل | نصف قُطر الذرّات المشاركة في الرابط، | رتبة الرابط | قطبيّة الرابط | |
| عدد مستويات الطاقة | عدد البروتونات في النواة | |||
| H-O | متساوٍ (1+2) | بروتون واحد للهيدروجين H؛ 8 بروتونات للأكسجين O | متساوٍ زوج إلكترونات مشترك واحد | أكثر قطبيّةً 1.4 = 3.5-2.1 |
| H-N | متساوٍ (1+2) | بروتون واحد للهيدروجين H؛ 7 بروتونات للنيتروجين N | متساوٍ زوج إلكترونات مشترك واحد | أقلّ قطبيّةً 0.9 = 3.0-2.1 |
يمكن أن نلاحظ أنّ العوامل التي تشرح لماذا الرابط H—O أقوى من الرابط H—N هي: الحقيقة بأنّ نصف قُطر الذرّات المشاركة في الرابط H—O أصغر (عمليًّا، نصف قُطر ذرّة الأكسجين O أصغر من نصف قُطر ذرّة النيتروجين N). كلّما كان نصف قُطر الذرّات المشاركة في الرابط أصغر، يكون البُعد بين الأنوية والإلكترونات الرابطة أصغر. هناك عامل آخر وهو أنّ الرابط H—O أكثر قطبيّةً.
نوسّع الشرح قليلًا، لكن تجدر الإشارة إلى أنّ الجواب المفصّل أعلاه كافٍ. بما أنّ عدد البروتونات في نواة ذرّة الأكسجين (O) أكبر من عدد البروتونات في نواة ذرّة النيتروجين (N)، فإنّ قوّة جذب نواة الأكسجين أكبر. لذلك ذرّة الأكسجين أصغر من ذرّة النيتروجين. يمكن القول أيضًا إنّ نصف قُطر ذرّة الأكسجين أصغر. نتيجةً لذلك، البُعد بين الأنوية وبين الإلكترونات الرابطة أصغر، وقوّة التجاذُب الكهربائيّ بين الأنوية وأزواج الإلكترونات المشتركة في الرابط H—O أكبر وفقًا لقانون كولوم.
الرابط H—O أكثر قطبيّةً، لذلك الشحنات الجزئيّة التي تتكوّن على الذرّات في هذا الرابط تكون أكبر. نتيجةً لذلك، قوّة التجاذُب الكهربائيّ الإضافيّة بين الشحنات الجُزئيّة اللتان تتكوّنان، هي أكبر وفقًا لقانون كولوم.
لنلخّص: في امتحان البچروت لا حاجة للتفسير، بل الإشارة فقط إلى العوامل التي تؤدّي إلى فرق في طاقة الرابط، لذلك يمكن أن نكتب أنّ الرابط O—H أقوى من الرابط H—N لأنّ نصف قُطر ذرّة الأكسجين O أصغر من نصف قُطر ذرّة النيتروجين، وأنّ الرابط H—O أكثر قطبيّةً من الرابط H—N.
- معطى الجدول التالي:
الرابط طاقة الرابط (kJ/mol) H-H 436 Br-Br 193 ما هي العوامل التي تفسّر الفرق في طاقات الرابط في كِلا الرابطَين؟
نذكّركم أنّه كلّما كانت الطاقة اللازمة لتفكيك الرابط، أيّ طاقة الرابط، أكبر، هذا يعني أنّ الرابط بين الذرّتَين المشاركتَين في الرابط أقوى. علينا أن نشرح عمليًّا لماذا الرابط H—H أقوى من الرابط Br—Br.
نبني الجدول من السؤال السابق. تجدر الإشارة هنا إلى أنّه ليس من الضروري أن نستعين بالجدول، لكن من الضروريّ أن نفحص العوامل الأربعة.
| الرابط/العامل | نصف قُطر الذرّات المشاركة في الرابط، الذي يؤثّر على البُعد بين الأنوية والإلكترونات الرابطة | رتبة الرابط | قطبيّة الرابط | |
| عدد مستويات الطاقة | عدد البروتونات في النواة | |||
| H-H | أصغر (1+1) | بروتون واحد لكلّ ذرّة هيدروجين H | متساوٍ زوج إلكترونات مشترك واحد | رابط نقيّ (غير قطبيّ) |
| Br-Br | أكبر (4+4) | 35 بروتونًا لكلّ ذرّة بروم Br | متساوٍ زوج إلكترونات مشترك واحد | رابط نقيّ (غير قطبيّ) |
نلاحظ من الجدول أنّ العامل الذي يفسّر الحقيقة بأنّ الرابط بين ذرّات الهيدروجين (H) أقوى، هو أنّ نصف قُطر ذرّة الهيدروجين أصغر من نصف قُطر ذرّة البروم. (عدد مستويات الطاقة في الهيدروجين أصغر، لذلك نصف قُطر ذرّة الهيدروجين أصغر. لذلك، البُعد بين الأنوية وبين الإلكترونات الرابطة أصغر، والرابط أقوى).
- اشرحوا لماذا طول الرابط Cℓ—Cℓ هو 1.99Å بينما طول الرابط Br—Br هو 2.88Å.
الكلور (Cℓ) موجود في السطر الثالث في القائمة. من هنا، لديه 3 مستويات طاقة. البروم (Br) موجود في السطر الرابع في القائمة، لذلك لديه 4 مستويات طاقة.
طول الرابط بين ذرّات الكلور (Cℓ) أصغر، لأنّ عدد مستويات الطاقة في ذرّة الكلور أقلّ بالمقارنة مع ذرّة البروم (Br).
- اشرحوا لماذا طول الرابط N—N هو 1.47Å بينما طول الرابط N—O هو 1.19Å.
هذه الحالة أكثر تعقيدًا.
في كِلا الرابطَين، لكل واحدة من الذرّات يوجد نفس عدد مستويات الطاقة: مستويان للأكسجين (O) ومستويان أيضًا للنيتروجين (N).
الفرق في طول الرابط ناتج عن سببَين:
أ. لذرّة الأكسجين عدد بروتونات أكبر في النواة، لذلك قوّة جذب النواة أكبر. لذلك، ذرّة الأكسجين أصغر من ذرّة النيتروجين. يمكن القول أيضًا إنّ نصف قُطر ذرّة الأكسجين أصغر من نصف قُطر ذرّة النيتروجين.
ب. الرابط N—O قطبيّ بينما الرابط N—N غير قطبيّ. في الرابط القطبيّ (N—O) هناك تجاذُب كهربائيّ أقوى بين الشحنات التي تتكوّن على الذرّات، وذلك بسبب الفرق في قيَم السالبيّة الكهربائيّة. في الرابط N—O تتكوّن على الذرّات شحنات كهربائيّة نسبيّة أكبر بالمقارنة مع الشحنات الكهربائيّة في ذرّات الرابط غير القطبيّ (N—N).
لهذَين السببَين، نستنتج أنّ الرابط N—O هو رابط أقصر، أيّ أنّ طوله أقلّ.