صفات المواد الأيونيّة
لكي نفهم صفات المواد الأيونيّة نتذكّر مبنى الشبكة الأيونيّة.
المادّة الأيونية مكوّنة من أيونات موجبة مُحاطة بأيونات سالبة ومن أيونات سالبة مُحاطة بأيونات موجبة، وبينها تجاذُب كهربائيّ. مبنى المادّة والقوى العاملة بين الجُسَيمات التي تُشكّلها (الأيونات) تساعدنا في فهم وشرح صفاتها.
سنقوم بشرح صفات المادّة الايونيّة وسنتطرّق أيضًا إلى خصائص مكوّناتها:
- المادّة الأيونيّة تتكوّن من أيونات؛
- بين الأيونات يوجد تجاذب كهربائيّ؛
- بسبب قوّة التجاذب الكهربائيّ بين الأيونات، الأيونات قريبة من بعضها ومتراصّة، ولهذا السبب تكون كافّة المواد الأيونيّة صلبةً في درجة حرارة الغرفة؛
- للمواد الأيونية درجة حرارة انصهار وغليان تتراوح بين مئات الدرجات المئويّة وحتّى آلاف الدرجات المئويّة؛
يتطلب الأمر طاقة كبيرة لفصل التجاذب الكهربائيّ بين الأيونات ذات الشحنات المعاكسة؛
(في المنهاج التعليميّ، لا يُطلب منكم شرح السبب في وجود اختلافات بين درجات حرارة الانصهار والغليان للمواد الأيونيّة ولا حتّى بين المواد الأيونيّة والمواد الأخرى التي سنتعلّمها أو قمنا بتعلّمها مثل المواد الجُزَيئيّة). - الذائبيّة في الماء: بعض المواد الأيونيّة تذوب في الماء. هذه المواد تُسمّى مواد أيونيّة قابلة للذوبان. بعض المواد الأيونيّة لا تذوب في الماء. تُسمّى هذه المواد بمواد أيونيّة غير قابلة للذوبان.
ثمّة مواد أيونيّة ذات ذائبيّة جُزئيّة في الماء، ولن نتوسّع في هذا الموضوع في هذا الفصل.
في المنهاج التعليميّ، سنتطرّق فقط لذائبيّة المواد الأيونيّة في الماء وليس في مذيبات أخرى. - التوصيل الكهربائيّ: المواد الأيونيّة لا تتمتّع بخاصّيّة التوصيل الكهربائيّ في الحالة الصلبة، ولكنها تتمتع بهذه الخاصّيّة في الحالة المنصهرة (السائلة). حتى المحاليل المائيّة للمواد الأيونيّة القابلة للذوبان تتمتّع بخاصيّة التوصيل الكهربائيّ؛ سنشرح عن الموضوع بتوسّع فيما بعد.
- التطريق: المواد الأيونيّة غير قابلة للتطريق؛
والآن سنشرح بتوسّع الصفات الثلاثة الأخيرة: الذائبيّة في الماء، التوصيل الكهربائيّ والتطريق.
الذائبيّة في الماء
سنتحدّث فيما يلي عن إذابة ملح الطعام (NaCℓ(s)) في الماء، وهي تجربة نعرفها جميعًا من الحياة اليوميّة.
قرّر سامر إعداد وجبة ساخنة. في البداية غلى الماء وأضاف ملعقتين كبيرتين من ملح الطعام (NaCℓ(s)). ملح الطعام هو مادّة صلبة بيضاء مكوّنة من حبيبات بيضاء لامعة. لاحَظَ سامر أن الملح اختفى في الماء.
ما الذي حدث فعليًا للملح؟
الظاهرة التي لاحظَها سامر هي إذابة الملح في الماء. هذا هو المستوى الماكروسكوبيّ للظاهرة.
أمامكم سلسلة من الصُور والتشبيهات من المستوى الماكروسكوبيّ إلى المستوى الميكروسكوبيّ:

ما الذي حدث على المستوى الميكروسكوبيّ لبلّورة (حُبيبة) الملح التي أضافها سامر إلى الماء؟
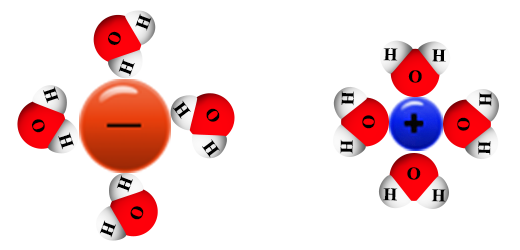
عند إدخال بلّورة ملح إلى الماء، فإنها تحاط على الفور بجُزَيئات الماء بالطريقة التالية (سنوضّح ذلك فقط على الطبقة الخارجيّة الأولى):

عندما تحيط جُزَيئات الماء بحُبَيبة الملح، يحدث تجاذب كهربائيّ بين الأيونات الموجبة في المادّة الأيونيّة وبين الأقطاب السالبة ( -δ) في جُزَيئات الماء، وهي ذرّات الأوكسجين. كما ويحدث تجاذب بين الأيونات السالبة في الشبكة الأيونيّة وبين الأقطاب الموجبة (+δ) في جُزَيئات الماء، وهي ذرّات الهيدروجين.
هناك أيضًا تجاذب كهربائيّ بين الأيونات في الشبكة الأيونيّة، التي تتحلّل تدريجيًا. إضافةً لذلك، هناك أيضًا أربطة هيدروجينيّة بين جُزَيئات الماء نفسها، أي بين ذرّة هيدروجين مكشوفة من الإلكترونات في جُزَيء واحد وزوج إلكترونات غير رابط في ذرّة أوكسجين في جُزَيء آخر.
في هذه الحالة، تبدأ الشبكة الأيونيّة بالتقلّص (التحلّل) حتى تختفي تمامًا. جُزَيئات الماء تتمكن من جذب أيون تلو الآخر من الشبكة الأيونيّة، حتى يتحلّل مبنى الشبكة الأيونيّة بالكامل.
على المستوى الميكروسكوبيّ، يمكن وصف مبنى المحلول على النحو التالي:
في محلول المادة الأيونيّة، توجد أيونات موجبة وسالبة مُحاطة بجُزَيئات ماء تُسمّى الأيونات المميّأة. هذه الأيونات حرّة الحركة (مُتَنقّلة) في المحلول.
يحتوي المحلول على أيونات موجبة، مُحاطة بالجزء المشحون بشحنة نسبيّة جُزئيّة ساابة (-δ) – ذرّة الأوكسجين الموجودة في جُزَيئات الماء – وبينها تجاذب كهربائيّ.
توجد أيضًا أيونات سالبة، مُحاطة بالجزء المشحون بشحنة نسبيّة جُزئيّة موجبة (+δ) – ذرّة الهيدروجين الموجودة في جُزَيئات الماء – وبينها تجاذب كهربائيّ.
إضافةً لذلك، هناك أيضًا أربطة هيدروجينيّة بين جُزَيئات الماء، أي بين ذرّة هيدروجين مكشوفة من الإلكترونات في جزيء واحد وزوج إلكترونات غير رابط لذرّة أكسجين في جُزَيء آخر.
كما أن الأيونات المميّأة وجُزَيئات الماء في المحلول تتمتّع بحركة دورانيّة وذبذبة.
عادةً، تكون درجة الترتيب في المحلول أقلّ منها في المادّة الصلبة.
نذكر هنا أنّه في حال أردنا وصف حالة مادّة أيّ كانت أو محلول على المستوى الميكروسكوبيّ، يجب أن نتطرق إلى العوامل التالية:
- نوع الجُسَيمات؛
- الأربطة بين الجُسَيمات ونوع الشبكة (إذا كانت المادّة في الحالة الصلبة)، مع تفاصيل وشرح (نوع الرابط، وبين من ومن يتحقّق)؛
- حركة الجُسَيمات؛
- درجة ترتيبها نسبةً للحالة الصلبة (إذا كانت الإمكانيّة واردة).
الرسم التالي يوضّح حالة الأيونات المميّأة في المحلول:
عندما تحيط جُزَيئات الماء بحُبَيبة الملح، يحدث تجاذب كهربائيّ بين الأيونات الموجبة في المادّة الأيونيّة وبين الأقطاب السالبة ( -δ) في جُزَيئات الماء، وهي ذرّات الأوكسجين. كما ويحدث تجاذب بين الأيونات السالبة في الشبكة الأيونيّة وبين الأقطاب الموجبة (+δ) في جُزَيئات الماء، وهي ذرّات الهيدروجين.
هناك أيضًا تجاذب كهربائيّ بين الأيونات في الشبكة الأيونيّة، التي تتحلّل تدريجيًا. إضافةً لذلك، هناك أيضًا أربطة هيدروجينيّة بين جُزَيئات الماء نفسها، أي بين ذرّة هيدروجين مكشوفة من الإلكترونات في جُزَيء واحد وزوج إلكترونات غير رابط في ذرّة أوكسجين في جُزَيء آخر.
في هذه الحالة، تبدأ الشبكة الأيونيّة بالتقلّص (التحلّل) حتى تختفي تمامًا. جُزَيئات الماء تتمكن من جذب أيون تلو الآخر من الشبكة الأيونيّة، حتى يتحلّل مبنى الشبكة الأيونيّة بالكامل.
على المستوى الميكروسكوبيّ، يمكن وصف مبنى المحلول على النحو التالي:
في محلول المادة الأيونيّة، توجد أيونات موجبة وسالبة مُحاطة بجُزَيئات ماء تُسمّى الأيونات المميّأة. هذه الأيونات حرّة الحركة (مُتَنقّلة) في المحلول.
يحتوي المحلول على أيونات موجبة، مُحاطة بالجزء المشحون بشحنة نسبيّة جُزئيّة ساابة (-δ) – ذرّة الأوكسجين الموجودة في جُزَيئات الماء – وبينها تجاذب كهربائيّ.
توجد أيضًا أيونات سالبة، مُحاطة بالجزء المشحون بشحنة نسبيّة جُزئيّة موجبة (+δ) – ذرّة الهيدروجين الموجودة في جُزَيئات الماء – وبينها تجاذب كهربائيّ.
إضافةً لذلك، هناك أيضًا أربطة هيدروجينيّة بين جُزَيئات الماء، أي بين ذرّة هيدروجين مكشوفة من الإلكترونات في جزيء واحد وزوج إلكترونات غير رابط لذرّة أكسجين في جُزَيء آخر.
كما أن الأيونات المميّأة وجُزَيئات الماء في المحلول تتمتّع بحركة دورانيّة وذبذبة.
عادةً، تكون درجة الترتيب في المحلول أقلّ منها في المادّة الصلبة.
نذكر هنا أنّه في حال أردنا وصف حالة مادّة أيّ كانت أو محلول على المستوى الميكروسكوبيّ، يجب أن نتطرق إلى العوامل التالية:
- نوع الجُسَيمات؛
- الأربطة بين الجُسَيمات ونوع الشبكة (إذا كانت المادّة في الحالة الصلبة)، مع تفاصيل وشرح (نوع الرابط، وبين من ومن يتحقّق)؛
- حركة الجُسَيمات؛
- درجة ترتيبها نسبةً للحالة الصلبة (إذا كانت الإمكانيّة واردة).
الرسم التالي يوضّح حالة الأيونات المميّأة في المحلول:
ملح الطعام (NaCl) هو مادة أيونية قابلة للذوبان إذ أنّه يذوب كلّيًّا في الماء إلى أن يختفي.
كمّية الملح التي تذوب في الماء تعتمد على كمّية الماء (المُذِيب) في الوعاء ودرجة حرارة الماء.
يمكنكم التحقّق من ذلك بأنفسكم. إذا أخذتم كوبًا مملوءًا حتّى نصفه بالماء، أضفتم إليه الملح وحرَّكتموه، عند نقطة معيّنة، لن يذوب الملح الذي تُضيفونه في الماء. يسمّى هذا المحلول محلولًا مشبعًا.
في تعليم الكيمياء في المدرسة لن نتطرّق إلى المحاليل المشبعة
كما أنّ هناك مواد أيونيّة قابلة للذوبان، هناك أيضًا مواد أيونيّة غير قابلة للذوبان. هذه مواد أيونيّة لا تذوب في الماء تقريبًا؛ عندما نقوم بإضافتها للماء سترسُب كالحجر. بدلاً من ذلك، إذا قمنا بأخذ مسحوق من مادّة أيونيّة غير قابلة للذوبان وخلطناه بالماء، سنحصل على خليط مُعكّر (غير صافٍ).
ما يميّز الحالة التي لا تذوب فيها المواد في بعضها البعض هو أن جُزَيئات المُذِيب لا تستطيع فصل جُسَيمات المُذاب عن بعضها.
هناك أيضًا مواد أيونيّة تذوب في الماء بشكل جزئيّ، وهذا الموضوع أيضًا لن نتطرّق إليه في دروس الكيمياء في المدرسة.
كما ذكرنا، هناك مواد أيونيّة قابلة للذوبان وهناك مواد أيونيّة غير قابلة للذوبان. لن تحتاجوا إلى التذكّر عن غيب أيّ المواد الأيونيّة قابلة للذوبان وأيّها غير قابلة للذوبان. ولكن مع ذلك، سنقدّم هنا القاعدة التالية: المواد الأيونيّة التي تحتوي على أيون فلزّيّ من العمود الأول مثل أيون الصوديوم (+Na) أو أيون البوتاسيوم ( +K) أو أيون النترات NO3–، أو أيون الأمونيومNH4+ تكون في الغالب موادًا أيونيّة قابلة للذوبان
الآن، سنصيغ عمليّة الإذابة في الماء لبعض المواد الأيونيّة. لنتذكّر الطريقة التي حدّدنا بها شحنة الأيون وهل هو أيون لفلزّ انتقاليّ أو أيون معقّد، كما تعلّمنا في الدرس السابق.
فيما يلي صيغة العمليّة:
كيف عرفنا ما هي الشحنة على كلّ واحد من الأيونات؟
استعنّا في قائمة العناصر الدوريّة. الصوديوم الموجود في العمود الأوّل هو فلزّ، لذلك شحنته كأيون ستكون +1. النيتروجين الموجود في العمود الخامس هو لافلّز، لذلك شحنته كأيون ستكون ‾3.
باستخدام قائمة العناصر الدوريّة، نحدّد أنّ شحنة أيون المغنيسيوم (Mg)، وهو فلزّ من العمود الثاني، هي +2. شحنة أيون الكلور (Cℓ)، وهو لافلزّ من العمود السابع، ستكون -1.
البوتاسيوم (K) هو فلزّ من العمود الأوّل وبالتالي شحنته كأيون هي +1؛ الكبريت (S) هو لافلزّ من العمود السادس وبالتالي شحنته كأيون هي -2.
الآن سنرى أمثلة على محاليل للمواد الأيونيّة التي تحتوي على فلزّات انتقاليّة.
المشكلة هي تحديد ما ستكون شحنة أيون الحديد (Fe). بما أنّ الصيغة الأمبيريّة للمادّة من المفترض أن تكون متعادلة كهربائيًا، فسنقوم بالعمليّة الحسابيّة التي قمنا بها في الدرس السابق.
سنحسب عدد الشحنات السالبة الكلّيّ في الصيغة الأمبيريّة:
| الأيون | Cℓ ‾ |
| شحنة الأيون | 1- |
| عدد الأيونات في الصيغة الأمبيريّة | 3 |
| عدد الشحنات الكلّيّ | 3- |
نحسب عدد الشحنات الموجبة الكلّيّ في الصيغة الأمبيريّة:
| الأيون | Cℓ ‾ | ||
| شحنة الأيون | 1- | ||
| عدد الأيونات في الصيغة الأمبيريّة | 3 | ||
| عدد الشحنات الكلّيّ | 3- | ⟵ | 3+ |
نقسم الشحنة الموجبة الكلّية على عدد ذرّات الأيون الموجب في الصيغة الأمبيريّة ونحصل على:
| الأيون | Cℓ ‾ | Fe3+ | |
| شحنة الأيون | 1- | 3+ | |
| عدد الأيونات في الصيغة الأمبيريّة | 3 | 1 | |
| عدد الشحنات الكلّيّ | 3- | ⟵ | 3+ |
أي، أيون الحديد هو Fe3+.
وبالتالي صياغة عمليّة الإذابة في الماء للمادّة FeCℓ3(s) هي:
الآن سنرى أمثلة إضافية لمواد أيونيّة تحتوي على ايونات معقّدة. الأيون المعقّد هو أيون يحتوي على مجموعة من الذرّات، عادةً من اللافلزّات. غالبًا، تكون الأيونات المعقّدة أيونات سالبة.
هنا أيضًا سنتذكّر طريقة تحديد شحنة الأيون المعقّد، والتي تتشابه مع الطريقة المتّبعة لتحديد شحنة أيونات الفلزّات التي تنتمي إلى مجموعة الفلزّات الانتقاليّة.
سنحسب الشحنة على النحو التالي:
بالاستعانة بشحنة أيون واحد من عنصر البوتاسيوم (K+) الذي يقع في العمود الأول في القائمة الدوريّة وشحنته +1، وعدد أيونات البوتاسيوم في الصيغة الأمبيريّة، نحسب الشحنة الموجبة الكلّيّة.
| الأيون | K+ |
| شحنة الأيون | 1+ |
| عدد الأيونات في الصيغة الأمبيريّة | 2 |
| عدد الشحنات الكلّيّ | +2 |
الآن سنعرف ما هي الشحنة السالبة الكلّيّة التي تساوي في قيمتها المطلقة الشحنة الموجبة، بحيث يكون مجموعهما صفرًا:
| الأيون | K+ | ||
| شحنة الأيون | 1+ | ||
| عدد الأيونات في الصيغة الأمبيريّة | 2 | ||
| عدد الشحنات الكلّيّ | 2- | ⟶ | +2 |
إذا قسمنا الشحنة الكلّيّة على عدد أيونات الـSO4 في الصيغة الأمبيريّة نحصل على شحنة هذا الأيون:
| الأيون | SO42‾ | K+ | |
| شحنة الأيون | 2- | 1+ | |
| عدد الأيونات في الصيغة الأمبيريّة | 1 | 2 | |
| عدد الشحنات الكلّيّ | 2- | ⟶ | +2 |
وبالتالي فإنّ صياغة عمليّة الإذابة في الماء تكون على النحو التالي:
سنصيغ العمليات التالية.
صيغوا عمليّة الإذابة في الماء للمواد التالية:
لننظر إلى المثال التالي. في بعض الأحيان يتم كتابة المادّة الأيونيّة بترتيب عكسيّ، أي نكتب أوّلًا الأيون السالب من ثمّ الأيون الموجب. يحدث هذا عندما يكون الأيون السالب أيونًا معقّدًا مصدره من المواد العضويّة كالأحماض الكربوكسيليّة.
الصياغة
لا أهمّية لترتيب كتابة الأيونات في النواتج.
الصياغة
نادرًا ما نصادف أيونًا سلبيًا يحتوي على فلزّ. عادةً تحتوي الصيغة الأمبيريّة للمادّة على فلزّ من أحد الأعمدة 1، 2 أو 3، بالإضافة إلى أنّ الأيون المعقد يحتوي على فلزّ انتقاليّ.
كلّ من البوتاسيوم (K) والمنغنيز (Mn) هما فلزّات. البوتاسيوم يتواجد في العمود الأوّل بينما المنغنيز هو فلزّ انتقاليّ.
عمليّة الإذابة في الماء تُكتب على النحو التالي:
لن نتطرّق إلى شروحات معقّدة في هذا الموضوع، ولكن نذكر أنّ الأيون السالب (المعقّد) سيحتوي في داخله على فلزّ انتقاليّ.
الصياغة
التركيبة الأخيرة والمميّزة التي سنتعلّم عنها هي التركيبة التي تحتوي على أيون الأمونيوم، وهو أيون معقّد موجب يحتوي فقط على ذرّات من اللافلزّات NH4+.
أيون الأمونيوم هو واحد من بين أيونين موجبين يحتويان فقط على ذرّات للافلزّات والتي سنقوم بتعلّمها. عادةً تكون الأيونات الموجبة فلزّية، أي أنّ مصدرها من ذرّات عناصر فلزّيّة
ننصحكم بتذكّر أيون الأمونيوم عن غيب.
إليكم مثال لمادّة من هذا النوع : NH4Cℓ(s).
انتبهوا إلى أنّ المادّة تتكوّن فقط من ذرّات عناصر لافلزّية، إلّا أنّها مادّة أيونيّة. لذلك، تذكّروا فيما لو رأيتم التركيبة NH4 يمكنكم القول بأنّه أيون مشحون بشحنة موجبة +1.
الصياغة
نذكّركم بأنّ طريقة حساب شحنة الأيونات هي ذاتها كما تمرّنا في الأمثلة السابقة.
في هذه الحالة، المثال بسيط نسبيًا. بعد أن فهمنا أنّ المادّة أيونيّة، علينا أن نتذكّر أنّ لدينا هنا أيون الأمونيوم NH4+ وأيون الكلور الذي مصدره من لافلزّ من العمود السابع وبالتالي شحنته -1.
صياغة عمليّة الإذابة في الماء
صياغة عمليّة الإذابة في الماء
نلخّص موضوع إذابة المواد الأيونيّة بالقول بأنّ هناك مواد أيونيّة قابلة للذوبان وهناك مواد أيونيّة غير قابلة للذوبان. سنعاود التطرّق إلى الموضوع فيما بعد.
التوصيل الكهربائيّ
المواد الأيونيّة لا تتمتّع بخاصّيّة التوصيل الكهربائيّ في الحالة الصلبة. على الرغم من أنّ المواد الأيونيّة تتكوّن من أيونات، مما يعني وجود شحنات كهربائيّة في المادّة، إلّا أنّ هناك تجاذب كهربائيّ قوي بين الأيونات، ولذلك الأيونات ليست مُتنقّلة.
في المقابل، المواد الأيونيّة موصلة للكهرباء في الحالة المنصهرة. في حالة المادّة هذه، تكون الأيونات أبعد عن بعضها البعض، التجاذب الكهربائيّ بينها أقلّ، الأيونات مُتنقّلة ولذلك تتمتّع المادّة الأيونيّة في الحالة المنصهرة بخاصّيّة التوصيل الكهربائيّ. لكي نصف عملية مرور التيّار، سوف نصيغ للمادّة الأيونيّة عمليّة انصهار ونربط بين الصياغة والتفسير المتعلّق بتوصيل التيار.
معطاة المادّة NaCℓ(s).
صيغوا عمليّة انصهارها.
يمكننا أن نرى من الصياغة أنّه في الحالة الصلبة لا يتمّ تسجيل الأيونات بشكل منفصل، بينما في الحالة السائلة تكون الأيونات مُنفصِلة ومُتنقّلة. لذلك، للمادة الأيونيّة توصيل كهربائيّ في الحالة المنصهرة (السائلة).
فيما يلي بعض الأمثلة الإضافيّة.
صيغوا عمليّة الانصهار للمواد التالية.
صياغة عمليّة الانصهار
صياغة عمليّة الانصهار
صياغة عمليّة الانصهار
صياغة عمليّة الانصهار
وماذا يحدث في المحلول؟ هل محلول المادّة الأيونيّة موصِل للتيّار الكهربائيّ؟
للإجابة على هذا السؤال، يجب فحص ما إذا كانت المادّة الأيونيّة قابلة للذوبان أو غير قابلة للذوبان. في الواقع، يمكننا القول أنّه إذا كانت المادّة الأيونيّة غير قابلة للذوبان، فلن ينتج محلول لأنّ المواد لا تختلط مع بعضها البعض. ولكن عندما يتعلق الأمر بمادّة أيونيّة قابلة للذوبان، وإذا نجح الماء في تحليل الشبكة الأيونيّة، يتم الحصول على أيونات مميّأة مُتنقّلة، ويصبح المحلول موصلًا للتيّار الكهربائيّ.
يمكن مشاهدة الفيديو الذي يصف عملية إذابة المادّة الأيونيّة في الماء وموصليّة التيّار الكهربائيّ في المحلول المائيّ:
التطريق
المواد الأيونيّة غير قابلة للتطريق.
ما هي عمليّة التطريق؟
التطريق هي عمليّة يتم خلال تشغيل قوّة على مادّة ما، ممّا يؤدّي إلى تغيير شكلها.
عندما نتطرّق إلى عائلة المواد الفلزّيّة ونتعرّف على صفاتها، سنتعلّم أنّ الفلزّات قابلة للتطريق.
والآن سنشرح لماذا المواد الأيونيّة غير قابلة للتطريق؟ سنُمعِن النظر في طبقة واحدة من الشبكة الأيونيّة:

إذا قمنا بتشغيل قوّة على جزءٍ من الشبكة الأيونيّة، على سبيل المثال، قُمنا بضربها باستخدام مطرقةٍ
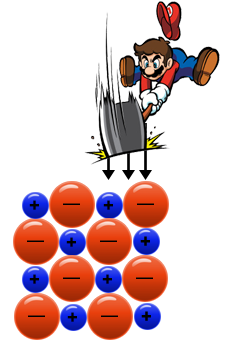
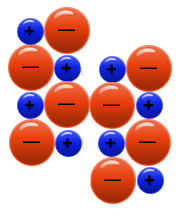
ستنتج حالة يكون فيها أيون سالب مقابل أيون سالب وأيون موجب مقابل أيون موجب. وبالتالي سيحدث تنافر كهربائيّ بين الأيونات، مما يتسبب في تفكّك البلّورة..
سنشاهد مقطع فيديو قصير يوضّح لماذا المادّة الأيونيّة غير قابلة للتطريق.
عمليّة الترسيب
أحيانًا يتم خلط مادّتين أيونيّتين قابلة للذوبان في محلول واحد ونتيجة لذلك يتكوّن راسب وهو ماّدة أيونيّة غير قابلة للذوبان.
هذه العمليّة تسمّى عملية الترسيب أو تكوين الراسب ويمكن صياغتها في صيغة كيميائيّة.
لنشرح عمليّة الترسيب من خلال المثال التالي.
تمّ وضع مياه مقطّرة في دَورَق مُختبريّ.
من ثمّ أضافوا نترات الرصاص Pb(NO3)2(s). بعد إضافتها، حصلنا على محلول صافٍ. مما يعني أنّ نترات الرصاص ذابت في الماء. نذكّر بأنّ أيونات الرصاص هي Pb2+(aq) وأيون النترات هو NO3–(aq).
ثمّ تمّت إضافة يوديد البوتاسيوم KI(s) إلى المحلول والذي هو أيضًا مادّة أيونيّة قابلة للذوبان. في المحلول ظهرت مادّة صفراء ترسّبت كمادّة صلبة. في حال قمنا بخلط المحلول، سنحصل على خليط مُعكّر (غير صافٍ) باللون الأصفر. يعني ذلك أنّ المادّة الصفراء لا تذوب في الماء.
المادّة الصفراء هي مادّة أيونيّة غير قابلة للذوبان تكوّنت نتيجة التجاذب الكهربائيّ الذي يحدث بين أيونات اليود (I–(aq)) وأيونات الرصاص (Pb2+(aq)). الصيغة الأمبيريّة للمادّة المتكوّنة بين هذين الأيونين هي كالتالي PbI2(s)
سنشرح ما يحدث في الوعاء.
بعد إضافة المادّة الأيونيّة الثانية للوعاء يكون هناك أربعة أنواع من الأيونات: أيونات الرصاص، أيونات النترات، أيونات اليود وأيونات البوتاسيوم.
تتحرّك الأيونات في المحلول ويحدث بينها تجاذب (بين الأيونات ذات الشحنات المعاكسة) وتنافر (بين الأيونات ذات الشحنات المتشابهة). إنّ التجاذب بين أيونات الرصاص وأيونات اليود قويّ بما يكفي بحيث لا تتمكن جُزَيئات الماء من فكّ الأربطة التي تَتشكّل فيما بينها. ونتيجةً لذلك، تترسّب في المحلول بلّورات ذات بُنية شبكيّة أيونيّة من يوديد الرصاصPbI2(s).
المعادلة الصافية للعمليّة هي
Pb2+(aq) + 2I ‾(aq) ⟶ PbI2(s)
تسمّى هذه العمليّة، كما ذكرنا، تفاعل الترسيب.
لن تحتاجوا إلى صياغة مثل هذه العمليّات بأنفسكم، ولكن يجب أن تكونوا قادرين على التعرّف على عملية الترسيب التي ستُعطى لكم.
تُسمّى هذة الصياغة بالصافية لأنّ أيونات النترات وأيونات البوتاسيوم غير مشمولة في صياغة العمليّة إذ أنّها ليست جزءًا من عمليّة الترسيب. تُسمّى أيونات مُراقِبة نظرًا لوجودها في وعاء التفاعل لكن لا يحدث أيّ تغيير في تركيبتها الكيميائيّة أو في كمّيتها.
