الرابط التساهميّ (كوفالنتيّ)
كلمة كوفالنتيّ مكوّنة من قسمَيْن:
- كو – (co) مشاركة
- فالنتيّ – (valent) تكافؤيّ
ومعًا: مشاركة إلكترونات التكافؤ.
الرابط التساهميّ (الكوفالنتيّ) يتكوّن بالأساس بين الذرّات التي تنتمي إلى مجموعة اللافلزّات في قائمة العناصر الدوريّة.
نُمعِن النظر في قائمة العناصر الدوريّة:
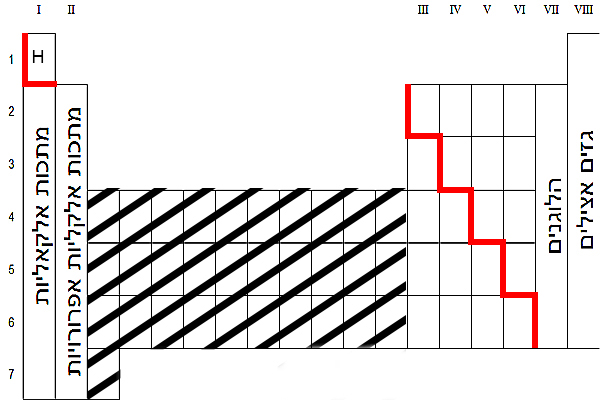
مجموعة اللافلزّات تقع على يمين الخطّ الأحمر، وهي لا تشمل الغازات الخاملة (عمود VIII). ذرّة الهيدروجين تنتمي هي أيضًا لمجموعة اللافلزّات.
نذكّركم بما تعلّمناه في تصنيف الموادّ: غالبيّة العناصر التي تنتمي إلى هذه المجموعة – الهيدروجين، النيتروجين، الأكسجين، الفلور، الكلور، البروم واليود – مكوّنة من جُزَيئات ثنائيّة الذرّة. تعلّمنا أيضًا أنّ الكبريت والفوسفور هما عنصران يظهران في الطبيعة كجُزَيئات متعدّدة الذرّات. كلّ العناصر التي ذكرناها مكوّنة من ذرّات لافلزّات التي تكوِّن رابطًا تساهميًّا مع بعضها البعض. عمليًّا، هذا رابط تقوم فيه كلّ واحدة من الذرّات بمشاركة إلكترون/إلكترونات تكافؤ.
تعلّتعلّمنا أيضًا مصطلحًا آخر من درس ترتيب الإلكترونات، وهو الأوربيتال. وهو منطقة حول نواة الذرّة، والتي فيها احتمال كبير لإيجاد إلكترون أو إلكترونات. نحصل على شكل الأوربيتال من خلال دالّة رياضيّة معقّدة.
ماذا يحدُث إذًا خلال تكوُّن الرابط التساهميّ (الكوفالنتيّ)؟
نتذنتذكّر بأنّ كلّ ذرّة تحتوي على إلكترونات. تتواجد الإلكترونات في مستويات طاقة مختلفة في أوربيتالاتها. هذه الأوربيتالات تُسمّى أوربيتالات ذرّيّة، لأنّها تنتمي إلى ذرّة واحدة فقط.
عندا ترتبط ذرّتان وتكوِّنان معًا رابطًا تساهميًّا، يحدّث تطابُق بين الأوربيتالات الذرّيّة، الخارجيّة بشكل عام، التي تحتوي على إلكترونات التكافؤ. نتيجةً لهذا التطابُق، تتكوّن أوربيتالات جُزَيئيّة.
الأوربيتال الجُزَيئيّ مُعرّف على أنّه المنطقة التي تتواجد فيها إلكترونات مشتركة لذرّتَيْن أو أكثر، مرتبطة برابط كيميائيّ. بما أنّنا نتحدّث عن الرابط التساهميّ، الأوربيتال الجُزَيئيّ هو المنطقة التي يوجد فيها احتمال بأن نجد الإلكترونات المشتركة، التي تنتمي إلى ذرتَيْن مرتبطتَيْن برابط تساهميّ. هنا أيضًا، توجد حالات معقّدة لن نتطرّق إليها.
نتيجة المشاركة بين الذرّات المختلفة، تتكوّن جُزَيئات، سواءً للعنصر – المكوّنة من نوع واحد من الذرّات، وسواءً للمركّبات – المكوّنة من ذرّات عناصر مختلفة – التي يكون مستوى الطاقة الأخير فيها مليئًا. هذه الحالة تشبه مستوى الطاقة الأخير المعبّأ بالإلكترونات لدى الغاز الخامل الموجود في نفس السطر مع ذرّة العنصر، أو في السطر الذي فوقه، وذلك بحسب نوع الرابط الكيميائيّ. بهذا الشكل، يكون هناك استقرار كيميائيّ ينعكس في تغيُّرات الطاقة التي ترافق تكوين الروابط الكيميائيّة. سنتحدّث عن التغيُّرات في الطاقة فيما بعد.
في المثال التالي، سنحاول أن نفهم بشكل مفصّل ماذا يحدُث خلال تكوُّن الرابط التساهميّ (الكوفالنتيّ) بين ذرّتَيّ هيدروجين. ماذا يحدُث عمليًّا عندما تلتقي ذرّة هيدروجين بذرّة هيدروجين أخرى؟
للإجابة عن هذا السؤال، نتذكّر ترتيب الإلكترونات في ذرّة الهيدروجين ومبناها الجُسَيميّ.
لذرّة الهيدروجين ثلاثة نظائر لها نفس السلوك الكيميائيّ. نذكّركم أنّ ما يحدِّد السلوك الكيميائيّ هو مبنى الإلكترونات وإلكترونات التكافؤ، وليس عدد النيوترونات في النواة.
النظير الأكثر شيوعًا هو:
وهو مكوّن من إلكترون واحد وبروتون واحد. ترتيب الإلكترونات فيه هو:
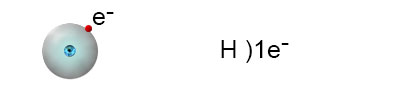
لكي نصل إلى حالة يكون فيها مستوى الطاقة الخارجيّ مليئًا، يجب على الهيدروجين أن يضيف إلكترونًا واحدًا لهذا المستوى. تذكّروا أنّه بحسب قاعدة الأوكتيت، في أغلب الحالات سيمتلئ المستوى الخارجيّ للذرّة بثمانية إلكترونات، في أعقاب تكوُّن رابط كيميائيّ. بما أنّ الهيدروجين له مستوى طاقة واحد فقط، يمكن أن يمتلئ بإلكترونَيْن فقط.
عندما تقترب ذرّتان من بعضهما البعض، تحدُث عمليّات تجاذُب وتنافُر للشحنات الكهربائيّة بين جُسَيمات (البروتونات والإلكترونات) إحدى الذرّتَيْن وجُسَيمات الذرّة الثانية. الإلكترون في إحدى ذرّتَيّ الهيدروجين ينجذب إلى نواتها، لكنّه ينجذب أيضًا إلى نواة الذرّة الثانية، لأنّ كلتَيْهما تحتويان على بروتون موجب. في نفس الوقت، يحدُث تنافُر أيضًا بين إلكترونات الذرّتَيْن لأنّها مشحونة بشحنة سالبة، وكذلك بين بروتونات الذرّتَيْن لأنّها مشحونة بشحنة موجبة. يحدُث شيء مشابه لإلكترون الذرّة الثانية. أيّ أنّ هناك عمليّات تجاذُب وتنافُر بين الشحنات الكهربائيّة. كلّما كان البُعد بين الذرّتَيْن أصغر، تزداد قوة التجاذُب والتنافُر. نذكّركم أنّه بموجب قانون كولوم، كلّما كانت الشحنات الكهربائيّة أقرب من بعضها البعض، تزداد قوّة التنافًر (إذا كانت الشحنات متشابهة) وكذلك قوّة التجاذُب (إذا كانت الشحنات مختلفة).
وواوالآن، إلى النتيجة النهائيّة. معلوم لنا أنّ الهيدروجين موجود في الطبيعة كجُزَيء ثنائيّ الذرّة، أيّ كجُزَيء فيه ذرّتا هيدروجين مرتبطتان ببعضهما البعض. يمكن القول إنّ مُحصّلة قوى التجاذُب بين الشحنات الكهربائيّة، أكبر من مُحصّلة قوى التنافُر بين الشحنات الكهربائيّة، ولذلك يتكوّن الرابط الكيميائيّة بين ذرّتَيّ الهيدروجين.
الرابط الذي يتكوّن بين الذرّتَين هو رابط تساهميّ (كوفالنتيّ). إنّه رابط بين ذرّتَيْن، حيث تقوم كلّ واحدة منهما بمشاركة إلكترون واحد. نتيجةً لهذه المشاركة، يتكوّن أوربيتال جُزَيئيّ، وهو منطقة فراغيّة جديدة تتواجد فيها الإلكترونات المشتركة لذرّتَيْ الهيدروجين. الإلكترونات المشتركة تنجذب للنواتَيْن الموجبتَيْن في ذرّتَيْ الهيدروجين.
فيما يلي فيديو يوضّح بشكل تخطيطيّ وبثلاث مراحل تكوُّن الرابط التساهميّ وتكوُّن المدار المشترك بين ذرّتَيّ هيدروجين:
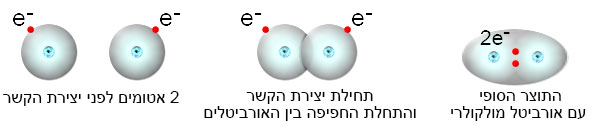
فيما يلي توضيح بسيط لعمليّة تكوُّن الرابط التساهميّ وتكوُّن الأوربيتال المشترك بين ذرّتَيّ هيدروجين
يمكن وصف الرابط بين ذرّتَيّ الهيدروجين بعدّة طرق. خلال هذا الفصل، سنتعرّف في الدروس القادمة على عدّة طرق لوصف/كتابة/تمثيل الناتج الذي يتمّ الحصول عليه في العمليّة.
