الروابط الهيدروجينيّة
في درس التأثيرات المتبادلة بين الجُزَيئات، أشرنا إلى أنّ هناك نوعين من التأثيرات المتبادلة بين الجُزَيئات: تأثيرات متبادلة ڤان در ڤالس وروابط هيدروجينيّة. تحدّثنا عن التأثيرات المتبادلة ڤان در ڤالس، العوامل التي تؤثّر عليها وتأثير قوّة التأثيرات المتبادلة بين الجُزَيئات على درجة انصهار ودرجة غليان المواد.
هناك موادّ جُزَيئيّة، والتي بين جُزَيئاتها، بالإضافة إلى التأثيرات المتبادلة ڤان در ڤالس، توجد تأثيرات أخرى بين الجُزَيئات. في بعض الحالات، هذه التأثيرات المتبادلة تكون أقوى من التأثيرات المتبادلة ڤان در ڤالس، بحيث يمكن تجاهُل تأثير ووجود التأثيرات المتبادلة ڤان در ڤالس.
هذه التأثيرات المتبادلة تسمّى الروابط الهيدروجينيّة.
فيما بعد، سنشرح باختصار لماذا تسمّى قوى التجاذُب من نوع هيدروجين الروابط الهيدروجينيّة، بينما قوى التجاذُب من نوع ڤان در ڤالس تسمّى التأثيرات المتبادلة ڤان در ڤالس.
أأربطة هيدروجينيّة هي روابط بين الجُزَيئات، والتي تتكوّن فقط إذا توفّرت شروط معيّنة سنتحدّث عنها لاحقًا. بخلاف التأثيرات المتبادلة ڤان در ڤالس، التي تتكوّن بين كلّ ذرّتَيْن، جُزَيئات أو جُسَيمات المادّة – لأنّ جميعها تحتوي على إلكترونات، وفي جميعها تتحرّك الإلكترونات وتكوِّن تقاطُبات مختلفة – الروابط الهيدروجينيّة تتكوّن عندما تكون في جُزَيء معيّن روابط تساهميّة (كوفالنتيّة) قطبيّة جدًا، والتي تُشارك فيها ذرّة الهيدروجين. ذرّة الهيدروجين هذه تنجذب إلى شحنة سالبة جدًا في جُزَيء آخر.
عمليًّا، في كلّ الروابط التساهميّة التي تتكوّن تقريبًا، ذرّة الهيدروجين ستكون ذات شحنة جزئيّة موجبة. وذلك لأنّه من بين اللافلزّات (ما عدا الفوسفور P، البورون B، السيليكون Si والأرسين As) قيمة السالبيّة الكهربائيّة للهيدروجين هي الأصغر، لذلك شحنته الجزئيّة موجبة. لكن لا يكفي أن تكون شحنته الجزئيّة موجبة… يجب أن تكون ذرّة الهيدروجين ذات شحنة جزئيّة موجبة كبيرة قدر الإمكان. نتذكّر من درس السالبيّة الكهربائيّة وقطبيّة الرابط، أنّه كلّما كان الفرق في قيَم السالبيّة الكهربائيّة أكبر، تكون الشحنة الجزئيّة على كلّ واحدة من الذرّات في الرابط أكبر. لكي تكون الشحنة الجزئيّة على ذرّة الهيدروجين أكبر، يجب أن نبحث في الجُزَيء عن الروابط التساهميّة التي فيها الفرق الأكبر في قيَم السالبيّة الكهربائيّة، حيث أنّ ذرّة الهيدروجين هي إحدى الذرّات في الرابط.
هناك ثلاث ذرّات تستوفي الشروط المذكورة: الفلور (قيمة السالبيّة الكهربائيّة 4)، الأكسجين (قيمة السالبيّة الكهربائيّة 3.5) والنيتروجين (قيمة السالبيّة الكهربائيّة 3). في هذه الحالات الثلاث، الفرق الناتج في قيَم السالبيّة الكهربائيّة بين ذرّة الهيدروجين وكلّ واحدة من الذرّات المذكورة (فلور، أكسجين ، نيتروجين) سيكون كبيرًا نسبيًّا، لذلك ستتكوّن على ذرّة الهيدروجين شحنة نسبيّة موجبة كبيرة. بكلمات أخرى، كلّما كان الفرق في قيَم السالبيّة الكهربائيّة أكبر، فإنّ زوج الإلكترونات المشترك يتّجه أكثر نحو الذرّة ذات السالبيّة الكهربائيّة الأكبر، بالمقارنة مع الاتّجاه نحو ذرّة الهيدروجين. نتيجةً لذلك، الشحنة النسبيّة على ذرّة الهيدروجين ستصبح موجبة أكثر.
كلّما كان الفرق في قيَم السالبيّة الكهربائيّة أكبر، الذرّة ذات السالبيّة الكهربائيّة الأصغر تُشحَن بشحنة جزئيّة موجبة أكبر. في حالة ذرّة الهيدروجين، فإنّها تبقى عمليًّا بدون إلكترون تقريبًا. بما أنه في الرابط التساهميّ لا يوجد فقدان كامل للإلكترونات/إعطاء إلكترونات (كما سنتعلّم لاحقًا، في الدروس التي تتناول موضوع الروابط الأخرى) بل انتقال جزئيّ للإلكترونات باتّجاه الذرّة ذات السالبيّة الكهربائيّة الأكبر – وهو انتقال متعلّق بالفرق في قيَم السالبيّة الكهربائيّة – من المتّبع أنّ نقول إنّ ذرّة الهيدروجين تتحوّل إلى ذرّة مكشوفة من الإلكترونات. كلّما كانت ذرّة الهيدروجين مكشوفة من الإلكترونات أكثر، تكون موجبة أكثر، وتنجذب بشكل أقوى إلى الشحنات السالبة.
يمكن أن نسأل ما السبب في أنّ ذرّة الكلور، ذات قيمة سالبيّة كهربائيّة مساوية لذرّة النيتروجين، أيّ 3، لا تسبّب نفس التأثير ولا تؤدّي إلى تكوين رابط هيدروجينيّ مع ذرّات الهيدروجين.
كما تذكرون من قانون كولوم، فإنّ أحد العوامل التي تؤثّر على قوّة التجاذُب الكهربائيّ بين الشحنات هو البُعد بينها. نصف قُطر ذرّة الكلور أكبر من ذرّة النيتروجين، لذلك التجاذُب بين زوج الإلكترونات غير الرابطة في ذرّة الكلور وذرّة الهيدروجين، المشحونة بشحنة جزئيّة موجبة، سيكون أضعف. ما يحدُث بين الجُزَيئات التي فيها رابط تساهميّ N—H، سيحدُث بقوّة أضعف بين الجُزَيئات التي فيها رابط تساهميّ Cℓ—H. هذا الرابط لا يسمّى رابطًا هيدروجينيًّا في تعلّم الكيمياء في المرحلة الثانويّة.
رأينا لغاية الآن أنّه لكي يتكوّن رابط هيدروجينيّ، نحتاج إلى ذرّة هيدروجين مكشوفة من الإلكترونات. ذرّة الهيدروجين هذه تتكوّن عندما تكون في جُزَيء معيّن ذرّة هيدروجين مرتبطة بذرّة ذات سالبيّة كهربائيّة كبيرة مثل الفلور، الأكسجين أو النيتروجين.
كيف يتكوّن التجاذُب بين الجُزَيئات؟
ذرّة الهيدروجين المشحونة بشحنة جزئيّة موجبة (بشكل نسبيّ شحنتها موجبة جدًا)، تنجذب إلى الشحنات السالبة، أيّ للإلكترونات غير الرابطة على الذرّات ذات سالبيّة كهربائيّة أكبر في جُزَيء آخر. بشكل عام، ستكون هذه ذرّات الفلور التي فيها ثلاثة أزواج إلكترونات غير رابطة، أو ذرّات الأكسجين التي فيها زوجا إلكترونات غير رابطة، أو ذرّات النيتروجين التي فيها زوج إلكترونات غير رابط واحد.
ما يميّز الرابط الهيدروجينيّ، مقارنةً بالتأثيرات المتبادلة ڤان در ڤالس، هو أنّ هناك اتّجاه للتجاذُب الكهربائيّ الذي يتكوّن في هذه الحالة. لذلك الرابط الهيدروجينيّ يبدو دائمًا كالتالي:
![]()
X – يمكن أن يكون كلّ واحدة من الذرّات N, O, F.
يظهر الاتّجاه بحيث إنّ الذرّات الثلاث الظاهرة في الرسم (X,H,X) موجودة بزاوية °180.
يبحث العلماء أيضًا الروابط الهيدروجينيّة التي تتكوّن مع ذرّات أخرى. هذه روابط هيدروجينيّة التجاذُب بينها أضعف.
بدايةً، نحاول أن نفهم كيف نحدّد أنّه بين جُزَيئات الماء توجد روابط هيدروجينيّة. الماء، H2O، هو مادّة جُزَيئيّة. نذكّركم أنّ العلامة المميِّزة هي أنّ المادّة مكوّنة من وحدات تُسمّى جُزَيئات؛ كلّ جُزَيء مكوّن من ذرّات لافلزّات مرتبطة ببعضها البعض برابط تساهميّ. كما تعلّمنا سابقًا، توجد بين جُزَيئات الماء تأثيرات متبادلة ڤان در ڤالس، بسبب حركة الإلكترونات والتقاطُبات التي تتكوّن داخل الجُزَيء. كلّ هذه الأمور تؤدّي إلى تجاذُب بين الجُزَيئات. لكن، بين جُزَيئات الماء توجد أيضًا روابط هيدروجينيّة تُعتبَر أقوى وأكثر سيطرةً، بالمقارنة مع التأثيرات المتبادلة ڤان در ڤالس. لذلك، بشكل عام، لن نذكر وجود التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الماء. في الرسم التالي، يظهر تمثيل لجُزَيء ماء في نموذج مالئ الفراغ:

كلّ ذرّة أكسجين مرتبطة برابط تساهميّ بذرّتَيّ هيدروجين. بما أنّ ذرّة الأكسجين هي ذات سالبيّة كهربائيّة كبيرة جدًا، فإنّ قوّة انجذابها لزوج الإلكترونات المشترك كبيرة جدًا، لذلك فإنّ ذرّة الهيدروجين تبقى مكشوفة من الإلكترونات. هذه الذرّة تنجذب إلى زوج إلكترونات غير رابط، الموجود على ذرّة أكسجين في جزيء ماء آخر، وهكذا دواليك.
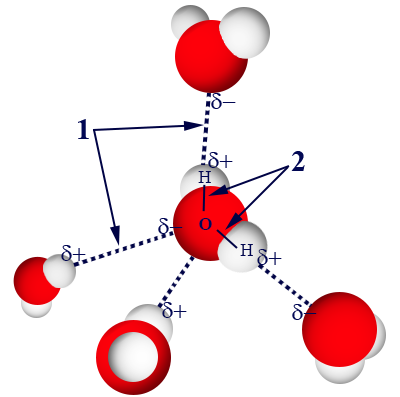
الرقم 1 يصف الروابط الهيدروجينيّة بين الهيدروجين المكشوف من الإلكترونات وبين الإلكترونات غير الرابطة في ذرّة الأكسجين في جُزَيء آخر. الرقم 2 يصف الرابط التساهميّ، داخل جُزَيئات الماء، بين ذرّة الهيدروجين وذرّة الأكسجين. انتبِهوا إلى أنّ الثلاثيّ ![]() נتقع على خطّ واحد، أيّ تتكوّن زاوية °180 بين الذرّات. بالإضافة إلى ذلك، الرابط التساهميّ (—) أقصر من الرابط الهيدروجينيّ (————)، لأنّه أقوى. سنشرح عن ذلك بتوسّع لاحقًا.
נتقع على خطّ واحد، أيّ تتكوّن زاوية °180 بين الذرّات. بالإضافة إلى ذلك، الرابط التساهميّ (—) أقصر من الرابط الهيدروجينيّ (————)، لأنّه أقوى. سنشرح عن ذلك بتوسّع لاحقًا.
االأمونيا هي مادّة جُزيئيّة. الأمونيا من وحدات تُسمّى جُزَيئات، وكلّ جُزَيء مُكوّن من ذرّات لافلزّات مرتبطة ببعضها البعض برابط تساهميّ. كما تعلّمنا سابقًا، توجد بين جُزَيئات الأمونيا تأثيرات متبادلة ڤان در ڤالس، بسبب حركة الإلكترونات؛ التقاطُبات التي تتكوّن داخل جُزَيء أمونيا واحد، تؤدّي إلى تجاذُب بينه وبين جُزَيئات أمونيا أخرى. لكن، بين جُزَيئات الأمونيا توجد أيضًا روابط هيدروجينيّة تُعتبَر أقوى وأكثر سيطرةً، بالمقارنة مع التأثيرات المتبادلة ڤان در ڤالس. لذلك، بشكل عام، لن نذكر وجود التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الأمونيا. في الرسم التالي، تظهر الصيغة البنائيّة لجُزَيء أمونيا: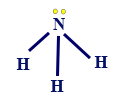 كلّ ذرّة نيتروجين مرتبطة برابط تساهميّ مع ثلاث ذرّات هيدروجين. بما أنّ قيمة السالبيّة الكهربائيّة لذرّة النيتروجين كبيرة جدًا، فإنّ انجذابه لزوج الإلكترونات المشترك مع كلّ واحدة من ذرّات الهيدروجين كبير جدًا. نتيجةً لذلك، تبقى ذرّات الهيدروجين مكشوفة من الإلكترونات. ذرّة الهيدروجين تنجذب إلى زوج إلكترونات غير رابطة، الموجود على ذرّة النيتروجين في جزيء أمونيا آخر، وهكذا دواليك.
كلّ ذرّة نيتروجين مرتبطة برابط تساهميّ مع ثلاث ذرّات هيدروجين. بما أنّ قيمة السالبيّة الكهربائيّة لذرّة النيتروجين كبيرة جدًا، فإنّ انجذابه لزوج الإلكترونات المشترك مع كلّ واحدة من ذرّات الهيدروجين كبير جدًا. نتيجةً لذلك، تبقى ذرّات الهيدروجين مكشوفة من الإلكترونات. ذرّة الهيدروجين تنجذب إلى زوج إلكترونات غير رابطة، الموجود على ذرّة النيتروجين في جزيء أمونيا آخر، وهكذا دواليك.
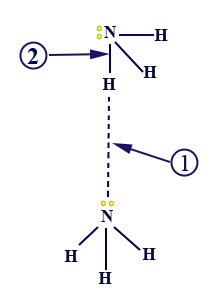
الرقم 1 يصف الروابط الهيدروجينيّة بين الهيدروجين المكشوف من الإلكترونات وبين الإلكترونات غير الرابطة في ذرّة النيتروجين في جُزَيء آخر. الرقم 2 يصف الرابط التساهميّ، بين ذرّة الهيدروجين وذرّة النيتروجين داخل جُزَيء الأمونيا.
الآن، سنرى ما هي العوامل التي تؤثّر على قوّة الرابط الهيدروجينيّ. هناك عاملان مؤثّران:
- عدد المراكز أو المواقع القادرة على تكوين رابط هيدروجينيّ بين الجُزَيئات؛
- قوّة الرابط الهيدروجينيّ المتعلّقة بالفرق في قيَم السالبيّة الكهربائيّة.
سنتطرّق إلى كلّ واحد من العوامل التي تؤثّر على قوّة الرابط الهيدروجينيّ، ونفهم مدى تعلُّق قوّة الرابط الهيدروجينيّ بهذا العامل. نذكّركم أنّه كلّما كانت الروابط بين الجُزَيئات أقوى، يكون التجاذُب بين الجُزَيئات أقوى، ودرجة غليان ودرجة انصهار المادّة ستكونان أعلى.
العامل 1: عدد المراكز/الإمكانيّات لتكوين رابط هيدروجينيّ بين الجُزَيئات
كلّما كوّنَت جُزَيئات المادّة روابط هيدروجينيّة أكثر بينها وبين نفسها، تكون الروابط بين الجُزَيئات أقوى.
نشبّه ذلك بجدار مبنيّ بطريقتَين:

أيّ جدار سيكون أصعب للفكّ؟
الإجابة هي الجدار “ب” لأنّ عدد الوصلات بين الألواح التي تكوّنه أكبر.
كذلك الأمر في الروابط الهيدروجينيّة.
كيف نعرف عدد الروابط الهيدروجينيّة التي يمكن لجُزَيء واحد أن يكوّنها مع جُزَيئات أخرى، أو عدد إمكانيّات الروابط الهيدروجينيّة نظريًّا؟
الإجابة هي أنّ العدد متعلّق بعدد المراكز الممكنة الموجودة في الجُزَيء ومتوسّط عدد الروابط الهيدروجينيّة التي يمكنه تكوينها.
لذلك، نعرّف ما هو مركز تكوين الروابط الهيدروجينيّة.
مركز تكوين الروابط الهيدروجينيّة هو:
- ذرّة هيدروجين مكشوفة من الإلكترونات؛
- أزواج إلكترونات غير رابطة، الموجودة على ذرّة فلور أو ذرّة نيتروجين أو ذرّة أكسجين.
اشرحوا: لماذا درجة غليان بيروكسيد الهيدروجين (H2O2) أعلى من درجة غليان الماء (H2O)؟
في المرحلة الأولى، نشير إلى أنّ المادّتَين هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد روابط هيدروجينيّة. نحدّد ذلك بحسب مبنى الجُزَيء. من لا يمكنه تخيُّل مبنى الجُزَيء، عليه أن يرسم الصيغة البنائيّة أو صيغة التمثيل الإلكترونيّ للجُزَيء، لكي يرى أنّ هناك ذرّة هيدروجين مرتبطة برابط تساهميّ بذرّة أكسجين. لهذا السبب، ذرّة الهيدروجين مكشوفة من الإلكترونات. بين جُزَيئات الماء توجد روابط هيدروجينيّة، وكذلك أيضًا بين جُزَيئات بيروكسيد الهيدروجين. لبيروكسيد الهيدروجين توجد 6 مراكز لتكوين روابط هيدروجينيّة بين الجُزَيئات، بينما للماء توجد 4 مراكز فقط. بكلمات أخرى، لبيروكسيد الهيدروجين توجد مراكز (إمكانيّات) أكثر لتكوين روابط هيدروجينيّة بين الجُزَيئات، لذلك، بين جُزَيئات بيروكسيد الهيدروجين ستتكوّن روابط هيدروجينيّة أكثر. سيكون من الأصعب تكوين هذه الروابط الهيدروجينيّة. نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات بيروكسيد الهيدروجين، لذلك درجة غليان بيروكسيد الهيدروجين ستكون أعلى.
انتبِهوا إلى أنّنا لم نذكر في هذه الحالة التأثيرات المتبادلة ڤان در ڤالس، لأنّنا نتحدّث عن جُزَيئات فيها التأثيرات المتبادلة بين الجُزَيئات هي روابط هيدروجينيّة. فيما بعد، سنرى أمثلة يجب فيها التطرّق إلى الروابط الهيدروجينيّة وأيضًا للتأثيرات المتبادلة ڤان در ڤالس.
لا حاجة لشرح سبب وجود روابط هيدروجينيّة في السؤال، فهذا لم يُطلب منكم. لو سُئِلتُم عن سبب وجود روابط هيدروجينيّة، لكان عليكم التطرّق إلى أنّه في كلّ واحد من الجُزَيئات، توجد ذرّة هيدروجين مكشوفة من الإلكترونات. وهذا لأنّ الهيدروجين مرتبط بالأكسجين الذي هو ذرّة ذات سالبيّة كهربائيّة كبيرة جدًا. لذلك، تنجذب ذرّة الهيدروجين إلى زوج الإلكترونات غير الرابط في ذرّة الأكسجين في جُزَيء آخر.
العامل 2: قوّة الرابط الهيدروجينيّ المتعلّقة بالفرق في قيَم السالبيّة الكهربائيّة
تعلّمنا في درس السالبيّة الكهربائيّة وقوّة الرابط، أنّه كلّما كان الرابط أكثر قطبيّةً، تكون الشحنات الكهربائيّة على الذرّات أكبر. عمليًّا، يمكن القول إنّ الذرّة الأقلّ سالبيّةً كهربائيّة (الهيدروجين في هذه الحالة)، تصبح أكثر انكشافًا من الإلكترونات، أيّ موجبة أكثر. لذلك، قوّة انجذابها الكهربائيّ إلى زوج الإلكترونات غير الرابطة في جُزَيء آخر تكون أقوى.
فيما يلي مثال:
للأمونيا (NH3) درجة غليان أصغر من الماء (H2O). لماذا؟
الأمونيا والماء هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد روابط هيدروجينيّة. للأمونيا توجد 4 مراكز لتكوين روابط هيدروجينيّة، وكذلك للماء توجد 4 مراكز كهذه، لكن درجة غليان الماء أعلى. هذا يعني أنّ الروابط الهيدروجينيّة بين جُزَيئات الماء أقوى. سنشرح هذه الحقيقة على النحو التالي: الهيدروجين الموجود في جُزَيء الماء أكثر انكشافًا من الإلكترونات لأنّ الرابط O—H هو أكثر قطبيّةً من الرابط N—H (الفرق في قيَم السالبيّة الكهربائيّة في الرابط O—H أكبر). لذلك، تتكوّن على الهيدروجين شحنة كهربائيّة موجبة نسبيّة جزئيّة أكبر، وقوّة انجذابه الكهربائيّ إلى زوج الإلكترونات غير الرابطة في ذرّة الأكسجين في جُزَيء آخر تكون أقوى. نستنتج من هنا أنّ الروابط الهيدروجينيّة بين جُزَيئات الماء أقوى، لذلك درجة غليانه أعلى.
الآن، سنرى مثالًا يدمج بين الموادّ الجُزَيئيّة والتأثيرات المتبادلة ڤان در ڤالس والروابط الهيدروجينيّة، ونحاول أن نرى أيّ رابط بين الجُزَيئات هو الأقوى.
اشرحوا: لماذا درجة غليان الأمونيا (NH3) أعلى من درجة غليان الإيثان (C2H6)؟
الأمونيا هي مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة، بينما الإيثان هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. سنفحص كِبَر سحابة الإلكترونات لغرض التمرين. لا حاجة لذِكر ذلك في الإجابة. سحابة الإلكترونات/عدد الإلكترونات الموجودة في جُزَيء الأمونيا هو 10، بينما سحابة الإلكترونات في الإيثان هي 18 إلكترونًا. أيّ، سحابة إلكترونات متشابهة. بما أنّه ليس هناك فرق كبير في سحابة الإلكترونات، يمكن القول أنّ الروابط الهيدروجينيّة بين جُزَيئات الأمونيا أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات الإيثان. لذلك، درجة غليان الأمونيا أعلى.
اشرحوا: لماذا درجة غليان CI4 أعلى من درجة غليان الماء (H2O)؟
الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة. CI4 هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. لـ CI4 يوجد 218 إلكترونًا، بينما للماء توجد 10 إلكترونات. بسبب كِبَرسحابة الإلكترونات في CI4، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها أقوى من الروابط الهيدروجينيّة بين جُزَيئات الماء. بالتالي، درجة غليانها أعلى.
في المثال الذي قمنا بحلّه الآن، وفي حالات أخرى أيضًا، من الصعب أن نقرّر أيّ قوّة بين الجُزَيئات هي الأقوى (الروابط الهيدروجينيّة أو التأثيرات المتبادلة ڤان در ڤالس)، وأيّ عامل يؤثّر أكثر. بشكل عام، الروابط الهيدروجينيّة تتفوّق بقوّتها على التأثيرات المتبادلة ڤان در ڤالس، طالما أنّه ليست هناك فوارق كبيرة جدًا في حجم سُحُب الإلكترونات. بشكل عام، عندما يكون الفرق في كِبَر سُحُب الإلكترونات كبيرًا جدًا، نجيب أنّه لا يمكن أن نحدّد بالتأكيد أيّ قوّة بين الجُزَيئات هي الأقوى، ونشرح السبب. أحيانًا، تكون المعطيات عن درجة الغليان ظاهرة في الأسئلة، وعلينا فقط أن نشرحها بواسطة الأدوات التي تعلّمناها لغاية الآن.
فيما يلي مثال لمثل هذه الحالة:
حدِّدوا لأيّ مادّة من بين المادّتَين H2O أو CCℓ4 درجة غليان أعلى.
أولًا، انتبهوا إلى أنّ المادّتين هما مادّتان جُزَيئيّتان. بين جُزَيئات الماء توجد روابط هيدروجينيّة، بينما بين جُزَيئات CCℓ4 توجد تأثيرات متبادلة ڤان در ڤالس. الروابط الهيدروجينيّة أقوى من التأثيرات المتبادلة ڤان در ڤالس، لكن بما أنّه في جُزَيء الماء توجد 10 إلكترونات وفي جُزَيء CCℓ4 يوجد 74 إلكترونًا (أيّ أكثر بـ 7.4 ضعف)، فإنّ التأثيرات المتبادلة ڤان در ڤالس تصبح أقوى لذلك لا يمكن أن نحدّد في أيّ مادّة تكون الروابط بين الجُزَيئات أقوى، ولأيٍّ منهما توجد درجة غليان أعلى.
لو قيلَ لنا إنّ درجة غليان الماء (H2O) أعلى من درجة غليان CCℓ4 ، كنّا سنشرح ذلك بالقول إنّ الروابط الهيدروجينيّة أقوى بين جُزَيئات الماء بالمقارنة مع التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CCℓ4.
لو قيلَ لنا إنّ درجة غليان CCℓ4 أعلى من درجة غليان الماء، كنّا سنشرح ذلك بالقول إنّ التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CCℓ4 أقوى بالمقارنة مع الروابط الهيدروجينيّة بين جُزَيئات الماء. سحابة الإلكترونات في CCℓ4 أكبر بكثير من سحابة الإلكترونات في جُزَيء الماء، لذلك التأثيرات المتبادلة ڤان در ڤالس تصبح أقوى من الروابط الهيدروجينيّة بين جُزَيئات الماء.
نشير فقط إلى أنّه في حالة الماء بالمقارنة مع CCℓ4، درجة غليان الماء أعلى. هذا يعني أنّ الروابط الهيدروجينيّة بين جُزَيئات الماء أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CCℓ4 برغم الفرق الكبير في سُحُب الإلكترونات.
أسئلة كمثال
- في الجدول التالي، تظهر أزواج موادّ ودرجات غليانها. اشرحوا باختصار، لماذا درجة غليان إحدى المادّتَين في كلّ زوج أعلى من درجة غليان المادّة الأخرى.
| الرقم التسلسليّ | المادّة A | المادّة B | العامل/العوامل المسبّبة للفرق | ||
| الصيغة الجُزَيئيّة | درجة الغليان (ºC) | الصيغة الجُزَيئيّة | درجة الغليان (ºC) | ||
| 1 | HF | 20 | HCℓ | 85- | |
| 2 | HF | 20 | HBr | 67- | |
| 3 | HF | 20 | H2O | 100 | |
| 4 | NH3 | 33- | N2H4 | 114 | |
| 5 | N2H4 | 114 | H2O2 | 150 | |
| الرقم التسلسليّ | المادّة A | المادّة B | العامل/العوامل المسبّبة للفرق | ||
| الصيغة الجُزَيئيّة | درجة غليان C° | الصيغة الجُزَيئيّة | درجة الغليان C° | ||
| 1 | HF | 20 | HCℓ | 85- | الروابط الهيدروجينيّة أقوى من التأثيرات المتبادلة ڤان در ڤالس |
| 2 | HF | 20 | HBr | 67- | الروابط الهيدروجينيّة أقوى من التأثيرات المتبادلة ڤان در ڤالس |
| 3 | HF | 20 | H2O | 100 | عدد الروابط الهيدروجينيّة التي يمكن أن تتكوّن أكبر، لكن ليس عدد المراكز. |
| 4 | NH3 | 33- | N2H4 | 114 | عدد المراكز لتكوين الروابط الهيدروجينيّة أكبر |
| 5 | N2H4 | 114 | H2O2 | 150 | قوّة الرابط الهيدروجينيّ الذي تكوّنَ مع ذرّة الأكسجين أقوى، لأنّ الرابط أكثر قطبيّةً، والهيدروجين أكثر انكشافًا من الإلكترونات، لذلك فهو مشحون بشحنة جزئيّة موجبة أكبر. |
- سؤال 2
- اكتبوا التمثيل الكامل للصيغة البنائيّة لحامض البوريك B(OH)3.
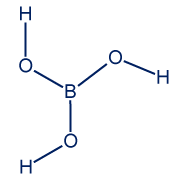
- اشرحوا: لماذا درجة غليان حامض البوريك أعلى من درجة غليان الماء (H2O)؟
من خلال المقارنة بين حامض البوريك والماء، نلاحظ أنّ كلتيهما مادّتان جُزَيئيّتان. توجد روابط هيدروجينيّة بين جزيئياتهما. لحامض البوريك توجد إمكانيّات أكثر لتكوين روابط هيدروجينيّة بين الجُزَيئات، لذلك، الروابط بين الجُزَيئات في حامض البوريك أقوى. من هنا، درجة غليان حامض البوريك أعلى.
- اشرحوا: لماذا درجة غليان حامض البوريك أعلى من درجة غليان الماء CBr4؟
من خلال المقارنة بين حامض البوريك و- CBr4 ، نلاحظ أنّ كلتيهما مادّتان جُزَيئيّتان. بين جُزَيئات حامض البوريك توجد روابط هيدروجينيّة. بين جُزَيئات CBr4 توجد تأثيرات متبادلة ڤان در ڤالس. التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CBr4 أضعف من الروابط الهيدروجينيّة بين جُزَيئات حامض البوريك، لذلك نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات حامض البوريك، ودرجة غليان حامض البوريك أعلى.
في الدرس القادم، سنرى المزيد من الأمثلة عن التأثيرات المتبادلة بين الجُزَيئات، علاقتها بدرجة غليان الموادّ المختلفة، وبحالة الموادّ في درجة حرارة الغرفة. هناك صفات أخرى تتأثّر من هذه التأثيرات المتبادلة، وهي الذائبيّة بين الموادّ الجُزَيئيّة والتوصيل الكهربائيّ في المحلول.
