פתרון בגרות בכימיה 2024
השאלות
פרק ראשון (40 נקודות)
- בסעיפים א–ד בטבלה שלפניכם מוצגים נתונים על ארבעה אטומים שונים.
באיזה סעיף המידע הנתון תואם במלואו?מיקום אטום היסוד
בטבלה המחזוריתהיערכות
אלקטרוניםנוסחת ייצוג
אלקטרוניםטור שורה א 7 2 2,7 
ב 2 3 2,2,2 
ג 3 2 2,8,3 
ד 4 2 2,4 
הסבר
לאטום של היסוד יש שתי רמות אנרגייה המאוכלסות באלקטרונים על פי היערכות האלקטרונים שנתונה. לכן הוא בשורה השנייה ויש לו 4 אלקטרוני ערכיות על סמך נוסחת ייצוג האלקטרונים שלו. לפיכך הוא בטור הרביעי. - לפניכם נוסחאות מולקולריות של ארבע מולקולות: CS2, C2H2, C2Cℓ2, CO2.
המבנה של כל אחת מהן הוא קווי.
מה ההיגד הנכון?- בכל אחת מן המולקולות הנתונות יש קשר קוולנטי יחיד.
- רק בשתיים מן המולקולות הנתונות יש קשרים קוולנטיים כפולים.
- הקשר בין אטום פחמן לבין אטום גופרית במולקולה CS2 קוטבי יותר מן הקשר בין אטום פחמן ובין אטום חמצן במולקולה CO2.
- הקשרים בין אטומי הפחמן במולקולה C2H2 הם קשרים קוולנטיים טהורים, אך המולקולה היא קוטבית.
הסבר
לפי הייצוג המלא של נוסחת המבנה של ארבע המולקולות אפשר לראות שרק לשתיים מהן יש קשרים קוולנטיים כפולים.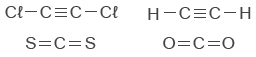
- מבין המולקולות א-ד שלפניכם, איזו מולקולה יכולה ליצור קשרי מימן גם עם מולקולות מים, H2O, וגם עם מולקולות אצטון, CH3COH3?
- CH3CH2OCH2CH3
- CH3CH(OH)CH2CH3
- CH3CH2CHFCH2CH3
- (CH3)2CHF
הסבר
בין המולקולות של חומר ב יש קשרי מימן ואינטראקציות ון־דר־ולס. לכן יכולים להיווצר קשרי מימן בין המולקולות שלו למולקולות המים, ויכולים להיווצר קשרי מימן בין מולקולות חומר ב (שמכיל אטום מימן חשוף מאלקטרונים בקבוצת OH) ובין מולקולות האצטון (עם זוג אלקטרונים לא קושר על אטום החמצן במולקולת האצטון). - טמפרטורת הרתיחה של מים, H2O(ℓ), גבוהה מטמפרטורת הרתיחה של מימן גופרי H2S(ℓ).
מהי הסיבה העיקרית לכך?- ענן האלקטרונים של מולקולת מימן גופרי גדול מענן האלקטרונים של מולקולת מים.
- אינטראקציות ון־דר־ולס בין מולקולות מימן גופרי במצב נוזלי חלשות מאינטראקציות ון־דר־ולס בין מולקולות מים במצב נוזלי.
- בין מולקולות מימן גופרי במצב נוזלי יש בעיקר אינטראקציות ון־דר־ולס ואילו בין מולקולות מים במצב נוזלי יש בעיקר קשרי מימן.
- קשרי המימן בין מולקולות מימן גופרי במצב נוזלי חלשים מקשרי המימן בין מולקולות המים במצב נוזלי.
הסבר
קשרי המימן בין מולקולות המים חזקים מאינטראקציות הון־דר־ולס שיש בין מולקולות המימן הגופרי. לפיכך יש להשקיע יותר אנרגייה בפירוק קשרי המימן בין מולקולות המים. לכן טמפרטורת הרתיחה של המים גבוהה יותר. - לכוס המכילה מים מזוקקים הכניסו חומר מסוים, והתקבלה תמיסה. הוספת החומר למים לא גרמה לשינוי ב- pH.
מהו החומר שהוסיפו למים?- C2H5OH(ℓ)
- CH3COOH(ℓ)
- HBr(g)
- KOH(s)
הסבר
חומר א (C2H5OH(ℓ)) הוא כוהל ובהוספתו למים לא נוצרים יוני הידרוניום או יוני הידרוקסיד, ולכן אין שינוי ב- pH. - ערכו ארבעה ניסויים כמפורט בטבלה שלפניכם.
בכל אחד מן הניסויים לקחו 100 מ”ל תמיסה מקורית ובדקו את ערך ה- pH שלה.
הוסיפו לתמיסה המקורית 100 מ”ל תמיסה אחרת (ראו איור), ערבבו, ובדקו את ערך ה- pH של התמיסה שהתקבלה.
הריכוז של כל אחת מן התמיסות לפני הערבוב היה 1M.ניסוי התמיסה המקורית התמיסה שהוסיפו 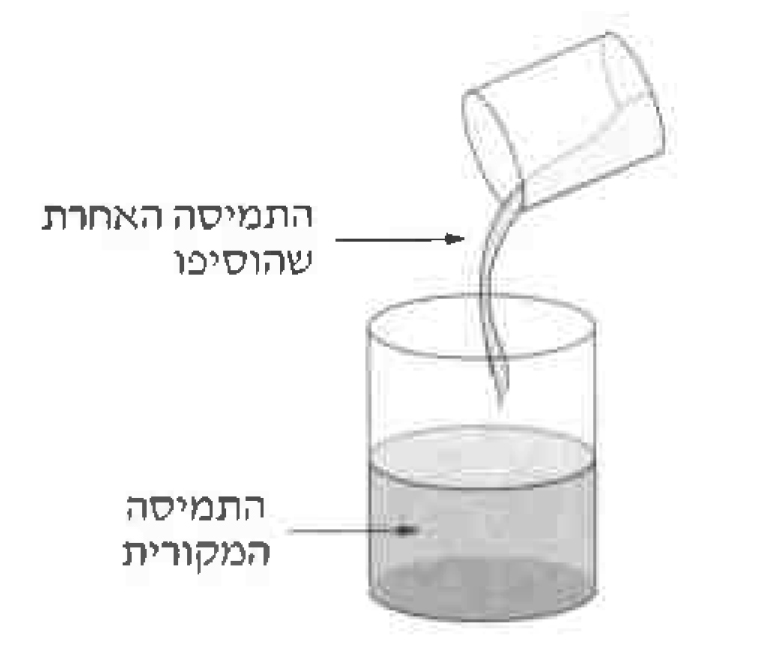
1 HCℓ(aq) H2SO4(aq) 2 NaOH(aq) HCℓ(aq) 3 Ba(OH)2(aq) NaOH(aq) 4 H2SO4(aq) Ba(OH)2(aq) נמצא כי ערך ה- pH של התמיסה שהתקבלה היה שונה מזה של התמיסה המקורית.
מבין ארבע האפשרויות א-ד, מהי האפשרות הנכונה?- בניסוי 1 ערך ה- pH של התמיסה שהתקבלה היה גבוה מזה של התמיסה המקורית.
- בניסוי 2 ערך ה- pH של התמיסה שהתקבלה היה גבוה מזה של התמיסה המקורית.
- בניסוי 3 ערך ה- pH של התמיסה שהתקבלה היה נמוך מזה של התמיסה המקורית.
- בניסוי 4 ערך ה- pH של התמיסה שהתקבלה היה נמוך מזה של התמיסה המקורית.
הסבר
התמיסה המקורית מכילה יוני הידרוקסיד בריכוז 2M. לתמיסה מוסיפים תמיסה שבה ריכוז יוני ההידרוקסיד הוא נמוך יותר (1M). לכן הוספת בסיס בריכוז נמוך יותר תמהל את התמיסה המקורית, ריכוז יוני ההידרוקסיד החדש יהיה נמוך יותר וערך ה- pH החדש יהיה נמוך יותר.OH–(aq) Ba(OH)2(aq) 2 : 1 יחס מולים 2 1 (M) C 0.1 0.1 V (ליטר) 0.2 0.1 n (מול) הוסיפו:
OH–(aq) NaOH(aq) 1 : 1 יחס מולים 1 (M) C 0.1 V (ליטר) 0.1 0.1 n (מול) כעת נחשב את הריכוז החדש של יוני ההידרוקסיד.
מכיוון שריכוז יוני הידרוקסיד ירד מ- 2M ל- 1.5M אפשר לקבוע שערך ה-pH בתמיסה שהתקבלה לאחר הערבוב נמוך מהערך ה- pH של התמיסה המקורית.
- נתונות נוסחאות מולקולריות של כמה מולקולות המכילות אטום חנקן (N):
HNO3, N2O, N2O5, NO2, N2O4, NO
מהו ההיגד הנכון?- במולקולות N2O ו- NO אטומי החנקן יכולים לעבור תהליך חמצון בלבד.
- במולקולות HNO3 ו- N2O5 אטומי החנקן יכולים לעבור תהליך חיזור בלבד.
- כאשר מולקולות N2O4 נוצרות ממולקולות NO2, אטומי החנקן עוברים תהליך חיזור.
- כאשר מולקולות NO2 נוצרות ממולקולות NO, אטומי החנקן עוברים תהליך חיזור.
הסבר
דרגת החמצון המינימלית של חנקן היא 3-. כשהחנקן בדרגת חמצון 3- הוא יכול לשמש רק כמחזר. דרגת החמצון המקסימלית של החנקן היא 5+. כשהחנקן בדרגת חמצון 5+ הוא יכול לשמש רק כמחמצן.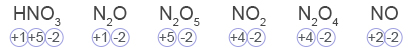 לכן אטומי N בחומרים HNO3 ו- N2O5 שנמצאים בדרגת החמצון המקסימלית שלהם, יכולים לשמש רק כמחמצנים ולעבור תהליך חיזור בלבד.
לכן אטומי N בחומרים HNO3 ו- N2O5 שנמצאים בדרגת החמצון המקסימלית שלהם, יכולים לשמש רק כמחמצנים ולעבור תהליך חיזור בלבד. - נתון ייצוג מקוצר של נוסחת המבנה של מולקולת טריגליצריד:
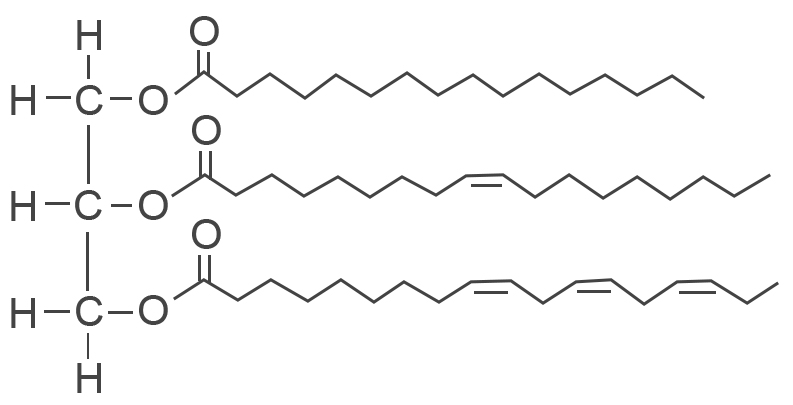 מה הן חומצות השומן המרכיבות את הטריגליצריד הנתון?
מה הן חומצות השומן המרכיבות את הטריגליצריד הנתון?- C16:0, C18: 1ω9cis, C18: 3ω3cis,cis,cis
- C15:0, C17: 1ω9cis, C17: 3ω3cis,cis,cis
- C15:0, C17: 1ω9trans, C17: 3ω3trans,trans,trans
- C16:0, C18: 1ω9trans, C18: 3ω3trans,trans,trans
הסבר
על סמך ספירת הפחמנים, מספר הקשרים הכפולים, מיקומם וסוג האיזומריה הגאומטרית שלהם, אפשר לדעת מה הן חומצות השומן המרכיבות את הטריגליצריד.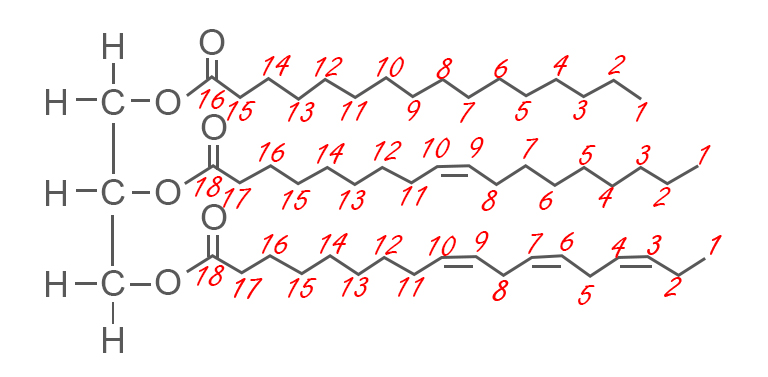
ניתוח קטע ממאמר מדעי – חובה
- קראו את הקטע שלפניכם, וענו על הסעיפים שאחריו לפי ההנחיות (שאלת חובה – 20 נקודות).
Ag(s) H2S(g) 2 : 1 יחס מולים 6.02×1017 N (מולקולות) 6.02×1023 NA 2×10-6 1×10-6 n (מול) 107.9 Mw (גרם/מול) 2.158×10-4 m (גרם) יגיבו 2.158×10-4 גרם של כסף.
- בין מולקולות ה- TMA פועלות אינטראקציות ון־דר־ולס שהן חזקות מקשרי המימן שיש בין מולקולות האמוניה, בשל ההבדל הגדול בענן האלקטרונים ביניהן (למולקולת TMA ענן אלקטרונים גדול הרבה יותר מענן האלקטרונים של אמוניה). לכן נדרשת אנרגייה רבה יותר לפירוק אינטראקציות הון־דר־ולס בין מולקולות TMA, וטמפרטורת הרתיחה שלו גבוהה יותר.
- בין מולקולות DMA יש אינטראקציות ון־דר־ולס וקשרי מימן, אבל ענן האלקטרונים של מולקולת DMA קטן מענן האלקטרונים של מולקולת TMA, שבין המולקולות שלה יש רק אינטראקציות ון־דר־ולס. השילוב בין קשרי המימן ואינטראקציות הון־דר־ולס בין מולקולות ה-DMA דומה בעוצמתו לאינטראקציות הון־דר־ולס בין מולקולות TMA. לפיכך האנרגייה שנדרשת לפירוק הקשרים בין מולקולות ה- DMA והאנרגייה הנדרשת לפירוק הקשרים בין מולקולות TMA די דומות, ולכן טמפרטורת הרתיחה של DMA קרובה לטמפרטורת הרתיחה של TMA.
- הניסוח הנכון הוא ניסוח II. במאמר צוין שתרכובות אלה מגיבות עם המים ומתקבלת תמיסה בסיסית. לכן נוצרים יוני הידרוקסיד (OH–(aq)) – יש בתמיסה עודף יוני הידרוקסיד. מסקנה: ניסוח II הוא הנכון.
- יתקבל צבע ירוק. כשדגים מתקלקלים נוצרות תרכובות שמגיבות עם המים ויוצרות תמיסה בסיסית. לכן הצבע הכחול יהפוך לירוק.
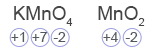
ניתן לראות שאטומי Mn שינו את דרגת חמצון מ- 7+ ל- 4+, הם ירדו בדרגת החמצון, קיבלו אלקטרונים ועברו תהליך חיזור, ולכן החומר KMnO4 הוא מחמצן.- בין מולקולות האתילן ובין מולקולות המים לא נוצרים קשרי מימן או אינטראקציות ון־דר־ולס, ולכן אתילן לא נמס במים.
פרק שני (60 נקודות)
ענו על שלוש מן השאלות 14-10 (לכל שאלה 20 נקודות).
10. מבנה האטום, מבנה וקישור
- א
- Z הוא איזוטופ של גופרית. איזוטופים הם אטומים בעלי מספר פרוטונים זהה (מספר אטומי), אבל מספר נויטרונים שונה.
אטום Z הוא היחיד שמכיל 16 פרוטונים. - S 2, 8, 6
- Z הוא איזוטופ של גופרית. איזוטופים הם אטומים בעלי מספר פרוטונים זהה (מספר אטומי), אבל מספר נויטרונים שונה.
- ב
- הקשרים בין אטומי S הם קשרים טהורים, ההפרש בערכי האלקטרושליליות בין האטומים בקשרים הללו הוא 0.
- לאטום גופרית יש שני אלקטרונים לא מזווגים, ולכן הוא משתף שני אלקטרונים. כיוון שכל אטום גופרית קשור לשני אטומי גופרית אחרים, הוא ייצור שני קשרים קוולנטים יחידים. אטום הגופרית ישתף עם כל אטום גופרית אחר רק זוג אלקטרונים אחד, קשר קוולנטי יחיד.
- למולקולת גופרית ענן אלקטרונים גדול מענן האלקטרונים של מולקולת זרחן. לכן אינטראקציות הון־דר־ולס בין מולקולות הגופרית חזקות יותר, ונדרשת אנרגייה רבה יותר לפירוק הקשרים בין מולקולות הגופרית.
- בין מולקולות הגופרית למולקולות ההקסאן נוצרות אינטראקציות ון־דר־ולס. לכן גופרית נמסה בהקסאן.
- ה
- Na2S(s)

- 16Na(s) + S8(s) → 8Na2S(s)
- S8(s) + 8O2(g) → 8SO2(g)
11. חומצות שומן
- כתבו במחברתכם את פרטי המידע 1, 2, 3, 4, 5 החסרים בטבלה (ראו פריטים מסומנים בצהוב).
שם חומצת השומן ייצוג מקוצר של נוסחת המבנה של המולקולה רישום מקוצר של חומצת השומן חומצה מיריסטית 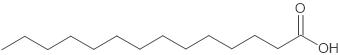
C14:0 חומצה בוטירית 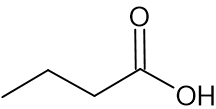
C4:0 חומצה אולאית 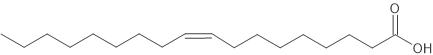
C18: 1ω9 cis חומצה לינולאית 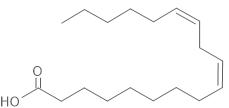
C18:2 ω 6 all cis - החומצה האולאית.
- לחומצה האולאית טמפרטורת היתוך גבוהה יותר. הגורם הוא דרגת הרוויון.
- לחומצה מיריסטית טמפרטורת היתוך גבוהה יותר. הגורם הוא אורך השרשרת (גודל ענן האלקטרונים, מספר אטומי הפחמן).
- חומצה בוטירית.
- ו
- החומצה האולאית היא חומצת שומן חד בלתי רוויה והחומצה הלינולאית היא חומצת שומן רב בלתי רוויה (שתי החומצות מכילות קשרי C=C). קשרים אלה במולקולות חומצת השומן מגיבים עם מולקולות המימן בתהליך ההידרוגנציה.
- C4:0, C14:0, C18:0
- בחומצת השומן האולאית יחס המולים למימן הוא 1:1, ולכן לכל מול חומצה אולאית יידרש 1 מול גז מימן.
בחומצת השומן הלינולאית יחס המולים למימן הוא 1:2, ולכן לכל מול חומצה אולאית יידרשו 2 מול גז מימן.
בסך הכל יידרשו 3 מול גז מימן.
12. חומצות ובסיסים, חישובים
- HCℓ(g) + H2O(ℓ) → H3O+(aq) + Cℓ–(aq)
- n = C × V = 2.5 × 0.1 = 0.25 mol
m = n × Mw = 0.25× 36.5 = 9.125gram
צריך 9.125 גרם.
- H3O+(aq) + OH–(aq) → 2H2O(ℓ)
H3O+(aq) H2SO4(aq) 2 : 1 יחס מולים 1 (M) C 0.0125 V (ליטר) 0.025 0.0125 n (מול) OH–(aq) H3O+(aq) 1 : 1 יחס מולים 0.025 0.025 n (מול) NaOH(aq) OH–(aq) 1 : 1 יחס מולים 0.025 0.025 n (מול) 0.02 V (ליטר) 1.25 (M) C ריכוז תמיסת מסיר השומנים הוא 1.25M.
- קבוצה 1.
- ערך ה-pH יהיה גבוה יותר. מתרחשת תגובה בין יוני ההידרוניום לאבנית. מספר המולים של יוני ההידרוניום יקטן, ונפח התמיסה לא ישתנה (הוסיפו מוצק לתמיסה). לכן ריכוז יוני ההידרוניום יפחת, וערך ה-pH בתום התגובה יהיה גבוה מערך ה-pH בתמיסת הלימון שהכינו.
13. חמצון־חיזור, מבנה וקישור
- א
- סליל הנחושת מוליך חשמל כי נחושת מוצקה היא מתכת ויש בה אלקטרונים ניידים.
- הכסף החנקתי הוא חומר יוני ותמיסת הכסף החנקתי מוליכה חשמל, מכיוון שיש בתמיסה יונים ממוימים ניידים.
- 2Ag+(aq) + Cu(s) → Cu2+(aq) + 2Ag(s)
- 3Cu2+(aq) + 2Fe(s) → 2Fe3+(aq) + 3Cu(s)
- המגנזיום הוא המחזר הטוב ביותר כי אף מתכת מהמתכות שבשאלה אינה מוסרת אלקטרונים ליונים של המגנזיום, ולא גורמת ליוני מגנזיום (Mg2+(aq)) לעבור תהליך חיזור.
לפי סעיף ג אפשר לקבוע שהמתכת ברזל (Fe(s)) מחזרת טובה יותר מהנחושת (Cu(s)), כי בתגובה בין הברזל המוצק ובין יוני הנחושת, המתכת ברזל העבירה אלקטרונים ליוני הנחושת, (התרחשה תגובת חמצון־חיזור ביניהם).
לכן הרצף היחיד שמתאים הוא דירוג I.- Mg(s) > Fe(s) > Cu(s) > Ag(s)
- Ag(s) > Cus) > Fe(s) > Mg(s)
- Mg(s) > Cu(s) > Ag(s) > Fe(s)
- ה
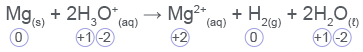
ההיגד נכון. אטומי המימן ביוני ההידרוניום (H3O+(aq)) הם בדרגת חמצון 1+ והם יורדים בדרגת החמצון ל- 0. הם מקבלים אלקטרונים. זהו תהליך חיזור. לכן המימן הוא תוצר של תהליך חיזור.- ההיגד לא נכון. אפשר לראות שאין שינויים בדרגות החמצון של אטומי החמצן בתגובה.
- ו
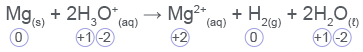
ההיגד לא נכון כי אטומי המימן (H) ואטומי החמצן (O) במולקולות המים לא עברו שינוי בדרגת החמצון יחסית למגיבים.- ההיגד נכון. אטומי Mg במגיבים הם בדרגת חמצון 0, ואילו בתוצרים 2+. חלה עלייה בדרגת החמצון של המגנזיום. כלומר, המגנזיום במגיבים מסר אלקטרונים ועבר תהליך חמצון. לכן Mg2+(aq) הוא תוצר של תהליך חמצון.
14. חישובים
מספר המולים הוא 0.004 מול של AgCℓ(s)
Cℓ–(aq) AgCℓ(s) 1 : 1 יחס מולים 0.004 0.004 n (מול) ב- 40 מ”ל של התמיסה יש 0.004 מול של יוני כלור (Cℓ–(aq)).
לכן ב- 200 מ”ל תמיסה פי 5 בנפח) מספר המולים גם יהיה פי 5 ממספר המולים של יוני הכלור הנמצאים ב- 40 מ”ל של אותה התמיסה (התמיסה והדגימה בריכוז זהה). כלומר,
0.004 × 5 = 0.02 moℓ
אפשר לחשב גם כך:
הריכוז בתמיסת הדגימה הוא:הריכוז בתמיסה המקורית זהה לריכוז בדגימה, ולכן:
n = C × V = 0.1 × 0.2 = 0.02 moℓNaCℓ(s) Cℓ–(aq) 1 : 1 יחס מולים 0.02 0.02 n (מול) 58.5 Mw (גרם/מול) 1.17 m (גרם) בתערובת המוצקים יש 1.17 גרם של NaCℓ(s).
- ו
Na+(aq) NaCℓ(s) 1 : 1 יחס מולים 0.02 0.02 n (מול) Na+(aq) Na2SO4(s) 2 : 1 יחס מולים 0.02 0.01 n (מול) ריכוז יוני הנתרן הוא 0.2M.
- מצאנו שב- 200 מ”ל תמיסה המסו 0.01 מול של Na2SO4(s).
מכיוון שחילקו ב- 5, ב- 40 מ”ל תמיסה יהיו 0.002 מול של המומס Na2SO4(s).SO4-2(aq) Na2SO4(s) 1 : 1 יחס מולים 0.002 0.002 n (מול) BaSO4(s) SO4-2(aq) 1 : 1 יחס מולים 0.002 0.002 n (מול) 233.4 Mw (גרם/מול) 0.4668 m (גרם) יתקבלו 0.4668 גרם של BaSO4(s).
בהצלחה!
