פתרון בגרות בכימיה 2023
- בטבלה שלפניכם מוצגים נתונים על ההרכב של שלושה חלקיקים שמסומנים באופן שרירותי באותיות X, Y, Z.
החלקיק מספר פרוטונים מספר נויטרונים היערכות אלקטרונים X 18 18 2,8,8 Y 17 18 2,8,8 Z 18 20 2,8,8 מהי הקביעה הנכונה?
- המטען של הגרעין בחלקיקים X ו- Y הוא זהה.
- לכל אחד משלושת החלקיקים X, Y, ו-Z אין מטען חשמלי.
- החלקיקים X ו- Z הם איזוטופים של אותו יסוד.
- שלושת החלקיקים X, Y ו- Z הם אטומים של יסודות שונים.
הסבר
לחלקיקים X ו- Z אותו מספר פרוטונים ומספר נויטרונים שונה לכן הם איזוטופים. - לפניכם הנוסחאות המולקולריות של ארבע מולקולות: CℓCN , CO2, C2Cℓ2 , CS2.
המבנה של כל אחת מן המולקולות הוא קווי.
לפניכם ארבעה היגדים, א-ד, בעניין הקשרים הקוולנטיים במולקולות וקוטביות המולקולות.
מהו ההיגד הנכון?- בכל המולקולות, כל הקשרים הקוולנטיים הם קוטביים.
- המולקולות C2Cℓ2 ו- CO2 הן קוטביות.
- במולקולות CS2 ו- CO2 יש קשרים קוולנטיים יחידים.
- במולקולות CℓCN ו- C2Cℓ2 יש קשר קוולנטי משולש.
הסבר
- ערבבו בכוס כימית 200 מ”ל תמיסת נתרן כלורי, NaCℓ(aq), בריכוז 0.4M,
עם 200 מ”ל תמיסת אלומיניום כלורי, AℓCℓ3(aq), בריכוז 0.4M.
מהו הריכוז המולרי של כל אחד מן היונים בתמיסה שהתקבלה בתום הערבוב?Cℓ¯(aq) Aℓ3+(aq) Na+(aq) א. 0.8M 0.2M 0.2M ב. 0.8M 0.4M 0.4M ג. 0.4M 0.4M 0.4M ד. 0.2M 0.2M 0.2M הסבר
ראשית נחשב את מספר המולים שיש מכל אחד מהיונים בכל אחת מהתמיסות:Cℓ¯(aq) Na+(aq) NaCℓ(aq) 1 1 1 יחס מולים 0.2 V (ליטר) 0.4 (M) C 0.08 0.08 0.08 n (מספר מולים) Cℓ¯(aq) Aℓ3+(aq) AℓCℓ3(aq) 3 1 1 יחס מולים 0.2 V (ליטר) 0.4 (M) C 0.24 0.08 0.08 n (מספר מולים) כעת נחשב את הריכוז של כל אחד מהיונים בתמיסה החדשה:
Cℓ¯(aq) Aℓ3+(aq) Na+(aq) 0.32 0.08 0.08 n (מספר מולים) 0.4 0.4 0.4 V (ליטר) 0.8 0.2 0.2 (M) C - המודלים שלפניכם מייצגים את נוסחאות המבנה של שתי מולקולות המסומנות באופן שרירותי a ו- b.
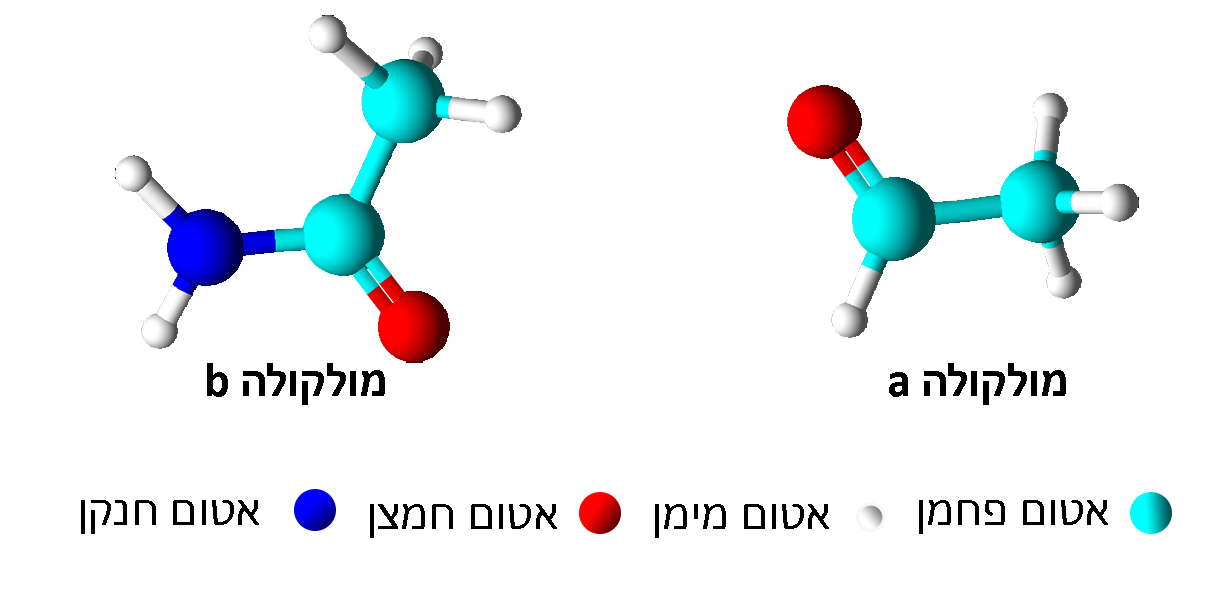 לפניכם ארבעה היגדים I-IV.
לפניכם ארבעה היגדים I-IV.
I. במולקולה a הקבוצה הפונקציונלית היא קטון.
II. במולקולה b הקבוצה הפונקציונלית היא אמיד.
III. בין מולקולות a עשויים להיווצר גם קשרי מימן.
iV. בין מולקולות b עשויים להיווצר גם קשרי מימן.
מה הם ההיגדים הנכונים?- I ו- II
- II ו- III
- I ו- IV
- II ו- IV
הסבר
קבוצת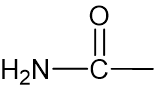 היא אמיד. ובמקרה הזה ישנם אטומי מימן חשופים מאלקטרונים ולכן יכולים להיווצר קשרי מימן בין המולקולות.
היא אמיד. ובמקרה הזה ישנם אטומי מימן חשופים מאלקטרונים ולכן יכולים להיווצר קשרי מימן בין המולקולות. - שעוות הנרות עשויה בעיקר מפחמימן שנוסחתו המולקולרית היא C25H52 (מסה מולרית: ).
לפניכם תגובת השרפה המלאה של אדי הפחמימן בעת בעירת הנר:
C25H52(g) + 38O2(g) → 25CO2(g) + 26H2O(g)
נמצא שכמות האנרגייה שנפלטה בתגובת השרפה של 1.76 גרם C25H52(g) שווה ל- 77.825kJ.
מהו שינוי האנתלפיה התקנית, ΔH0, בתגובת השרפה של 1 מול C25H52(g)?- 15,565kJ+
- 15,565kJ-
- 77,825kJ+
- 77,825kJ-
הסבר
נחשב כמה מול מהפחמימן הגיבו:עכשיו באמצעות חישוב ערך משולש נחשב את שינוי האנתלפיה התקנית, ΔH0, בתגובת השרפה של 1 מול C25H52(g)
אנרגייה (kJ) (מול)
77.825 0.005 15,565 1 לכן: ΔH0 = -15,565kJ
- לפניכם התגובות (1) – (3):
(1) C(s) + 2H2(g) → CH4(g) ΔH01 = -74.8kJ
(2) C(s) + 2H2(g) + O2(g) → CH3OH(ℓ) ΔH02 = -238.9kJ(3) CH4(g) + O2(g) → CH3OH(ℓ) ΔH03 =?
מהו ערכו של ΔH03 עבור תגובה (3)?
- 313.7kJ-
- 313.7kJ+
- 164.1kJ-
- 164.1kJ+
הסבר
את תגובה (1) יש לכפול ב: 1- (להפוך את התגובה)
את תגובה (2) יש לכפול ב: 1CH4(g) →
C(s)+2H2(g) ΔH01 = 74.8kJC(s)+2H2(g)+ O2(g) → CH3OH(ℓ) ΔH02 = -238.9kJCH4(g) + O2(g) → CH3OH(ℓ) ΔH03 =-164.1kJ
- תלמידים ערכו כמה ניסויים, ובהם הם טבלו פסים של 3 מתכות שונות בתמיסות המכילות יוני מתכות. בכל ניסוי הם טבלו פס של מתכת אחת בתמיסה מימית שהכילה יונים של מתכות אחרות (וגם יונים שליליים).
בטבלה שלפניכם מצוין בנוגע לכל אחד מן הניסויים אם התרחשה בו תגובה (+) או שלא התרחשה בו תגובה (-).יוני מתכות
מתכות
Ba2+(aq) Zn2+(aq) Pb2+(aq) בריום Ba(s) + + אבץ Zn(s) – + עופרת Pb(s) – – מהו הסדר הנכון של יוני המתכות על פי כושרם לחמצן?
- Zn2+(aq) > Pb2+(aq) > Ba2+(aq)
- Ba2+(aq) > Zn2+(aq) > Pb2+(aq)
- Pb2+(aq) > Zn2+(aq) > Ba2+(aq)
- Pb2+(aq) > Ba2+(aq) > Zn2+(aq)
הסבר
יוני Pb2+(aq) מקבלים אלקטרונים מהמתכת Ba(s) ומהמתכת Zn(s) ולכן כושרם לחמצן הוא הטוב ביותר.
יוני Zn2+(aq) מקבלים אלקטרונים רק מהמתכת Ba(s) ולכן כושרם לחמצן טוב יותר מזה של יוני Ba2+(aq) אבל פחות טוב מזה של יוני Pb2+(aq). - לכלי פתוח המכיל תמיסה של חומצה גופרתית, H2SO4(aq), מכניסים מגנזיום, Mg(s).
כל המתכת טבולה בתמיסה.
לפניכם ניסוח נטו של התגובה המתרחשת.Mg(s) + 2H3O+(aq) → Mg2+(aq) +H2(g) +H2O(ℓ)
לפניכם רשימת משתנים הקשורים לניסוי:
I. מסת גז המימן.
II. שטח הפנים של המגנזיום.
III. ריכוז תמיסת החומצה הגופרתית.
IV. נפח הכלי שבו מתרחשת התגובה.אילו מן המשתנים ברשימה עשויים להשפיע על קצב התגובה?
- I ו- II
- II ו- III
- III ו- IV
- I ו- IV
הסבר
שטח הפנים של המתכת משפיע.
– ככל ששטח הפנים של המתכת גדול יותר יש יותר שטח למגע בין היונים שבתמיסה לפני השטח של המתכת לכן יש יותר התנגשויות ואיתם יותר התנגשויות פוריות בין חלקיקי המגיבים ליחידת זמן.
ריכוז תמיסת החומצה הגופרתית משפיע.
– ככל שריכוז תמיסת החומצה הגופרתית גדול יותר ריכוז יוני ההידרוניום בתמיסה גדול יותר.
ככל שריכוז חלקיקי המגיבים גדול יותר יש יותר התנגשויות ואיתם יותר התנגשויות פוריות ליחידת זמן.
ניתוח קטע ממאמר מדעי – חובה
- קראו את הקטע שלפניכם, וענו על כל הסעיפים שאחריו לפי ההנחיות (שאלת חובה – 20 נקודות).
| ענו על הסעיפים א, ב, ד, ה, ו, ז ועל אחד מן הסעיפים ג או ח |
- רשמו נוסחאות של 4 תרכובות יוניות העשויות להיות מקור ליונים שיש בקרחונים.
תשובה:
יש מספר אפשרויות:
NaCℓ, Na2SO4, MgCℓ2, CaCℓ2, CaSO4, MgSO4
יש לציין רק 4 מתוך הרשימה.
בצפון כדור הארץ ריכוז יוני הנתרן במי ים הוא 0.46.
- פי כמה גדולה המסה של יוני הנתרן ב- 1 ליטר מי ים לעומת המסה של יוני הנתרן ב- 1 ק”ג קרחון? פרטו את חישוביכם.
תשובה:
ב- 1 ק”ג קרחון יש 10-6 × 0.4 גרם יוני נתרן (על פי המאמר).
ב- 1 ליטר מי ים ריכוז יוני הנתרן הוא 0.46M.
נחשב מהי מסת יוני הנתרן ב- 1 ליטר מי ים.
ראשית נחשב את מספר מול יוני הנתרן:
n = C × V = 0.46 × 1 = 0.46 mol
כעת נחשב את מסת יוני הנתרן:
m = n × Mw = 0.46 × 23 = 10.58 gram
נחלק את מסת יוני הנתרן במי ים במסת יוני הנתרן בקרחון:מסת יוני הנתרן בליטר מי ים גדול פי 26450000 מאשר באחד ק”ג של קרחון.
| סעיף ג הוא סעיף בחירה. אם תבחרו לענות עליו אל תענו על סעיף ח |
- המודל בתרשים שלפניכם מייצג קטע של סידור מולקולות המים בקרח.
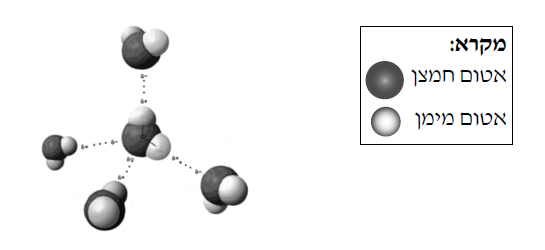
- התבוננו במודל וקבעו לכמה אטומי מימן קשור כל אטום חמצן ובאילו סוגי קשרים.
תשובה:
כל אטום חמצן קשור ל- 4 אטומי מימן. 2 קשרים הם בתוך המולקולה והם קשרים קוולנטיים, 2 קשרים הם בין המולקולות והם קשרי מימן. - נסחו את תהליך ההיתוך של הקרח.
תשובה:
H2O(s) → H2O(ℓ)
- התבוננו במודל וקבעו לכמה אטומי מימן קשור כל אטום חמצן ובאילו סוגי קשרים.
- לפניכם שני היגדים I ו- II. קבעו עבור כל היגד אם הוא נכון או לא נכון.
- לאטומים של מולקולות המים בקרח יש אופני תנועה מסוג תנודה בלבד. נכון.
- למולקולות המים בקרח יש אופני תנועה מסוג מעתק בלבד.לא נכון.
- קבעו אם תהליך ההיתוך של הקרח בקרחון יבשתי הוא תהליך אנדותרמי או אקסותרמי.
הסבירו ובססו את תשובתכם על סוגי הכוחות הפועלים בין המולקולות.
תשובה:
התהליך הוא תהליך אנדותרמי. במהלך התהליך יש לנתק / לשבור את קשרי המימן שבין המולקולות. לשם ניתוק קשרי המימן יש להשקיע אנרגייה. אנרגייה עוברת מהסביבה למערכת. ניתן גם לציין שלמים במצב צבירה נוזל יש אנרגייה פנימית גבוהה יותר ממים במצב צבירה מוצק. - קרחון שמסתו 2 טון נפל למים והותך כולו. כמה מולקולות מים נוספו לים? פרטו את חישוביכם.
נתון: 1 טון = 1×106 גרם.תשובה:
2 טון קרחון הם 2,000,000 גרם.
לפי המאמר רק 99% מהם הם מים ולכן מסת המים בקרחון היא:
2000000 × 0.99 = 1980000 gram
נחשב כמה מול מים:כעת נחשב את מספר מולקולות המים:
N = n × NA = 110000 × 6.02 × 1023 = 6.622 × 1028
מספר מולקולות המים שנוספו לים הם: 6.622 × 1028 - לפניכם שלושה היגדים I, II ו- III. התבססו על המאמר המדעי וקבעו עבור כל אחד מן ההיגדים אם הוא נכון או לא נכון.
- בעת התרחשות ברק נשברים קשרים קוולנטיים בין האטומים במולקולות המים הנמצאות בעננים. נכון.
- בעת התרחשות ברק נשברים קשרים קוולנטיים בין האטומים במולקולות הנמצאות באוויר. נכון.
- ברק משפיע על הטמפרטורה של הסביבה רק כאשר הוא פוגע באדמה. לא נכון.
| סעיף ח הוא סעיף בחירה. אם תבחרו לענות עליו אל תענו על סעיף ג |
- לפניכם גרף אנרגייה סכמטי עבור 1 מול מים.
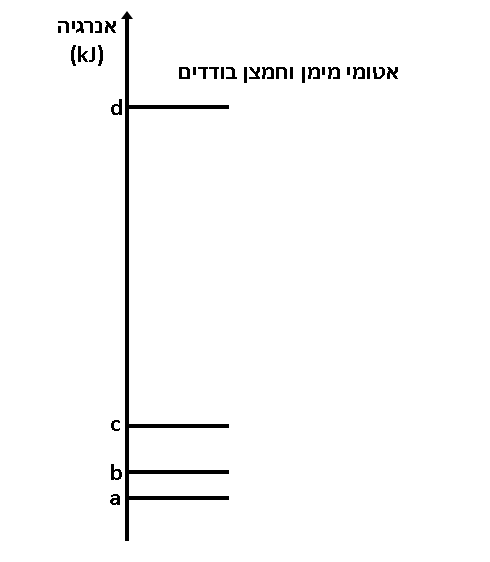
- מהו מצב הצבירה של המים בכל אחד מהמצבים: a, b, c?
תשובה:
a מצב צבירה מוצק.
b מצב צבירה נוזל.
c מצב צבירה גז. - הסבירו מדוע מעבר אנרגייה d-c גדול ממעבר האנרגייה b-a.
תשובה:
המעבר בין c-d גדול מהמעבר בין a-b משום שבמעבר בין a-b נשברים קשרי המימן בין המולקולות ואילו במעבר בין c-d נשברים קשרים קוולנטיים בין המימן לחמצן בתוך המולקולה.
קשר קוולנטי חזק מקשר מימני ונדרשת אנרגייה רבה יותר משמעותית לפירוקו מאשר האנרגייה שנדרשת לפירוק קשרי המימן בין המולקולות.
- מהו מצב הצבירה של המים בכל אחד מהמצבים: a, b, c?
פרק שני (60 נקודות)
ענו על שלוש מן השאלות 14-10 (לכל שאלה 20 נקודות).
10. מבנה האטום, מבנה וקישור, חישובים
סוללות ליתיום מספקת אנרגייה למכשירים רבים. הן מכילות תרכובות יוניות, תמיסות שמכילות יונים ניידים וחומרים נוספים.
ליתיום, Li(s), היה מרכיב חיוני בסוללות הליתיום הראשונות.
- תארו את מבנה הליתיום, Li(s), והסבירו מדוע החומר מוליך חשמל בטמפרטורת החדר.
תשובה:
המבנה מכיל יוני ליתיום +Li שביניהם נעים ים אלקטרונים לא מאותרים, (ביניהם ישנו קשר מתכתי).
Li(s) מוליך זרם חשמלי בזכות ים האלקטרונים הניידים שיש במבנה של מתכת הליתיום.
בסוללות שאינן מבוססות על ליתיום הממס הוא מים. אולם, בסוללות ליתיום הממסים אינם מימיים.
לפניכם התגובה הבאה:
Li(s) + H2O(ℓ) →H2(g) + Li+(aq) +OH–(aq) ΔH0 <0
- הסבירו מדוע לא משתמשים במים כממס בסוללת ליתיום.
תשובה:
לא משתמשים במים כממס בסוללת ליתיום מכיוון שהמים מגיבים עם הליתיום.
בתגובה משתחרר גז מימן דליק, סוללה בדרך כלל אטומה ויצירת גז תגרום ללחץ בתוך הסוללה דבר שיכול לגרום לפיצוץ הסוללה.
בנוסף משתחררת בתגובה אנרגייה בשילוב עם גז המימן הדליק יכול להתרחש פיצוץ.
אחד הממסים בסוללת ליתיום הוא די-מתיל קרבונט (DMC).
לפניכם ייצוג מקוצר לנוסחת המבנה של מולקולת DMC:
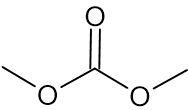
- רשמו נוסחה מולקולרית של DMC.
תשובה:
C3H6O3
לפניכם ייצוגים מקוצרים לנוסחאות מבנה של שלוש מולקולות נוספות: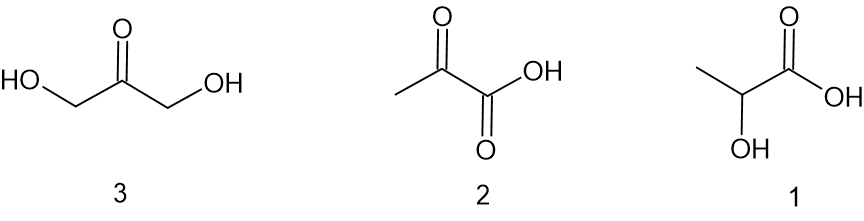
- איזו מולקולה או אילו מולקולות הן איזומרים של DMC? הסבירו את בחירתכם.
תשובה:
למולקולות 1 ו-3 יש אותה נוסחה מולקולרית כמו DMC ונוסחת מבנה שונה ולכן הם איזומרים של DMC.
למולקולות חומר 2 יש נוסחה מולקולרית שונה מזו של DMC ולכן חומר 2 אינו איזומר של DMC (הנוסחה המולקולרית של חומר 2 היא C3H4O3). - טמפרטורת הרתיחה של DMC נמוכה מטמפרטורת רתיחה של מים באותם תנאים. הסבירו עובדה זו.
תשובה:
בין מולקולות DMC יש אינטראקציות ון-דר-ואלס. בין מולקולות המים יש קשרי מימן שחזקים מאינטראקציות הון-דר-ואלס שבין מולקולות DMC.
נדרשת יותר אנרגייה לפירוק קשרי המימן שבין מולקולות המים ולכן טמפרטורת הרתיחה של מים גבוהה מזו של DMC (טמפרטורת הרתיחה של DMC נמוכה מטמפרטורת הרתיחה של המים). - המסו 139 גרם DMC במים והכינו 1 ליטר תמיסה.
- הסבירו מדוע DNC מתמוסס במים.
תשובה:
לאטומי החמצן במולקולת DMC יש זוגות אלקטרונים לא קושרים – המהווים מוקדים ליצירת קשרי מימן עם מולקולות המים.
בין מולקולות DMC לבין מולקולות מים נוצרים קשרי מימן.העשרה: אטומי המימן החשופים מאלקטרונים במולקולת המים נמשכים לזוג אלקטרונים לא קושר של אטום חמצן במולקולת DMC הסמוכה אליהם.
- חשבו את הריכוז המולרי של התמיסה שהוכנה.
תשובה:
- הסבירו מדוע DNC מתמוסס במים.
סוללות ליתיום נטענות נקראות סוללות ליתיום-יון והן משמשות, בין השאר, להפעלת מכוניות חשמליות.
יש סוללות ליתיום-יון שמבוססות על תרכובות של ליתיום, כגון ליתיום קובלט חמצני, LiCoO2(g).
התרכובת היונית LiCoO2(g) מורכבת מיוני ליתיום, יוני קובלט, Co3+, ויוני חמצן, O2-.
- רשמו נוסחאות ייצוג אלקטרונים של יוני ליתיום ושל יוני חמצן.
תשובה: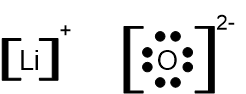
11. חומצות שומן, מבנה וקישור, חישובים
בפולי קקאו יש חמאת קקאו ומוצקי קקאו. חמאת קקאו מכילה שומן. מוצקי קקאו מכילים חומרים שאינם שומן.
לאחר טיפול מתאים בפולי הקקאו מייצרים מהם שוקולד.
שוקולד הוא תערובת של חמאת קקאו ומוצרי קקאו ומרכיבים אחרים כמו סוכר וחומרי טעם במינונים שונים.
בחמאת קקאו יש טריגליצרים שמורכבים בעיקר משלוש חומצות השומן שמוצגות בטבלה 1:
| חומצת שומן | סמל | ייצוג מקוצר לנוסחת מבנה |
| חומצה פלמיטית | P | |
| חומצה סטארית | S | |
| חומצה אולאית | O |
טבלה 1
- כתבו רישום מקוצר של כל אחת מחומצות השומן שמוצגות בטבלה 1.
תשובה:
חומצה פלמיטית: C16:0
חומצה סטארית: C18:0
חומצה אולאית: C18:1ω9 cis - טמפרטורת ההיתוך של חומצה פלמיטית נמוכה מטמפרטורת ההיתוך של חומצה סטארית. מהו הגורם לכך?
תשובה:
אורך השרשרת (גודל ענן האלקטרונים במולקולה, מספר אטומי פחמן).
חמאת קקאו מכילה חומצות שומן נוספות בכמויות קטנות, ובהן חומצות השומן שרשומות בטבלה 2:
| חומצת שומן | רישום מקוצר של חומצת השומן |
| חומצה מיריסטית | C14:0 |
| חומצה לינולאית | C18:2ω6 cis, cis |
| חומצה לינולנית | C18:3ω3 cis, cis, cis |
| חומצה אראכידית | C20:0 |
טבלה 2
- רשמו ייצוג מקוצר של נוסחאות המבנה של חומצות השומן הלא רוויות שרשומות בטבלה 2.
תשובה:
חומצה לינולאית
חומצה לינולנית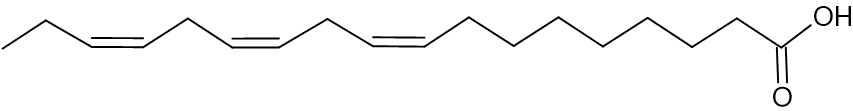
- טמפרטורת ההיתוך של חומצה אולאית גבוהה מטמפרטורת ההיתוך של חומצה לינולאית. מהו הגורם לכך?
תשובה:
דרגת הרוויון (מספר קשרי C=C במולקולה)
חומצת שומן נוספת בחמאת הקקאו היא חומצה פלמיטולאית. הרישום המקוצר של חומצה זו הוא C16:1ω7 cis.
- רשמו ייצוג מלא של נוסחת המבנה של מולקולת חומצה פלמיטולאית.
תשובה: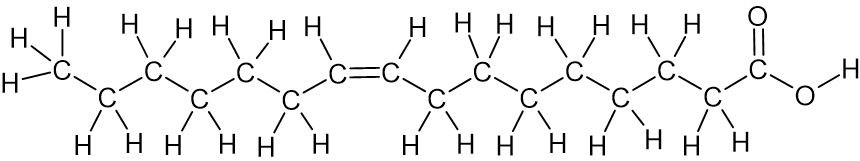
הסמלים של הטריגליצרידים בחמאת קקאו הם: POP, SOS, POS.
לפניכם ייצוג מקוצר לנוסחת המבנה של מולקולת טריגליצריד:
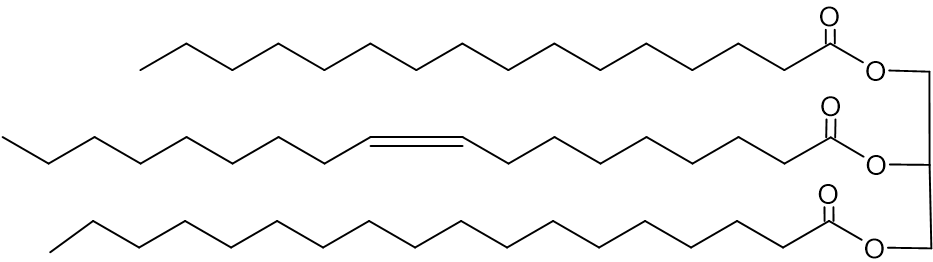
- בחרו את הסמל המתאים לייצוג המקוצר של נוסחת המבנה הנתונה.
תשובה:
POS
לפניכם ייצוג מקוצר של נוסחת המבנה של שלוש מולקולות:
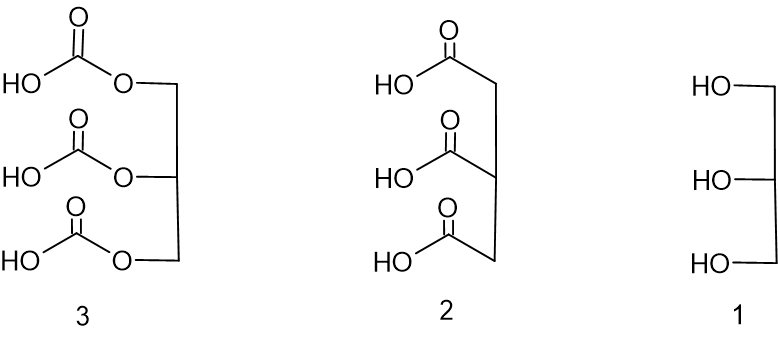
- איזה ייצוג מקוצר משלושת הייצוגים האלה מתאים לייצוג המקוצר של נוסחת המבנה של מולקולת הגליצרול?
תשובה:
ייצוג מקוצר מספר 1 מתאים לייצוג המקוצר של נוסחת המבנה של מולקולת הגליצרול.
מוצקי הקקאו שבשוקולד מכילים, בין השאר, את החומרים הממריצים תאוברומין וקפאין.
לפניכם ייצוג מקוצר של נוסחאות המבנה של מולקולת תאוברומין, C7H8N4O2, ומולקולת קפאין, C8H10N4O2.

- הסבירו מדוע החומרים תאוברומין וקפאין מתמוססים בחמאת קקאו.
תשובה:
בין מולקולות התאוברומין או מולקולות הקפאין למולקולות של הטריגליצרידים ולחומצות השומן הנמצאות בחמאת הקקאו נוצרים בעיקר אינטראקציות ון־דר־ולס (ומעט מאוד קשרי מימן) ולכן תאוברומין או קפאין מתמוססים בחמאת הקקאו. - לפניכם נתונים על ריכוז קפאין במשקאות שונים.
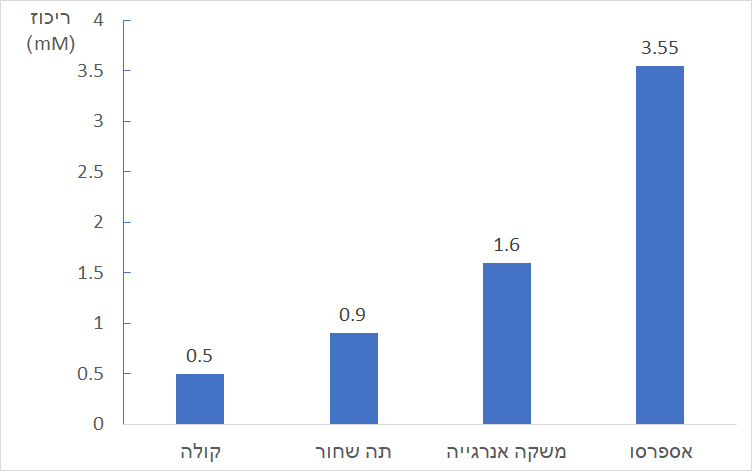
רצוי לצרוך לא יותר מ- 400 מיליגרם קפאין ביום. תלמיד שתה 4 פחיות משקה אנרגייה ביום אחד.- מהי מסת הקפאין בפחית אחת של משקה אנרגייה? פרטו את חישוביכם.
תשובה
הריכוז של הקפאין במשקה אנרגייה הוא 1.6mM שהוא: 1.6×10-3M
נפח פחית השתייה הוא 0.33 ליטר ולכן:
n = C × V = 1.6×10-3 × 0.33 = 5.28×10-4 mol (קפאין)
Mw = 194 gram / mol (קפאין)
m = n × Mw = 5.28×10-4 × 194 = 0.102 gram (קפאין)
בפחית אחת של משקה אנרגייה יש 0.102 גרם של קפאין. - קבעו אם התלמיד עבר את צריכת הקפאין היומית המומלצת (בהנחה שמשקה זה היה מקור הקפאין היחיד). פרטו את חישוביכם.
נתונים: 1×10-3M = 1mM
1 מיליגרם = 10-3×1 גרם
נפח פחית = 330 מ”לתשובה:
אם תלמיד שתה ארבע פחיות משקה אנרגייה הוא שתה 0.102 כפול 4 גרם קפאין. זאת אומרת שהוא שתה 0.408 גרם קפאין.
היות שרצוי לצרוך לא יותר מ- 400 מיליגרם קפאין ליום שהם 0.4 גרם. ניתן לקבוע שהתלמיד עבר את צריכת הקפאין היומית הממולצת.
- מהי מסת הקפאין בפחית אחת של משקה אנרגייה? פרטו את חישוביכם.
12. חומצות ובסיסים
לפניכם 3 כוסות כימיות שכל אחת מהן מכילה חומצה אחרת.

בכל אחת מן התמיסות טבלו נייר לקמוס ורוד וגם נייר לקמוס כחול. כמו כן, בדקו בכל אחת מהתמיסות את ערך ה- pH ואת המוליכות החשמלית.
בכל אחת מן הכוסות נמצא כי:
- הצבע של שני ניירות הלקמוס בתמיסה הוא ורוד.
- ערך ה- pH של התמיסה הוא 2.
- התמיסה מוליכה חשמל.
נתון: בטבלה שלפניכם מצויין הצבע של ניירות לקמוס שנטבלו בתמיסות שונות.
| בתמיסה חומצית | בתמיסה ניטרלית | בתמיסה בסיסית | |
| נייר לקמוס ורוד | אין שינוי | אין שינוי | משנה גוון לכחול |
| נייר לקמוס כחול | משנה גוון לוורוד | אין שינוי | אין שינוי |
- א
- ציינו את כל סוגי החלקיקים שנמצאים בכל אחת מן התמיסות בכוסות 3-1.
תשובה:
תמיסה 1 מכילה: יוני H3O+(aq) ,Cℓ–(aq) ומולקולות H2O.
תמיסה 2 מכילה: יוני H3O+(aq) ,NO3–(aq) ומולקולות H2O.
תמיסה 3 מכילה : יוני H3O+(aq) , Br–(aq) ומולקולות H2O. - מדוע כל אחת מהתמיסות מוליכה חשמל?
תשובה:
בכל התמיסות יש יונים ממוימים ניידים. - מדוע ערך ה- pH זהה בכל הכוסות?
תשובה:
בכל התמיסות ריכוז יוני ההידרוניום, H3O+(aq), שווה.
- ציינו את כל סוגי החלקיקים שנמצאים בכל אחת מן התמיסות בכוסות 3-1.
לכל אחת מן הכוסות הוסיפו תמיסת נתרן הידרוקסידי, NaOH(aq), בנפחים ובריכוזים שונים, כמפורט לפניכם.
לכוס 1 – הוסיפו 50 מ”ל תמיסת NaOH(aq) בריכוז 0.02M.
לכוס 2 – הוסיפו 50 מ”ל תמיסת NaOH(aq) בריכוז 0.01M.
לכוס 3 – הוסיפו 100 מ”ל תמיסת NaOH(aq) בריכוז 0.02M.
לאחר ההוספה, התקבלה תמיסה צלולה בכל אחת מן הכוסות.
בכל אחת מן הכוסות טבלו נייר לקמוס ורוד.
- ב
- רשמו ניסוח נטו של התגובה שהתרחשה בכל אחת מן הכוסות.
תשובה:
H3O+(aq) + OH–(aq) → 2H2O(ℓ) - באיזו מן הכוסות נראה שינוי בצבע של נייר הלקמוס? פרטו את חישוביכם.
תשובה:
כעת יש לבדוק בכל אחת מהכוסות כמה מול יוני הידרוניום היו בכוס וכמה מול יוני הידרוקסיד הכניסו, ובעקבות תגובת הסתירה מאיזה יון נותר עודף.
כוס 1H3O+(aq) HCℓ(aq) 1 1 יחס מולים 0.1 V (ליטר) 0.01 (M) C 0.001 0.001 n (מול) לכוס הוסיפו
OH–(aq) NaOH(aq) 1 1 יחס מולים 0.05 V (ליטר) 0.02 (M) C 0.001 0.001 n (מול) OH–(aq) H3O+(aq) 1 1 יחס מולים 0.001 0.001 n (מול) התחלה 0.001 0.001 n (מול) תגובה —- —- n (מול) סוף היות שבתום התגובה אין עודף יוני הידרוניום או עודף יוני הידרוקסיד (התרחשה תגובת סתירה בשלמות) ניתן לקבוע שערך ה-pH של התמיסה בתום התגובה הוא 7, התמיסה ניטראלית ולכן לא יחול שינוי בצבע נייר הלקמוס הורוד.
כוס 2H3O+(aq) HNO3(aq) 1 1 יחס מולים 0.1 V (ליטר) 0.01 (M) C 0.001 0.001 n (מול) לכוס הוסיפו
OH–(aq) NaOH(aq) 1 1 יחס מולים 0.05 V (ליטר) 0.01 (M) C 0.0005 0.0005 n (מול) OH–(aq) H3O+(aq) 1 1 יחס מולים 0.0005 0.001 n (מול) התחלה 0.0005 0.0005 n (מול) תגובה —- 0.0005 n (מול) סוף היות שבתום התגובה יש עודף יוני הידרוניום, ניתן לקבוע שערך ה-pH של התמיסה בתום התגובה קטן מ- 7, התמיסה חומצית ולכן לא יכול שינוי בצבע נייר הלקמוס הורוד.
כוס 3H3O+(aq) HBr(aq) 1 1 יחס מולים 0.1 V (ליטר) 0.01 (M) C 0.001 0.001 n (מול) לכוס הוסיפו
OH–(aq) NaOH(aq) 1 1 יחס מולים 0.1 V (ליטר) 0.02 (M) C 0.002 0.002 n (מול) OH–(aq) H3O+(aq) 1 1 יחס מולים 0.002 0.001 n (מול) התחלה 0.001 0.001 n (מול) תגובה 0.001 —- n (מול) סוף היות שבתום התגובה יש עודף יוני הידרוקסיד ניתן לקבוע שערך ה-pH של התמיסה בתום התגובה גדול 7, התמיסה בסיסית ולכן יכול שינוי בצבע נייר הלקמוס הורוד, הוא יהפוך לכחול.
- קבעו אם ה- pH היה קטן מ- 7, שווה ל- 7, או גדול מ- 7 בכל אחת מן הכוסות לאחר ההוספה של תמיסת נתרן הידרוקסידי.
תשובה:
על פי החישובים שנעשו בסעיף הקודם ניתן לקבוע כי:
– לאחר ההוספה בכוס הראשונה ערך ה- pH הוא 7.
– לאחר ההוספה בכוס השנייה ערך ה- pH קטן 7.
– לאחר ההוספה בכוס השלישית ערך ה- pH גדול 7.
- רשמו ניסוח נטו של התגובה שהתרחשה בכל אחת מן הכוסות.
- נערכו שני ניסויים
ניסוי 1
מדדו את ה- pH של 100 מ”ל תמיסת H2SO4(aq) בריכוז 0.2M.
לתמיסה זו הוסיפו 100 מ”ל תמיסת HCℓ(aq) בריכוז 0.2M וערבבו את שתי התמיסות.
בתום הערבוב בדקו שוב את ה- pH.- קבעו אם בתום הערבוב ה- pH גבוה מן ה- pH ההתחלתי, נמוך ממנו או שווה לו. נמקו או פרטו את חישוביכם.
תשובה:
ראשית נחשב את ריכוז יוני ההידרוניום, H3O+(aq), בתמיסה לפני ההוספה.H3O+(aq) H2SO4(aq) 2 1 יחס מולים 0.1 0.1 V (ליטר) 0.4 0.2 (M) C 0.04 0.02 n (מול) כעת נחשב כמה מול יוני הידרוניום התווספו מהתמיסה השנייה.
H3O+(aq) HCℓ(aq) 1 1 יחס מולים 0.1 V (ליטר) 0.2 (M) C 0.02 0.02 n (מול) כעת נחשב את ריכוז יוני ההידרוניום החדש לאחר ערבוב שתי התמיסות:
היות שריכוז יוני ההידרוניום ירד מ- 0.4M ל- 0.3M ניתן לקבוע שערך ה-pH עלה, זאת אומרת שערך ה-pH לאחר ערבוב התמיסות גבוה מערך ה- pH ההתחלתי.
- קבעו אם בתום הערבוב ה- pH גבוה מן ה- pH ההתחלתי, נמוך ממנו או שווה לו. נמקו או פרטו את חישוביכם.
ניסוי 2
מדדו את ה- pH של 100 מ”ל תמיסת HCℓ(aq) בריכוז 0.1M.
לתמיסה זו הוסיפו 100 מ”ל תמיסת NaCℓ(aq) בריכוז 0.1M וערבבו את שתי התמיסות.
בתום הערבוב בדקו שוב את ה- pH.
- קבעו אם בתום הערבוב ה- pH גבוה מן ה- pH ההתחלתי, נמוך ממנו או שווה לו? נמקו או פרטו את חישוביכם.
תשובה:
במקרה זה אפשר לבצע חישוב אבל ניתן להסביר גם ללא חישוב.
היות שהוסיפו תמיסה שלא מכילה יוני הידרוניום או יוני הידרוקסיד לתמיסת HCℓ(aq) ולא מתרחשת תגובה ניתן לקבוע שמספר המולים של יוני ההידרוניום שהיה בתמיסה המקורית לא משתנה, אבל נפח התמיסה הכולל גדל ולכן על פי הנוסחה: ניתן לקבוע כי ריכוז יוני ההידרוניום בתמיסה החדשה קטן מריכוז יוני ההידרוניום לפני ההוספה. לכן ערך ה- pH לאחר ההוספה גבוה מערך ה-pH לפני ההוספה.
- קבעו אם בתום הערבוב ה- pH גבוה מן ה- pH ההתחלתי, נמוך ממנו או שווה לו? נמקו או פרטו את חישוביכם.
13. חמצון־חיזור, מבנה וקישור וחישובים
השאלה עוסקת במתכת טיטניום, Ti(s), ובסגסוגות שלה. למתכת זו ולסגסוגות שלה יש שימושים רבים בתעשייה, בין היתר בתעשיית התעופה והחלל.
להפקת טיטניום משתמשים במחצבים המכילים טיטניום חמצני TiO2(s).
הפקת המתכת טיטניום מתבצעת בשני שלבים:
שלב ראשון
בשלב זה טיטניום חמצני, TiO2(s), מגיב עם פחמן, C(s), ועם גז כלור, Cℓ2(g).
אחד התוצרים הוא הנוזל, TiCℓ4(ℓ), על פי תגובה (1)
(1) TiO2(s) + C(s) + Cℓ2(g) → TiCℓ4(ℓ) + CO2(g)
שלב שני
התרכובת הנוזלית טיטניום ארבע כלורי, TiCℓ4(ℓ), שנוצרה בתגובה (1), מגיבה עם מגנזיום מתכתי, Mg(s), על פי תגובה (2).
(2) TiCℓ4(ℓ) + 2Mg(s) → Ti(s) + 2MgCℓ2(s)
נתון: אלקטרושליליות של טיטניום, Ti – 1.54.
- קבעו מי החומר המחמצן ומי החומר המחזר בכל אחת מן התגובות (1) ו- (2). נמקו את קביעתכם.
תשובה:בתגובה (1) ה- C(s) בדרגת חמצון 0 הוא המחזר הוא עולה בדרגת החמצון מ- 0 ל- 4+. הוא מוסר אלקטרונים ועובר תגובת חמצון.
ה- Cℓ2(g) בדרגת חמצון 0 הוא המחמצן. הוא יורד בדרגת החמצון ל- 1- הוא מקבל אלקטרונים ועובר תגובת חיזור.בתגובה 2 ה- Mg(s) בדרגת חמצון 0 הוא המחזר הוא עולה בדרגת החמצון ל- 2+ הוא מוסר אלקטרונים ועובר תגובת חמצון. ואילו Ti בחומר TiCℓ4(ℓ) בדרגת חמצון 4+ הוא המחמצן הוא יורד בדרגת החמצון ל- 0 מקבל אלקטרונים ועובר תגובת חיזור.
- איזו מתכת מחזרת טובה יותר – מגנזיום או טיטניום? נמקו את תשובתכם.
תשובה:
המתכת המחזרת הטובה יותר היא ה- Mg(s) . על פי תגובה (2) היא מוסרת אלקטרונים לאטומי Ti בדרגת חמצון 4+ בחומר TiCℓ4(ℓ). לכן המתכת מגנזיום Mg(s) מחזרת טובה יותר מהמתכת טיטניום Ti(s). - כמה טון טיטניום חמצני, TiO2(s), דרושים כדי להפיק טון אחד של המתכת טיטניום, Ti(s)? פרטו את חישוביכם.
נתון: 1 טון = 106 × 1 גרםTiCℓ4(ℓ) Ti(s) 1 1 יחס מולים 100000 m (גרם) 47.9 Mw (גרם/מול) 20876 20876 n (מול) TiO2(s) TiCℓ4(ℓ) 1 1 יחס מולים 20876 20876 n (מול) 79.9 Mw (גרם/מול) 1667992.4 m (גרם) דרושים 1.667 טון של TiO2(s).
- אחת הסגסוגות השימושיות בתעשיית החלל והתעופה נוצרת מעיבוד של המתכות טיטניום, Ti(s) , ונדיום, V(s), ואלומיניום, Aℓ(s).
בכל 100 גרם סגסוגת כזאת יש 90 גרם טיטניום, 4 גרם ונדיום והשאר אלומיניום.- לפניכם רשימה של סוגי חלקיקים: אטומים, מולקולות, יונים, יונים ניידים, אלקטרונים ניידים.
אילו סוגי חלקיקים מרשימה זו מרכיבים את הסגסוגת?
תשובה:
החלקיקים המרכיבים את הסגסוגת הם: יונים, אלקטרונים ניידים. - כמה מול אלומיניום יש ב- 1 ק”ג סגסוגת זו? פרטו את חישוביכם.
תשובה:
ב- 100 גרם סגסוגת יש 6 גרם אלומיניום.
m = 100 – 90 – 4 = 6 gram (אלומיניום)
לכן ב- 1 קילוגרם שהם 1000 גרם יש 60 גרם אלומיניום.Aℓ(s) סגסוגת 6 100 m (גרם) 60 1000 m (גרם)
- לפניכם רשימה של סוגי חלקיקים: אטומים, מולקולות, יונים, יונים ניידים, אלקטרונים ניידים.
כאשר מכינים סגסוגת של טיטניום צריך להתיך אותו. טיטניום מותך יכול להגיב עם גזים שבאוויר.
- בתגובה בין טיטניום מותך ובין גז חנקן, N2(g), שבאוויר נוצרת התרכובת טיטניום חנקני, TiN(s).
נסחו ואזנו את התגובה.
תשובה:
2Ti(ℓ) + N2(g) → 2TiN(s) - מעבדים את הטיטניום המותך בסביבה של גז ארגון, Ar(g). הסבירו מדוע.
תשובה:
באוויר יש גם חמצן וגם חנקן שיכולים להגיב עם מתכת הטיטניום. כאשר התהליכים מתרחשים בסביבת הגז האציל ארגון הוא לא יגיב עם המתכת טיטניום. - בסעיפי השאלה הוזכרו החומרים: Ti(s), TiO2(s), TiCℓ4(ℓ), TiN(s).
קבעו באיזה מן החומרים האלה הטיטניום יכול להגיב רק כמחזר.
תשובה:
נרשום דרגות חמצון לכל המרכיבים:
דרגת החמצון המינימלית של המתכת טיטניום היא 0 כמו לכל המתכות. לכן רק במצב זה היא יכולה לשמש רק כמחזר.
ולכן רק Ti(s) יכול לשמש רק כמחזר.
14. מבנה וקישור, חמצון־חיזור, חומצות ובסיסים
בטבלה שלפניכם מצוינים נתונים של שלושה יסודות המסומנים באופן שרירותי באותיות: c, b, a.
| סמל שרירותי של היסוד | טמפרטורת ההיתוך של היסוד (C°) | טמפרטורת הרתיחה של היסוד (C°) | הולכה חשמלית של היסוד בטמפרטורת החדר |
| a | 98 | 883 | מוליך |
| b | 259- | 253- | לא מוליך |
| c | 7- | 59 | לא מוליך |
- התאימו בין היסודות: מימן, H2(g), ברום, Br2(ℓ), נתרן, Na(s) ובין האותיות c, b, a.
תשובה:
a – Na(s)
b – H2(g)
c – Br2(ℓ) - ב
- קבעו מהו סוג הקשרים בין אטומי היסוד המסומן באות b.
תשובה:
בין אטומי היסוד b – H2(g) ישנם קשרים קוולנטיים. - הסבירו מדוע טמפרטורת הרתיחה של היסוד המסומן באות c גבוהה מטמפרטורת הרתיחה של היסוד המסומן באות b.
תשובה:
טמפרטורת הרתיחה של היסוד c – Br2 גבוהה מזו של היסוד b – H2 כי למולקולת Br2 ענן אלקטרונים גדול מזה של מולקולת H2, אינטראקציות הון־דר־ולס בין מולקולות Br2 חזקות יותר מאלה שבין מולקולות H2, צריך יותר אנרגייה לפירוק אינטראקציות הון־דר־ולס בין מולקולות ה- Br2, ולכן טמפרטורת הרתיחה של החומר Br2 גבוהה יותר.
- קבעו מהו סוג הקשרים בין אטומי היסוד המסומן באות b.
בתנאים מתאימים היסודות מגיבים ביניהם.
- בתגובה בין היסוד שסומן באות a ובין היסוד שסומן באות b מתקבל תוצר יחיד שהוא מוצק בטמפרטורת החדר.
מהי דרגת החמצון של כל אחד מן החלקיקים בתוצר שהתקבל?
תשובה:
התוצר שמתקבל בין a – Na(s) לבין b – H2(g) הוא NaH(s) , חומר יוני.
נתרן Na(s) היא מתכת מהטור הראשון ולכן כשהיא הופכת ליון מטענה הוא 1+.
מימן H2(g) היא אל מתכת שיכולה לקבל רק אלקטרון אחד ולכן כשהיא הופכת ליון מטענה הוא 1-.
דרגות החמצון הן: - בתגובה בין היסוד שסומן באות a ובין היסוד שסומן באות c מתקבל תוצר יחיד שהוא מוצק בטמפרטורת החדר.
תוצר זה מסיס במים.- נסחו את תגובת ההמסה במים של התוצר.
תשובה:
התוצר שמתקבל בין a – Na(s) לבין c – Br2(ℓ) הוא NaBr(s) , חומר יוני.
נתרן Na(s) היא מתכת מהטור הראשון, לכן המטען החשמלי של יוני נתרן הוא 1+.
ברום Br2(ℓ) היא אל מתכת מהטור השביעי, לכן המטען החשמלי של יוני ברום הוא 1-.
ניסוח תגובת ההמסה במים של התוצר:
- האם התמיסה הנוצרת מוליכה חשמל? נמקו את תשובתכם.
תשובה:
לתמיסה יש מוליכות חשמלית כי יש בה יונים ממוימים ניידים.
- נסחו את תגובת ההמסה במים של התוצר.
- בתגובה בין היסוד שסומן באות b ובין היסוד שסומן באות c מתקבל תוצר יחיד, שהוא גז בטמפרטורת החדר.
תוצר זה מגיב עם מים ונוצרת תמיסה.- מהי נוסחת התוצר?
תשובה:
התוצר שמתקבל בין b – H2(g) לבין c – Br2(ℓ) הוא HBr(g) , חומר מולקולרי.
מימן (H) הוא יסוד אל מתכתי שיש לאטום שלו אלקטרון אחד לא מזווג, הוא משתף רק אלקטרון אחד בקשר הקוולנטי.
ברום (Br) הוא יסוד על מתכתי שיש לאטום שלו אלקטרון אחד לא מזווג, הוא משתף רק אלקטרון אחד בקשר הקוולנטי. - נסחו את תגובת התוצר עם מים.
תשובה:
HBr(g) + H2O(ℓ) → H3O+(aq) + Br–(aq) - האם התמיסה הנוצרת חומצית, בסיסית, או ניטרלית? נמקו את תשובתכם.
תשובה:
התמיסה חומצית, יש בה עודף יוני הידרוניום, H3O+(aq) .
- מהי נוסחת התוצר?
- היסוד חנקן, N2(g), מגיב עם היסוד המסומן באות b, ומתקבל תוצר יחיד שהוא גז. תוצר זה מגיב עם מים ויוצר תמיסה בסיסית.
- נסחו את התגובה לקבלת התוצר.
תשובה:
התוצר שמתקבל בין b – H2(g) לבין N2(g) הוא NH3(g) , חומר מולקולרי.
מימן (H) הוא יסוד אל מתכתי שיש לאטום שלו אלקטרון אחד לא מזווג, הוא משתף רק אלקטרון אחד בקשר הקוולנטי.
חנקן (N) הוא יסוד אל מתכתי שיש לאטום שלו שלושה אלקטרונים לא מזווגים, הוא משתף שלושה אלקטרונים בקשר הקוולנטי.
ניסוח התגובה:
N2(g) + 3H2(g) → 2NH3(g) - נסחו את התגובה בין התוצר המתקבל ובין מים.
תשובה:
NH3(g) + H2O(ℓ) → NH4+(aq) + OH–(aq)
- נסחו את התגובה לקבלת התוצר.
- היסוד חנקן, N2(g), מגיב עם היסוד המסומן באות a, ומתקבל תוצר יחיד.
רשמו את נוסחת התוצר בטמפרטורת החדר.
תשובה:
התוצר שמתקבל בין a – Na(s) לבין N2(g) הוא Na3N(s) , חומר יוני.
נתרן Na(s) היא מתכת מהטור המטען החשמלי של יון הנתרן הוא 1+.
חנקן N2(g) היא אל מתכת מהטור החמישי המטען החשמלי של יון החנקן הוא 3-.
בהצלחה !
