בגרות בכימיה 2022
הוראות
- משך הבחינה : שלוש שעות
- מבנה השאלון ומפתח הערכה : בשאלון זה שני פרקים.
פרק ראשון – 40 נקודות
פרק שני – 60 נקודות
סה”כ – 100 נקודות - חומר עזר מותר בשימוש :
- מחשבון ( כולל מחשבון גרפי).
- דפי נוסחאות ונתונים (מצורפים).
- הוראות מיוחדות :
- בפרק הראשון יש תשע שאלות.
בכל אחת מהשאלות 1-8 מוצגות ארבע תשובות, ומהן יש לבחור בתשובה הנכונה. את התשובות הנכונות יש לסמן בתשובון שבסוף מחברת הבחינה (עמוד 19).
בשאלה 9 יש לענות על כל הסעיפים לפי ההנחיות. - בפרק השני יש חמש שאלות. יש לענות על שלוש מהן.
- בפרק הראשון יש תשע שאלות.
יש לכתוב במחברת הבחינה בלבד. יש לרשום “טיוטה” בראש כל עמוד המשמש טיוטה.
כתיבת טיוטה בדפים שאינם במחברת הבחינה עלולה לגרום לפסילה.
השאלות בשאלון זה מנוסחות בלשון רבים, אף על פי כן על כל תלמידה וכל תלמיד להשיב עליהן באופן אישי.
בהצלחה!
השאלות
פרק ראשון (40 נקודות)
ענו על כל השאלות 1 – 8.
אם תענו נכון על שש שאלות לפחות, תקבלו את מלוא 20 הנקודות (לכל שאלה – 31/3 נקודות).
לפני שתענו, קראו את כל התשובות המוצעות.
לכל שאלה מוצעות ארבע תשובות. בחרו בתשובה הנכונה.
* את התשובה שבחרתם סמנו בתשובון שבכריכה הפנימית בסוף מחברת הבחינה (עמוד 19).
* בכל שאלה סמנו בעט X במשבצת שמתחת לאות (א – ד) המייצגת את התשובה שבחרתם.
* בכל שאלה יש לסמן X אחד בלבד.
* כדי למחוק סימון יש למלא את כל המשבצת כך: ■
* אסור למחוק בטיפקס.
* שימו לב: כדאי להימנע ככל האפשר ממחיקות בתשובון, לכן מומלץ לסמן את התשובות הנכונות קודם בשאלון עצמו, ורק אחר כך לסמן אותו בתשובון.
- נתונים שניים מן האיזוטופים של נתרן: 22Na ו- 23Na.
מהו ההיגד הנכון?- המטען הגרעיני של האיזוטופ 23Na גדול מן המטען הגרעיני של האיזוטופ 22Na.
- מספר הנויטרונים באיזוטופ 22Na קטן ממספר הנויטרונים באיזוטופ 23Na.
- מספר האלקטרונים באיזוטופ 23Na גדול ממספר האלקטרונים באיזוטופ 22Na.
- מספר הפרוטונים באיזוטופ 22Na קטן ממספר הפרוטונים באיזוטופ 23Na.
- לפניכם נוסחאות ייצוג אלקטרונים I-V:
I II III IV V 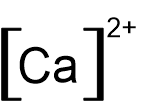
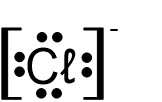
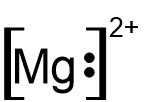
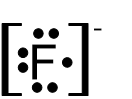
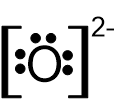
אילו מן הנוסחאות I-V מייצגות באופן נכון יונים חד-אטומיים?
- I ו- II
- III ו- IV
- III ו- V
- IV ו- V
- לפניכם טבלה שבה נתונים של שני חומרים:
שם החומר טמפרטורת רתיחה
(C°)ייצוג מלא של נוסחת המבנה של מולקולת החומר 1-פנטאנול 138 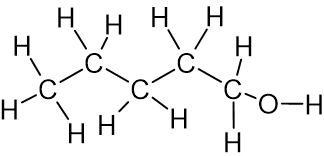
1-אמינו פנטאן 104 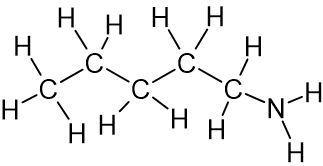
טמפרטורת הרתיחה של 1-אמינו פנטאן נמוכה מטמפרטורת הרתיחה של 1-פנטאנול.
מהי הסיבה לכך?- שטח הפנים של מולקולת 1-אמינו פנטאן קטן משטח הפנים של מולקולת 1-פנטאנול.
- ענן האלקטרונים במולקולת 1-אמינו פנטאן קטן מענן האלקטרונים במולקולת 1-פנטאנול.
- קשרי המימן הנוצרים בין המולקולות של 1-אמינו פנטאן חלשים יותר מקשרי המימן הנוצרים בין המולקולות של 1-פנטאנול.
- במולקולת 1-אמינו פנטאן יש פחות מוקדים אפשריים ליצירת קשרי מימן מאשר במולקולת 1-פנטאנול.
- חיממו 1.125 גרם של המוצק נחושת חנקתית Cu(NO3)2(s) ().
במהלך החימום התרחשה התגובה:
כל הנחושת הגיבה.
מהו ההיגד הנכון המתייחס לתוצרי התגובה?- נוצר 0.38 גרם של המוצק CuO(s) ().
- נוצר 0.006 מול של NO2(g).
- נוצרו 0.048 מול של מולקולות חמצן.
- בתגובה נוצר 0.015 מול של גזים סך הכול.
- נערך ניסוי שבו הונחו על המאזניים שני כלים כלי A וכלי B.
בכלי A היתה תמיסה של כסף חנקתי, AgNO3(aq), ובכלי B הייתה תמיסה של נתרן כלורי, NaCℓ(aq).
המסה הכוללת של החומרים והכלים שנמדדה במאזניים הייתה 16.0 גרם (ראו איור I).
שפכו את כל התמיסה שהייתה בכלי B לתמיסה שבכלי A, והניחו על המאזניים את כלי B הריק ואת כלי A שבו התרחשה התגובה (ראו איורים II ו- III).
ניסוח התגובה הוא:Ag+(aq) + NO3–(aq) + Na+(aq) +Cℓ–(aq) → AgCℓ(s) + Na+(aq) + NO3–(aq)
לפניכם איורים III – I, המתארים את שלושת השלבים בניסוי:

מהי המסה הכוללת שנמדדה במאזניים בתום התגובה (איור III)?- מסה גדולה מ- 16.0 גרם.
- מסה קטנה מ- 16.0 גרם.
- מסה שווה ל- 16.0 גרם.
- אי אפשר לקבוע את המסה הכוללת ללא נתונים על ריכוז התמיסות והנפח שלהן.
- המיסו 2.96 גרם של מגנזיום חנקתי, Mg(NO3)2(s), בתוך 100 מ”ל תמיסת נתקן חנקתי, NaNO3(aq), שריכוזה 0.1M.
נתונה המסה המולרית של מגנזיום חנקתי: .
מהו ריכוז יוני NO3–(aq) בתמיסה לאחר ההמסה?- 0.5M
- 0.4M
- 0.3M
- 0.2M
- לפניכם ΔH0 עבור תגובות השריפה (1) ו- (2):
(1) N2(g) + 2O2(g) →2NO2(g) ΔH01 = +66.4kJ
(2) 2NO(g) + O2(g) → 2NO2(g) ΔH02 = -114.4kJלפניכם תגובה 3
(3) N2(g) + O2(g) →2NO(g) ΔH03 =?
מהו ערכו של ΔH03 עבור תגובה (3)?
- 180.8kJ-
- 180.8kJ+
- 48.0kJ-
- 48.0kJ+
- בניסוי ערבבו שני גזים: אמוניה, NH3(g), ומימן כלורי, HCℓ(g). התרחשה תגובה.
התוצר שהתקבל הוא המוצק היוני אמון כלורי, NH4Cℓ(s).
ניסוח התגובה שהתרחשה הוא:NH3(g) + HCℓ(g) → NH4Cℓ(s)
מהי הקביעה הנכונה?
- בתגובה זו אמוניה, NH3(g), הוא המחמצן.
- בתגובה זו אמוניה, NH3(g), הוא הבסיס.
- בתגובה זו מימן כלורי, HCℓ(g), הוא המחמצן.
- בתגובה זו מימן כלורי, HCℓ(g), הוא הבסיס.
ניתוח קטע ממאמר מדעי – חובה
- קראו את הקטע שלפניכם, וענו על כל הסעיפים שאחריו (שאלת חובה – 20 נקודות).
מימן – אחד הפתרונות לדלק עתידי
רוב המדענים סבורים שיש קשר בין העלייה בטמפרטורת האטמוספירה במאה הנוכחית, ההתחממות הגלובלית, ובין השריפה של כמויות גדולות של דלקים המכילים בעיקר תרכובות פחמן (דלקים מאובנים).
שריפת דלקים אלה גורמת לשחרור אנרגייה זמינה לשימוש. בתהליך השריפה נפלט לאטמוספירה פחמן דו־חמצני, CO2(g), שהוא גז חממה. גזי חממה לוכדים קרינה שמוחזרת מפני כדור הארץ וכך גורמים להתחממותו.
בועידת האקלים שהאו”ם מכנס, נציגי המדינות דנים באפשרות לצמצם את פליטת הפחמן הדו־חמצני עד 2050, כדי להאט את ההתחממות הגלובלית. אחת האפשרויות שנדונו היא להפיק אנרגייה באמצעות שרפה (תגובה עם חמצן, O2(g)) של גז המימן, H2(g), במקום שרפה של דלקים המכילים תרוכובות פחמן.
המימן אינו מופיע כיסוד על פני כדור הארץ, לכן יש צורך להפיקו מתרכובות שונות באמצעות תהליכים כימיים הדורשים השקעת אנרגייה.
נהוג לכנות את המימן המופק על פי שיטת ההפקה, למשל:
“מימן אפור“: המימן הזול ביותר ומופק בין השאר מגז טבעי. המרכיב העיקרי של גז טבעי הוא מתאן, CH4(g). כאשר מתאן מגיב עם קיטור, H2O(g), בלחץ גבוה, נוצרים הגזים פחמן דו־חמצני, CO2(g), שנפלט לאטמוספירה, ומימן, H2(g), שנאסף למְכָלי אחסון.
“מימן כחול“: מימן המופק בתהליך זהה לתהליך הפקת “מימן אפור”, אולם הגז CO2(g) שנוצר בתהליך, אינו משתחרר לאטמוספירה, אלא נאסף אף הוא במהלך ההפקה. טכנולוגיות שונות לאיסוף וניצול של CO2(g) נמצאות בפיתוח.
אחת הבעיות בתהליך ההפקה של “מימן אפור” ושל “מימן כחול” היא שהמתאן, CH4(g), שגם הוא גז חממה, עלול להשתחרר לאטמוספירה.
“מימן ירוק“: מימן המופק בתהליך פירוק של מים בעזרת חשמל בתנאים מתאימים. תוצרי הפירוק הם מימן וחמצן בלבד. לתהליך זה נדרשת השקעת אנרגייה המתקבלת מניצול מקורות אנרגייה מתחדשים כגון השמש והרוח.
אפשר להשתמש במימן כדלק כך ששריפת המימן תהיה מקור לאנרגייה בתעשייה ולהנעת כלי רכב גדולים.
השימוש במימן כדלק עתידי יוצר כמה בעיות:
- את המימן המופק במצב צבירה גזי צריך לאחסן במכלים גדולים שעומדים בלחץ גבוה.
- אחסון המימן במצב צבירה נוזלי מחייב קירורו לטמפרטורה נמוכה מאוד (20.3K), שבה הוא נהפך לנוזל.
- במהלך שרפת המימן באוויר מתרחשת תגובה נוספת בין החמצן, O2(g), לבין החנקן, N2(g), שבאוויר.
בתגובה זו נוצר חנקן דו־חמצני, NO2(g), שגם הוא גז חממה לא רצוי.
אפשר להשתמש במימן כדלק במכוניות שבהן מותקן רכיב מיוחד. ברכיב זה מתרחשת תגובת חמצון־חיזור בין גז מימן ובין גז חמצן שמקורו באוויר. תגובה זו מתרחשת על שטח הפנים של זרז מוצק.
מכוניות המונעות במימן עשויות להתחרות במכוניות חשמליות הפועלות על סוללות נטענות ודורשות זמן רב לטעינה.
כיום רק חלק קטן מאוד מצריכת האנרגייה העולמית מבוסס על מימן. ייתכן שבשנים הקרובות עוד מדינות ישלבו את המימן כמקור אנרגייה.
מקור:
Dewan Angela (2021). Green hydrogen could be the fuel of the future. Here’s why it’s not yet a silver bullet. CNN, August 31.
- האם שריפת דלקים המכילים תרכובות פחמן היא תגובה אנדותרמית? נמקו על פי הקטע.
- מהו התוצר האפשרי בשריפת מימן: פחמן דו־חמצני או מים? נמקו את בחירתכם.
- נסחו ואזנו את תהליך הפקת הגז “מימן אפור”.
- קבעו את המחמצן ואת המחזר בתגובה שניסחתם בסעיף ג. נמקו את קביעתכם.
- קבעו את סימנו של ΔH0 עבור התגובה המתרחשת בעת הפקת “מימן ירוק”. נמקו על פי הקטע.
- לפניכם שני גרפים I ו- II. קבעו מהו הגרף שמתאר באופן נכון את השפעת הזרז על התגובה המתרחשת ברכיב שמותקן במכוניות המונעות במימן. נמקו את קביעתכם.
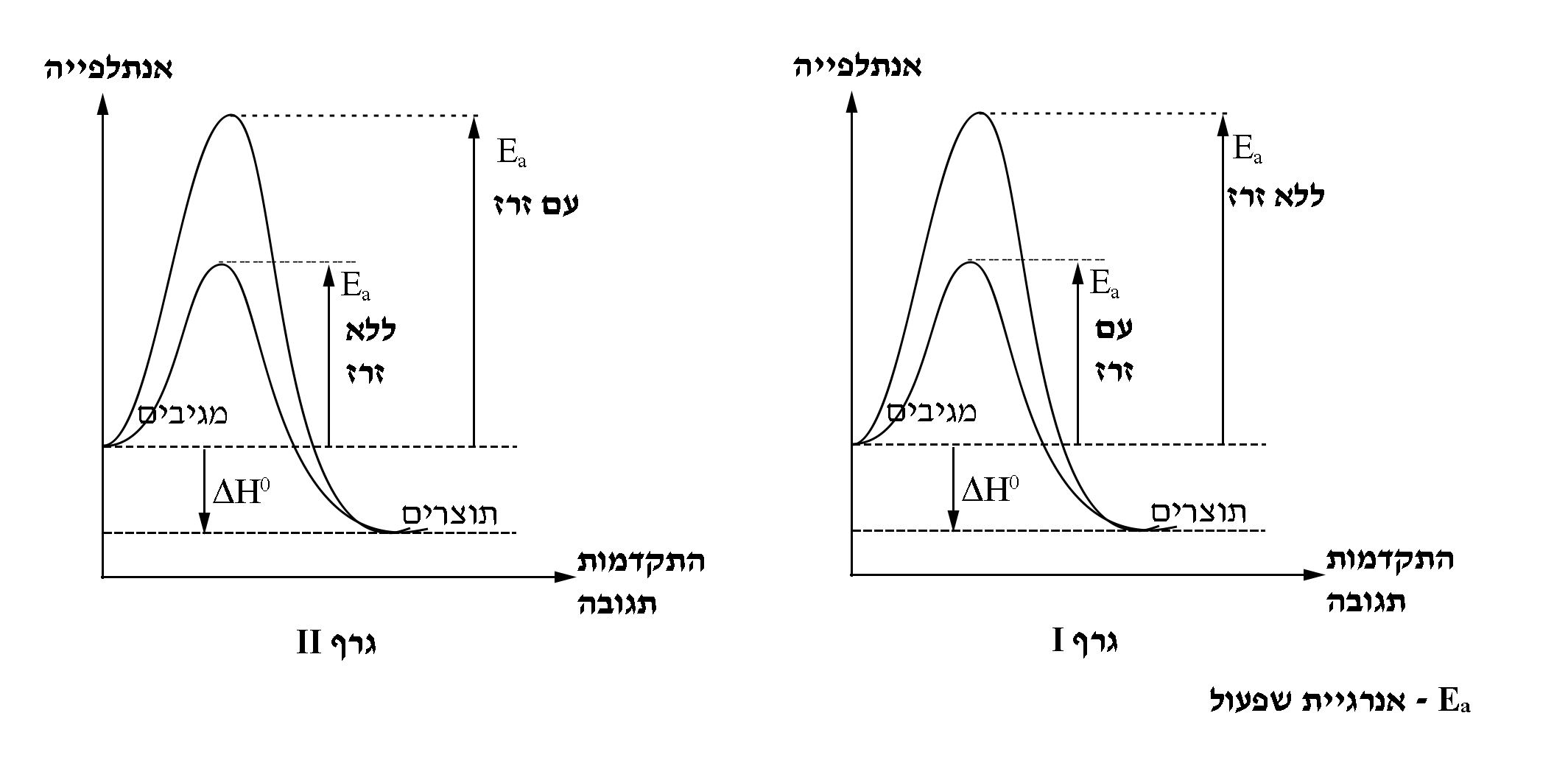
| יש לבחור אחד מן הסעיפים ז או ח. |
- בתהליך הפקה של “מימן כחול” הגיב 1 טון מתאן, CH4(g).
בתהליך אספו את הפחמן הדו־חמצני, CO2(g), שנוצר.
האם מסת הפחמן הדו־חמצני שהתקבל בתגובה גדולה מ- 1 טון או קטנה מ- 1 טון?
פרטו את חישוביכם או נמקו באופן מילולי.
נתון: 1 טון = 106×1 גרם. - על פי הקטע, מימן משנה מצב צבירה מגז לנוזל בטמפרטורה של 20.3K בלחץ אטמוספירי.
האם טמפרטורת הרתיחה של חמצן באותם תנאים גבוהה מ- 20.3K או נמוכה מ- 20.3K? נמקו את תשובתכם. התייחסו לכוחות הפועלים בין המולקולות של כל אחד מהיסודות במצב צבירה נוזלי.
פרק שני (60 נקודות)
ענו על שלוש מן השאלות 14-10 (לכל שאלה 20 נקודות).
10. מבנה וקישור, חישובים, אנרגייה
השאלה עוסקת בחומרים הנקראים מעכבי בעירה.
מטפים לשימוש ביתי מכילים גזים, אבקות או קצף שמעכבים בעירה.
בעבר השתמשו בגז שנוסחתו CBrF3(g).
היום מחליפה אותו תערובת של שלושה גזים: Ar(g), CF4(g), CHCℓ2CF3(g).
- רשמו נוסחאות ייצוג אלקטרונים של המולקולות CHCℓ2CF3(g), CBrF3(g) ו- CF4(g).
לפניכם טבלה שבה מוצגות טמפרטורות הרתיחה של שני חומרים וצורת המולקולה של כל אחד מהם:
| החומר (בטמפרטורת החדר) | טמפרטורת רתיחה (C°) | צורת המולקולה של החומר |
| CBrF3(g) | -58 | טטראדר |
| CF4(g) | -128 | טטראדר |
- ציינו שני גורמים להבדל בין טמפרטורת הרתיחה של שני החומרים.
- הסבירו כיצד כל אחד משני הגורמים שציינתם בסעיף ב משפיע על חוזק הכוחות הפועלים בין המולקולות.
אבקות שמשמשות לכיבוי שרפות גדולות הן בעיקר אלומיניום הידרוקסידי, Aℓ(OH)3(s), ומגנזיום הידרוקסידי, Mg(OH)2(s). מטוסים מפזרים אבקות אלה מן האויר על מקום השריפה יחד עם חומר שצבעו אדום.
התרכובת Aℓ(OH)3(s) מתפרקת בטמפרטורות גבוהות למוצק אלומיניום חמצני, Aℓ2O3(s), ואדי מים.
התרכובת Mg(OH)2(s) מתפרקת בטמפרטורות גבוהות למוצק מגנזיום חמצני, MgO(s), ואדי מים.
- רשמו ניסוח מאוזן לתגובת הפירוק של Aℓ(OH)3(s).
- רשמו ניסוח מאוזן לתגובת הפירוק של Mg(OH)2(s).
- בניסוי 1 חיממו 3.9 גרם של Aℓ(OH)3(s). כל החומר התפרק.
מהו מספר המולים של אדי מים שהתקבלו בתגובה? פרטו חישוביכם. - בניסוי 2 חיממו מסה נתונה של Mg(OH)2(s). כל החומר התפרק. מספר המולים של אדי המים שהתקבלו בתגובה היה זהה למספר המולים של אדי המים שחישבתם בסעיף ו.
האם מספר המולים של Mg(OH)2(s) שהתפרק בניסוי 2 זהה למספר המולים של Aℓ(OH)3(s) שהתפרק בניסוי 1? פרטו את חישוביכם או נמקו באופן מילולי. - שתי תגובות הפירוק של Aℓ(OH)3(s) ושל Mg(OH)2(s) תורמות להורדת הטמפרטורה של הסביבה באזור הבעירה. האם תגובות הפירוק הן אנדותרמיות או אקסותרמיות? הסבירו את תשובתכם.
11. מבנה וקישור, אנרגייה
השאלה עוסקת בשני חומרים: אתאנול, C2H5OH(ℓ), ואשלגן כלורי, KCℓ(s).
לפניכם שישה איורים, 1-6, המתארים באופן חלקי מבנים מיקרוסקופיים שונים:
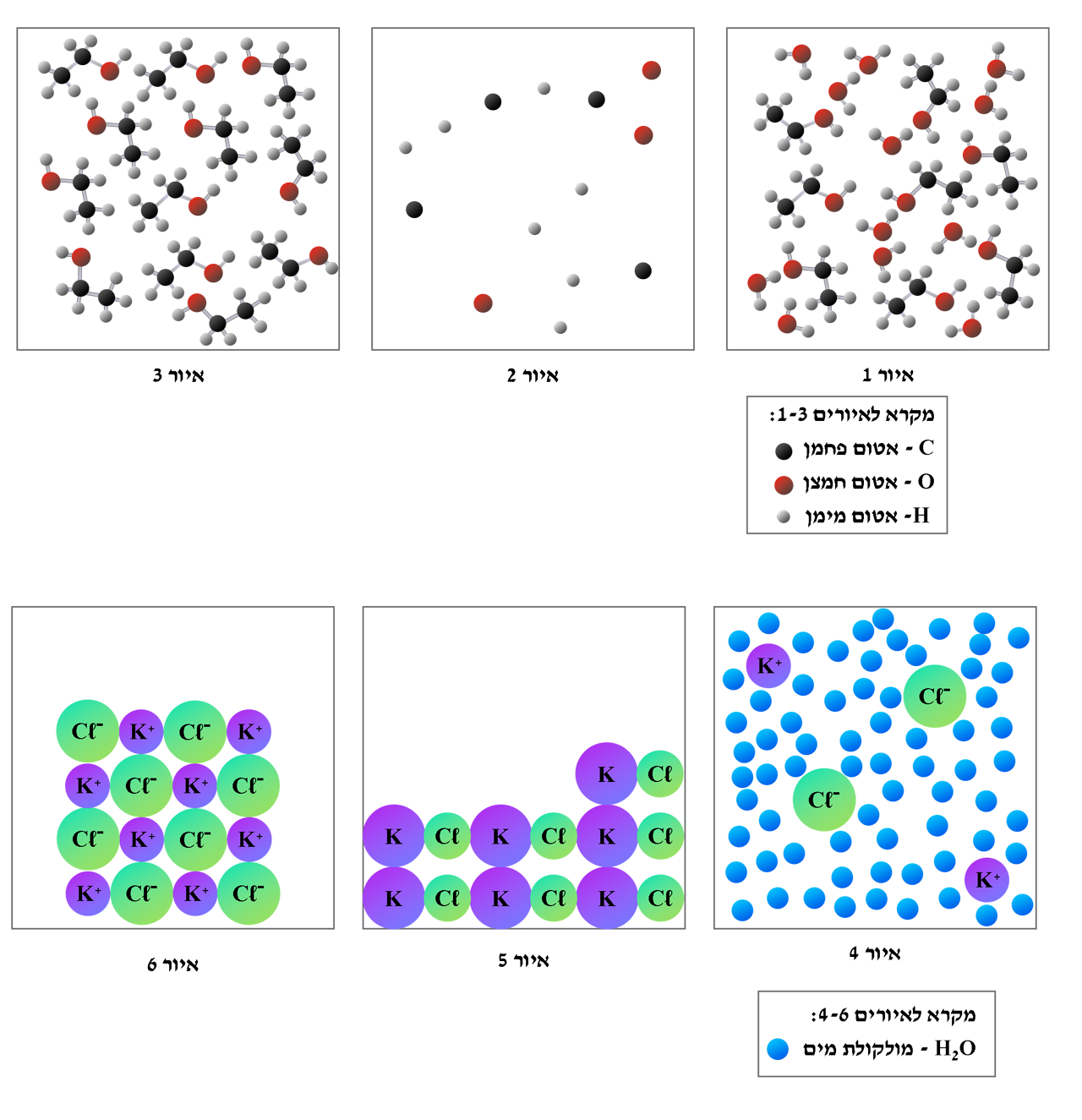
- קבעו מהו האיור המתאר את המבנה המיקרוסקופי של C2H5OH(ℓ) בטמפרטורת החדר, וקבעו מהו האיור המתאר את המבנה המיקרוסקופי של KCℓ(s) בטמפרטורת החדר.
לכלי אחד שבתוכו מים הוסיפו אשלגן כלורי, ולכלי שני שבתוכו מים הוסיפו אתאנול. שני החומרים מתמוססים היטב במים.
מהמסת KCℓ(s) התקבלה תמיסה 1 ומהמסת C2H5OH(ℓ) התקבלה תמיסה 2.
- נסחו את תהליך ההמסה במים של KCℓ(s) .
- נסחו את תהליך ההמסה במים של C2H5OH(ℓ) .
- איזו מן התמיסות, תמיסה 1 או תמיסה 2 מוליכה חשמל? הסבירו מדוע התמיסה שבחרתם מוליכה חשמל.
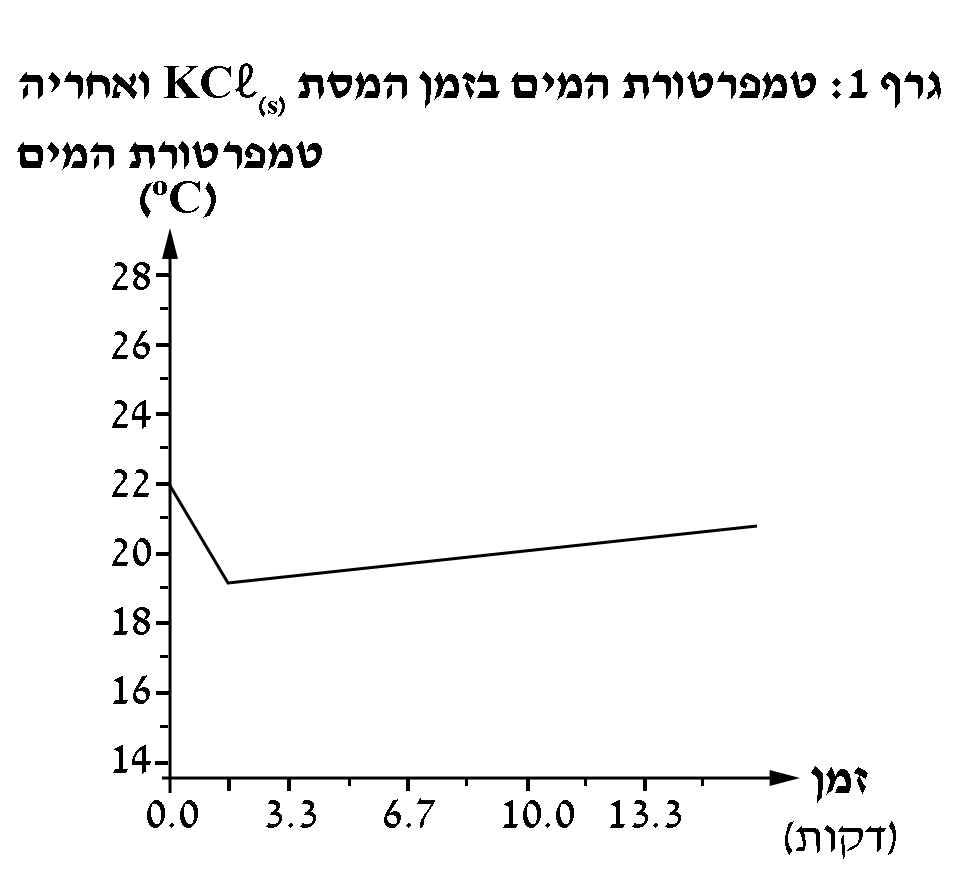
נערך ניסוי שבו המיסו 0.2 מול של KCℓ(s) ב- 200 מ”ל מים בכלי לא מבודד. לפני ההמסה נמדדה טמפרטורת מים התחלתית של 22°C.
לפניכם גרף 1, המתאר את שינוי טמפרטורת המים בזמן המסה ואחריה.
לפניכם שתי דיאגרמות אנרגייה a ו- b:
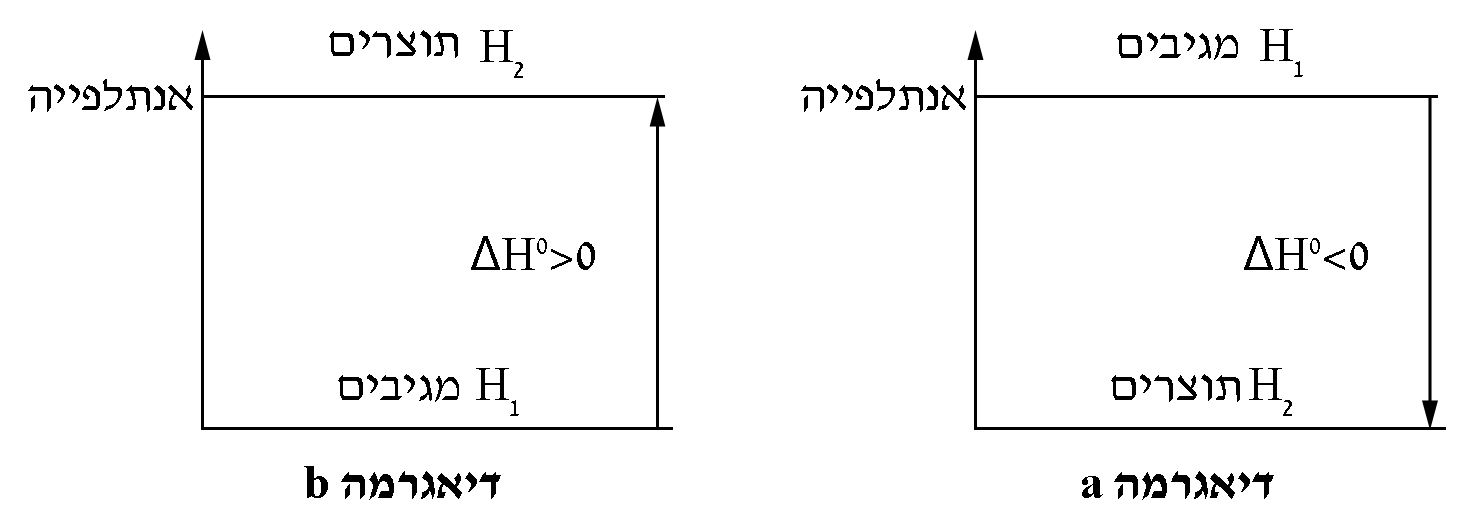
- איזו מן הדיאגרמות a או b , מתארת נכון את שינוי הטמפרטורה בתהליך ההמסה במים של KCℓ(s)?
נמקו את בחירתכם ובססו אותה על גרף 1.
מזגו את החומר ציקלוהקסאן, C6H12(l), לשני כלים: לכלי אחד הוסיפו KCℓ(s) ולכלי השני הוסיפו C2H5OH(ℓ).
ערבבו את החומרים בכל אחד מן הכלים.
רק אחד מן החומרים התמוסס בציקלוהקסאן. התקבלה תמיסה שאינה מוליכה חשמל.
- איזה חומר מבין החומרים התמוסס? נמקו מדוע.
- נסחו את תהליך ההמסה בציקלוהקסאן.
12. חומצות שומן
לפניכם טבלה שבה מוצגות כמה חומצות שומן:
| חומצת שומן | סמל | ייצוג מקוצר לנוסחת המבנה של מולקולת החומר | טמפרטורת היתוך (C°) |
| חומצה בוטירית | B | 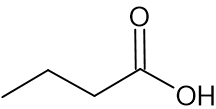 | -5.7 |
| חומצה קפרילית | Oc | 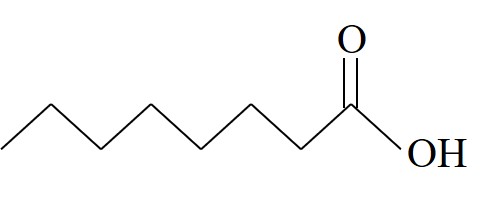 | 16.3 |
| חומצה לאורית | La | 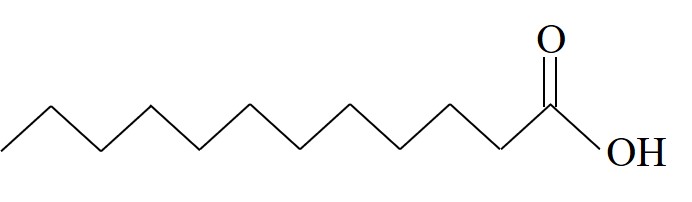 | 43.8 |
| חומצה סטארית | S | 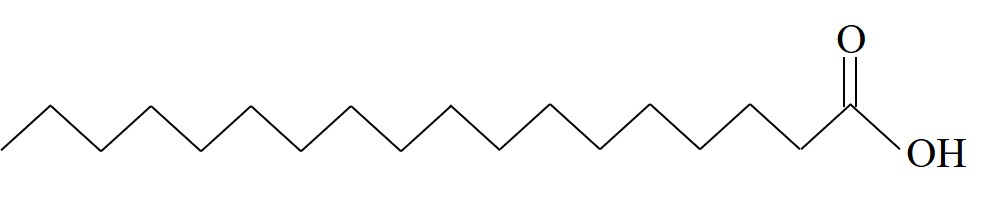 | 69.3 |
| חומצה לינולאית | L | 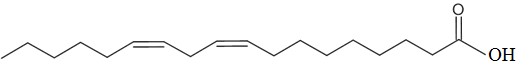 | -5.9 |
- כתבו רישום מקוצר של כל אחת מחומצות השומן שמוצגות בטבלה.
- מהו הגורם לכך שטמפרטורת ההיתוך של חומצה לינולאית (L) נמוכה מטמפרטורת ההיתוך של חומצה סטארית (S)?
חומצה קפרית, שסמלה D, היא חומצת שומן רוויה שמכילה 10 אטומי פחמן.
- רשמו ייצוג מקוצר לנוסחת המבנה של מולקולת חומצה קפרית.
- היעזרו בנתונים שבטבלה וקבעו אם טמפרטורת ההיתוך של חומצה קפרית היא 4°C או 31.6°C.
ציינו את הגורם שהתבססתם עליו בתשובתכם. - כאשר מוסיפים מימן, H2(g) , לחומצה לינולאית בנוכחות זרז מתאים, מקבלים חומצה סטארית.
כמה מול מימן, H2(g), נדרשים לתגובה מלאה עם 1 מול חומצה לינולאית? הסבירו את תשובתכם. - שמן קוקוס עשיר בטריגליצרידים שמורכבים מחומצות שומן רוויות, שלהן שרשרות אטומי פחמן באורך בינוני.
לדוגמה, הטריגליצריד OcLaD, שנוצר מגליצרול, חומצה קפרילית, חומצה לאורית וחומצה קפרית.
לפניכם ייצוג מקוצר לנוסחת המבנה של מולקולת הגליצרול: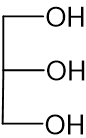 איזה ייצוג מקוצר מבין שלוש המולקולות (1) – (3) שלפניכם מתאר נכון את נוסחת המבנה של מולקולת הטריגליצריד OcLaD?
איזה ייצוג מקוצר מבין שלוש המולקולות (1) – (3) שלפניכם מתאר נכון את נוסחת המבנה של מולקולת הטריגליצריד OcLaD?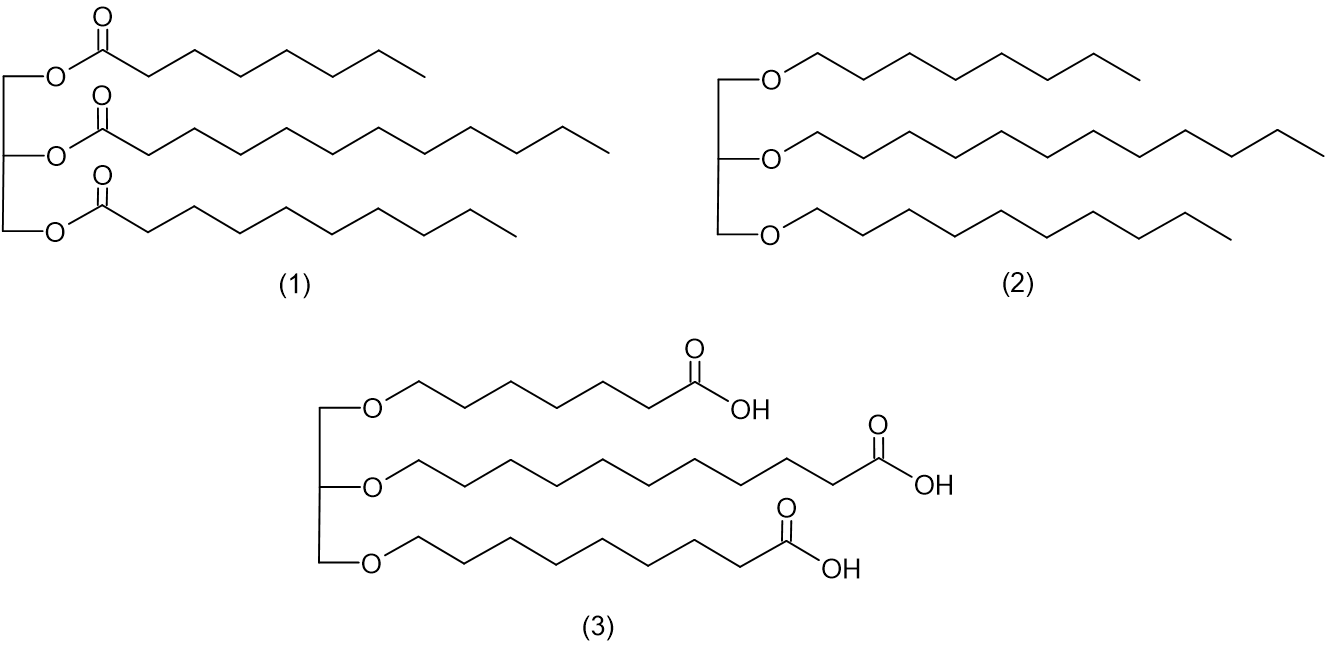
- עשב טרי מכיל, בין השאר בטא קרוטן, שצבעו צהוב כתום.
לפניכם ייצוג מקוצר לנוסחת מבנה של מולקולת בטא- קרוטן: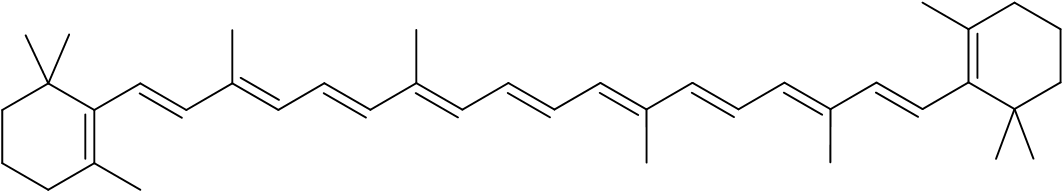
חמאה, שמיוצרת מחלב פרות שניזונות מעשב טרי, צבעה צהוב בגלל החומר בטא-קרוטן שנמצא בחלב של פרות אלה. חמאה מכילה 81% שומנים, כ-18% מים ועוד חומרים.
קבעו אם בטא קרוטן מתמוסס בשומנים או במים שבחמאה. הסבירו את קביעתכם. בתשובתכם התייחסו לכוחות הפועלים בין המולקולות.
13. חמצון־חיזור, חישובים
השאלה עוסקת בשני ניסויים.
ניסוי 1:
נתונות שלוש מבחנות 1-3:
מבחנה 1 מכילה תמיסה של יוני כלור Cℓ–(aq) ויוני נתרן Na+(aq).
מבחנה 2 מכילה תמיסה של יוני ברום Br–(aq) ויוני נתרן Na+(aq).
מבחנה 3 מכילה תמיסה של יוני יוד I–(aq) ויוני נתרן Na+(aq).
לכל אחת מהמבחנות הוסיפו תמיסת Cℓ2(aq).
לפניכם איורים המתארים את המבחנות 1-3 לפני הוספת תמיסת Cℓ2(aq) ואחריה:

- על פי איור 2, תארו תצפית אחת לכל אחת מן המבחנות לאחר הוספת תמיסת Cℓ2(aq).
בניסוי התרחשו תגובות רק בשתיים משלוש המבחנות.
לפניכם ניסוח נטו של התגובות שהתרחשו במהלך הניסוי:
Cℓ2(aq) +2I–(aq) → I2(aq) + 2Cℓ–(aq) : I תגובה
Cℓ2(aq) +2Br–(aq) → Br2(aq) + 2Cℓ–(aq) : II תגובה
- קבעו את דרגות החמצון של כל אחד מן החלקיקים המשתתפים בשתי התגובות.
- לפניכם שני היגדים (1) ו- (2) המתייחסים לתגובות שהתרחשו. קבעו עבור כל היגד אם הוא נכון או לא נכון.
נמקו כל אחת מן הקביעות:
(1) בשתי התגובות I ו- II המחמצן הוא Cℓ2(aq).
(2) בשתי התגובות I ו- II המחזר הוא Cℓ–(aq).
בתום הניסוי היה נפח התמיסה במבחנה שבה התרחשה תגובה IIפ5 מ”ל.
ריכוז יוני הכלור Cℓ–(aq) בתום התגובה היה 0.1M.
- מהו מספר מולקולות הברום, Br2(aq), שהתקבלו בתגובה? פרטו חישוביכם.
נתון: ב-1 מול יש 1023×6.02 חלקיקים.
ניסוי 2:
הדליקו צמר ברזל, המורכב בעיקר מברזל מוצק, Fe(s).
בתגובה Fe(s) מגיב עם החמצן שבאוויר O2(s), ומתקבלת התרכובת היונית המוצקה ברזל חמצני.
אטומי ברזל יוצרים שני סוגי יונים: Fe2+ ו- Fe3+. לכן קיימות שתי תרכובות אפשריות של ברזל חמצני, שכל אחת מהן מתאימה לאחד מן היונים האלה.
- רשמו את הנוסחאות של שתי התרכובות האפשריות של ברזל חמצני בטמפרטורת החדר.
בניסוי המתואר התקבל המוצק היוני שבו יון הברזל Fe3+.
- נסחו ואזנו את התגובה שהתרחשה בניסוי.
- האם התגובה שניסחתם היא תגובת חמצון־חיזור?
אם כן, קבעו מהו המחמצן ומהו המחזר. אם לא, נמקו את תשובתכם. - בניסוי הגיבו 9.8 גרם צמר ברזל, Fe(s), עם חמצן, O2(g), לפי התגובה שניסחתם בסעיף ו.
מהי מסת הברזל החמצני שהתקבל בתגובה? פרטו את חישוביכם.
14. חומצות ובסיסים
בטבלה שלפניכם מוצגים נתונים על ארבע תמיסות מימיות (1) – (4). כל התמיסות חסרות צבע.
| התמיסה | נוסחת החומר שהוכנס למים | נפח התמיסה (מ”ל) | ריכוז התמיסה (M) |
| (1) | KOH(s) | 100 | 1 |
| (2) | Ba(OH)2(s) | 100 | 1 |
| (3) | HCℓ(g) | 100 | 1 |
| (4) | H2SO4(ℓ) | 100 | 1 |
- נסחו את התהליך שמתרחש כאשר מכניסים למים כל אחד מן החומרים המוצגים בטבלה:
KOH(s) , Ba(OH)2(s) , HCℓ(g) , H2SO4(ℓ) - דרגו את התמיסות (1) – (4) לפי ה- pH מן הנמוך לגבוה.
- הוסיפו 100 מ”ל מים מזוקקים לכל אחת מן התמיסות.
קבעו עבור כל אחד מן ההיגדים II-I אם הוא נכון או לא נכון. נמקו כל קביעה.- ריכוז התמיסה השתנה.
- דירוג התמיסות לפי ה- pH השתנה.
לפניכם טבלה שבה מוצגים הנתונים על הצבע של שלושה אינדיקטורים בערכי pH שונים.
צבעים של אינדיקטורים בערכי pH שונים
| אינדיקטור | pH 14 | pH 12 | pH 10 | pH 7 | pH 4 | pH 2 | pH 0 |
| מי כרוב | צהוב | ירוק | ירוק | כחול | ורוד | אדום | אדום |
| פנול פתלאין | ורוד | ורוד | ורוד | חסר צבע | חסר צבע | חסר צבע | חסר צבע |
| מתיל אורנג’ | צהוב | צהוב | צהוב | צהוב | כתום | אדום | אדום |
- התבססו על הנתונים וקבעו עבור כל אחד מן ההיגדים iii-i אם הוא נכון או לא נכון. נמקו כל קביעה.
- פנול פתלאין הוא אינדיקטור המאפשר את זיהוי התמיסות הבסיסיות מבין התמיסות (1) – (4).
- אפשר להבחין בין תמיסה (2) ובין תמיסה (3) בעזרת האינדיקטור מי כרוב.
- אפשר להבחין בין תמיסה (1) ובין תמיסה (2) בעזרת האינדיקטור מתיל אורנג’.
ערבבו את התמיסות זו עם זו על פי המתואר בטבלה שלפניכם. התרחשה תגובה בכל ערבוב.
נתון: כל תרכובות האשלגן (K) הן חומרים קלי תמס, ואילו באריום גופרתי, BaSO4(s), הוא חומר לבן קשה תמס.
- ענו בנוגע לכל אחד מן הניסויים IV-I שלפניכם:
- מהו תחום ה- pH של התמיסה לאחר הערבוב?
- האם התמיסה לאחר הערבוב מוליכה חשמל?
| מספר ניסוי | התמיסות שעורבבו | תצפיות על התמיסה לאחר הערבוב | תחום ה- pH של התמיסה לאחר הערבוב (חומצי או בסיסי או ניטרלי) | הולכת חשמל של התמיסה לאחר הערבוב (מוליכה חשמל או לא מוליכה חשמל) |
| I | (1) ו- (3) | התמיסה צלולה | ||
| II | (1) ו- (4) | התמיסה צלולה | ||
| II | (2) ו- (3) | התמיסה צלולה | ||
| IV | (2) ו- (4) | נוצר משקע לבן |
- בניסויים III-I התרחשו תגובות שיש להן אותו ניסוח נטו. כתבו ניסוח זה.
- בחרו מבין הניסוחים (1)-(3), מהו הניסוח המתאים לתגובה שהתרחשה בניסוי IV.
(1) Ba2+(aq) + 2OH–(aq) + 2H3O+(aq) + SO42-(aq)→ Ba2+(aq) + SO42-(aq) + 2H2O(ℓ)
(2) Ba(OH)2(aq) + H2SO4(ℓ) → BaSO4(s) + 2H2O(ℓ)
(3) Ba2+(aq) + 2OH–(aq) + 2H3O+(aq) + SO42-(aq) → BaSO4(s) + 4H2O(ℓ)

