- מהי היערכות האלקטרונים של היון ?
- 8 , 2
- 6 , 2
- 2 , 8 , 2
- 4 , 8 , 2
הסבר
ליסוד Mg יש הערכות אלקטרונים 2,8,2
ליון מגנזיום +Mg2 יש 2 אלקטרונים פחות ולכן ההערכות האלקטרונים היא:
2,8.
- מסמלים יסוד בסימול שרירותי A.
מספר המסה של אחד מאטומי היסוד A הוא 87.
מספר הנויטרונים באטום זה הוא 49 .
מהו היון המתאים לאטום היסוד A?- +A2
- –A2
- +A
- +A3
הסבר
נחסר את מספר המסה פחות מספר הנויטרונים.
מספר הפרוטונים הוא: 38 = 49 – 87
מדובר ביסוד Sr שנמצא בטור השני בטבלה המחזורית ולכן מטענו 2+.
- בטבלה שלפניך מוצג מידע על המבנה המרחבי של ארבע מולקולות
המולקולה CF4 CH2Cℓ2 C2F2 HCN המבנה המרחבי של המולקולה טטראדר טטראדר קווית קווית לפניך ארבעה צמדים של מולקולות. באיזה צמד שתי המולקולות הנתונות הן קוטביות?
- HCN ו- C2F2
- HCN ו- CH2Cℓ2
- CF4 ו- C2F2
- CF4 ו- CH2Cℓ2
- האותיות X ו- Y הם סמלים שרירותיים המייצגים שני יסודות הנמצאים בשורה השנייה או בשורה השלישית של הטבלה המחזורית.
היסוד X נמצא בטור 1 של הטבלה המחזורית.
היסוד Y נמצא בטור 6 של הטבלה המחזורית.
בתגובה בין היסודות X ו- Y התקבלה תרכובת המתמוססת במים.
מבין ההיגדים א – ד, מהו ההיגד הנכון בנוגע לתרכובת זו?- מצב הצבירה של התרכובת בטמפרטורת החדר הוא גז.
- נוסחת התרכובת היא XY2(s).
- התמיסה המימית של התרכובת מוליכה חשמל.
- בטמפרטורת החדר, התרכובת מורכבת ממולקולות שנוסחתן המולקולרית היא X2Y.
הסבר
היסוד X הוא מתכת מהטור הראשון.
היסוד Y אל מתכת מהטור השישי.
התרכובת המתקבלת ביניהם היא תרכובת יונית ולכן התמיסה המימית של חומר זה מוליכה זרם חשמלי כי יש בה יונים ממוימים ניידים. - לפניך טבלה ובה נתונים על שלושה חומרים.
שם החומר מצב צבירה
בטמפרטורת החדרייצוג מלא של נוסחת המבנה
של המולקולה2 – פרופאנול נוזל 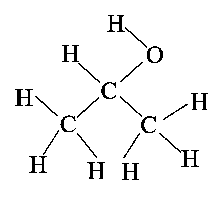
אצטון נוזל 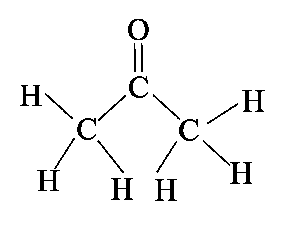
אוקטאן נוזל 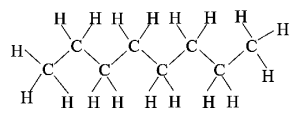
לפניך ארבעה היגדים IV–I המתארים תופעות. כל ההיגדים נכונים.
- טמפרטורת הרתיחה של 2-פרופאנול גבוהה מזו של אצטון.
- טמפרטורת הרתיחה של אוקטאן גבוהה מזו של 2-פרופאנול.
- 2-פרופאנול מתמוסס באוקטאן.
- אצטון מתמוסס במים.
אילו מן ההיגדים מתארים תופעות שאפשר להסביר על ידי אינטראקציות ון־דר־ולס בלבד?
- היגדים I ו- III.
- היגדים II ו- III.
- היגדים I ו- IV.
- היגדים II ו- IV.
הסבר
טמפרטורת הרתיחה של אוקטאן גבוהה מזו של 2 פרופאנול. אף על פי שבין מולקולות האוקטאן ישנן רק אינטראקציות ון־דר־ולס למולקולות חומר זה יש ענן אלקטרונים גדול בהרבה מזה של מולקולות 2-פרופאנול (שבין המולקולות שלו ישנם קשרי מימן ואינטרקציות ון־דר־ולס).
אינטראקציות הון־דר־ולס בין מולקולות האוקטאן חזקות מקשרי המימן ואינטראקציות הון־דר־ולס שבין מולקולות 2-פרופאנול, נדרשת אנרגייה רבה יותר לניתוק אינטראקציות הון־דר־ולס שבין מולקולות האוקטאן, ולכן טמפרטורת הרתיחה של אוקטאן גבוהה מזו של 2-פרופאנול (נוסף על כך למולקולות אוקטאן שטח פנים גדול מזה של 2-פרופאנול).
2-פרופאנול מתמוסס באוקטאן, כי בערבוב החומרים נוצרות אינטראקציות ון־דר־ולס בין מולקולות 2-פרופאנול לבין מולקולות אוקטאן. - ההיגדים א – ד מתארים מדגמים שונים של חומרים.
איזה מבין המדגמים המתוארים מכיל את מספר האטומים הכולל הגדול ביותר?- 2.56 גרם גופרית S8(s) .
- 0.2 מול מולקולות פחמן דו־חמצני, CO2(g).
- 1.6 גרם מתאן, CH4(g).
- 0.1 מול מולקולות הקסאן, C6H14(ℓ).
הסבר
אטומים S8(s) 8 : 1 יחס מולים 2.56 m (גרם) 256 Mw (גרם למול) 0.08 0.01 n (מול) 6.02×1023 NA (אטומים/מול) 4.816×1022 N (אטומים) אטומים CO2(g) 3 : 1 יחס מולים 0.6 0.2 n (מול) 6.02×1023 NA (אטומים/מול) 3.612×1023 N (אטומים) אטומים CH4(g) 5 : 1 יחס מולים 1.6 m (גרם) 16 Mw (גרם למול) 0.5 0.1 n (מול) 6.02×1023 NA (אטומים/מול) 3.01×1023 N (אטומים) אטומים C6H14(ℓ) 20 : 1 יחס מולים 2 0.1 n (מול) 6.02×1023 NA (אטומים/מול) 1.204×1024 N (אטומים) מספר האטומים הגדול ביותר במדגם ד
- בארבעה ניסויים הוסיפו תמיסת NaOH(aq) בריכוז 1M לארבע תמיסות של חומצות שונות.
לאיזו תמיסה מבין התמיסות א – ד יש להוסיף את הנפח הגדול ביותר של תמיסת NaOH(aq) כדי להגיע לסתירה מלאה של תמיסת החומצה.- 10 מ”ל תמיסת HCℓ(aq) בריכוז 1M.
- 10 מ”ל תמיסת HNO3(aq) בריכוז 2M.
- 10 מ”ל תמיסת H2SO4(aq) בריכוז 2M.
- 10 מ”ל תמיסת HBr(aq) בריכוז 3M.
הסבר
יש לחשב באיזו תמיסה מספר המולים של יוני ההידרוניום H3O+(aq) הוא הגדול ביותר.H3O+(aq) H2SO4(aq) 2 : 1 יחס מולים 0.01 V (ליטר) 0.2 C (מול/ליטר) 0.004 0.002 n (מול) בכל התמיסות האחרות מספר מול יוני ההידרוניום קטן יותר ולכן יידרש נפח קטן יותר מתמיסת ה- NaOH(aq)
- התרכובות א – ד מכילות אטומי כלור.
באיזו תרכובת אטומי הכלור יוכלו לעבור רק תהליך חיזור?- HCℓ(g)
- HCℓO(g)
- HCℓO4(g)
- CℓF(g)
הסבר
כדי שאטומי הכלור יעברו רק תהליך חיזור הם צריכים להימצא בדרגת החמצון המקסימאלית שלהם שהיא 7+.
רק בתרכובת HCℓO4(g) דרגת החמצון היא 7+.
9. ניתוח קטע ממאמר מדעי – חובה
- באקונומיקה של אחד היצרנים בארץ יש 30 גרם נתרן היפוכלוריט, NaOCℓ(s), ב-1 ליטר תמיסה.
מהו הריכוז המולרי של נתרן היפוכלוריט בתמיסת אקונומיקה? פרט את חישוביך.
תשובהריכוז התמיסה הוא 0.4M.
- נסח את תהליכי ההמסה במים של אמוניה, NH3(g), נתרן הידרוקסיד, NaOH(s), ומימן כלורי, HCℓ(g).
תשובה(1) NH3(g) + H2O(ℓ) → NH4+(aq) + OH–(aq)
(2) HCℓ(g) + H2O(ℓ) → H3O+(aq) + Cℓ–(aq)
- ציין אם ה- pH של כל אחת מן התמיסות המתקבלות בסעיף ב יהיה קטן, גדול או שווה ל- 7.
תשובה
תמיסה (1) היא בעלת pH גדול מ-7
תמיסה (2) היא בעלת pH קטן מ-7
תמיסה (3) היא בעלת pH גדול מ-7 - התגובה המתרחשת בין תמיסת אקונומיקה ובין תרסיס לניקוי חדרי אמבט, תגובה (1) היא תגובת חמצון־חיזור.
(1) HOCℓ(aq) + H3O+(aq) + Cℓ–(aq) → Cℓ2(g) + 2H2O(ℓ)
קבע מהו המחמצן ומהו המחזר בתגובה (1).
תשובהHOCℓ(aq) + H3O+(aq) + Cℓ–(aq) → Cℓ2(g) + 2H2O(ℓ)
תשובה
אטומי Cℓ בחומר HOCℓ(aq) הם המחמצן. (הם בדרגת חמצון 1+, מקבלים אלקטרונים, יורדים בדרגת החמצון ל- 0 עוברים תהליך חיזור).
ויוני הכלור Cℓ–(aq) הם המחזר (הם בדרגת חמצון 1-, מוסרים אלקטרונים, עולים בדרגת החמצון ל-0 עוברים תהליך חמצון). - ה
- טמפרטורת הרתיחה של אתאנול, C2H5OH(ℓ) היא 78°C ואילו טמפרטורת הרתיחה של אמוניה, NH3(ℓ), היא 33°C -.
מדוע טמפרטורת הרתיחה של אתאנול גבוהה מטמפרטורת הרתיחה של אמוניה? בתשובתך התייחס לכל סוגי הכוחות הפועלים בין המולקולות בכל אחת משתי התרכובות.
תשובה
האתאנול הוא חומר מולקולרי שבין המולקולות שלו ישנן אינטראציות ון־דר־ולס וקשרי מימן.
אמוניה חומר מולקולרי שבין המולקולות שלו קשרי מימן.
קשרי המימן בין מולקולות האתאנול חזקים מקשרי המימן בין מולקולות האמוניה, כיוון שקוטביות הקשר O-H גדולה מקוטביות הקשר N-H.העשרה: אטום המימן החשוף מאלקטרונים במולקולת האתנול נמצא בקשר קוטבי יותר (O-H) לעומת אטומי המימן החשופים מאלקטרונים במולקולת האמוניה (N-H). לכן המטען החלקי החיובי על אטום המימן בקשר O-H גדול יותר, המשיכה החשמלית לזוג אלקטרונים לא קושר על אטום חמצן במולקולת אתאנול סמוכה היא חזקה יותר, לכן נוצרים קשרי מימן חזקים יותר בין מולקולות האתאנול.
בנוסף ענן אלקטרונים של מולקולת האתאנול גדול יותר מענן האלקטרונים של מולקולת אמוניה, אינטראציות הון־דר־ולס בין מולקולות האתאנול חזקות מאינטראקציות הון־דר־ולס בין מולקולות האמוניה (בזכות החלק ההידרופובי, הפחמימני).
סך כל הכוחות בין מולקולות האתנול חזקים יותר ולכן נדרשת אנרגייה רבה יותר לניתוקם ולכן טמפרטורת הרתיחה שלו גבוהה יותר. - כלורופורם, CHCℓ3(ℓ), מתמוסס היטב באתאנול.
נסח את תהליך ההמסה של כלורופורם באתאנול.
תשובה
- טמפרטורת הרתיחה של אתאנול, C2H5OH(ℓ) היא 78°C ואילו טמפרטורת הרתיחה של אמוניה, NH3(ℓ), היא 33°C -.
- התבסס על הקטע וענה על התת סעיפים i – ii:
- רשום ניסוח נטו לתגובה המתרחשת בעת ערבוב תרסיס לניקוי אמבט עם תמיסת סודה קאוסטית.
תשובה
H3O+(aq) + OH–(aq) → 2H2O(ℓ) - קבע מהו הסימן של °ΔH עבור התגובה שניסחת בתת סעיף i. נמק את קביעתך על פי הקטע.
תשובה
סימנו שלילי ΔH° < 0 , כתוב במאמר שבתגובה זו נפלטת אנרגייה זאת אומרת שמדובר בתגובה אקסותרמית.
- רשום ניסוח נטו לתגובה המתרחשת בעת ערבוב תרסיס לניקוי אמבט עם תמיסת סודה קאוסטית.
- לפניך ציטוט מן הקטע: ” תמיסות המכילות את הכוהל אתאנול, C2H5OH(aq), בריכוזים שונים משמשות לניקוי משטחים, בעיקר משטחי זכוכית. אחרי ניקוי המשטח, הכוהל מתנדף במהירות ובצורה אחידה בלי להשאיר סימנים על המשטח”.
נסח את התהליך המתואר בציטוט מן הקטע.
תשובה
CH3CH2OH(aq) → CH3CH2OH(g)
או
CH3CH2OH(ℓ) → CH3CH2OH(g) - הסבר מדוע לאחר ערבוב חומרי ניקוי בטעות, צריך לדלל את התמיסה במים בטמפרטורת החדר ולא לדלל במים חמים.
תשובה
הוספת מים חמים תגרום להגברת האידוי של גזים רעילים הנמצאים בתערובת תרסיס הניקוי. בהוספת מים חמים תעבור אנרגייה מהמים החמים למולקולות בתמיסה, זה יגרום לתנועה מוגברת של החלקיקים בתמיסה ולשחרור של מולקולות גז רעילות לאוויר.
כדי למנוע את זה או להקטין את אידוי הגזים הללו יש להשתמש במי ברז הנמצאים בטמפרטורה נמוכה יותר.
פרק שני (60 נקודות)
10. כימיה של מזון
| ענה על הסעיפים א,ב,ג,ד,ו,ז, ועל אחד מהסעיפים ה או ח. |
שמן חוחובה מופק מזרעי שיח החוחובה ומשמש בעיקר להכנת מוצרים קוסמטיים. שמן החוחובה אינו מכיל טריגליצרידים.
חומצות השומן בשמן החוחובה מופיעות במבנה מיוחד, כמתואר בייצוג המקוצר לנוסחת המבנה של מולקולה (1).
לפניך ייצוג מקוצר לנוסחאות המבנה של שתי מולקולות המצויות בשמנים שונים:
מולקולה (1) 
מולקולה (2) 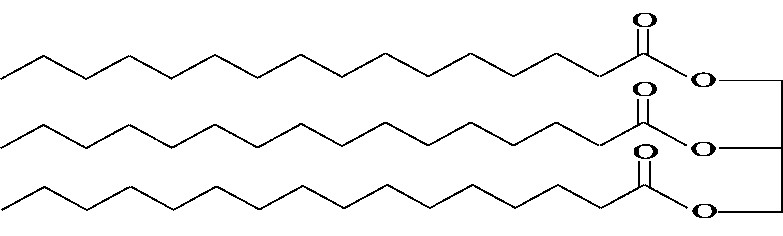
- רשום את הקבוצות הפונקציונליות בכל אחת מן המולקולות (1) ו- (2).
תשובה
במולקולות של חומר (1) יש קבוצות פונקציונליות: אסטר ו- C=C
במולקולות של חומר (2) יש קבוצות פונקציונליות : אסטר
הרכב השמן בזרע החוחובה תלוי באזור הגידול שלו. הטבלה שלפניך מציגה את חומצות השומן העיקריות שמרכיבות את שמן החוחובה המופק מזרעי החוחובה מאזור מסוים במקסיקו.
| חומצת השומן | רישום מקוצר של חומצת השומן | אחוז מכלל חומצות השומן |
| חומצה פלמיטית | C16:0 | 8.1% |
| חומצה אולאית | C18:1ω 9 cis | 19.7% |
| חומצה גונדואית | C20:1ω 9 cis | 60.6% |
| חומצה ארוסית | C22:1ω 9 cis | 10.1% |
| חומצות שומן אחרות | 1.5% |
- רשום ייצוג מקוצר לנוסחת המבנה של מולקולת חומצה גונדואית וייצוג מקוצר לנוסחת המבנה של מולקולת חומצה פלמיטית.
תשובה
חומצה גונדואית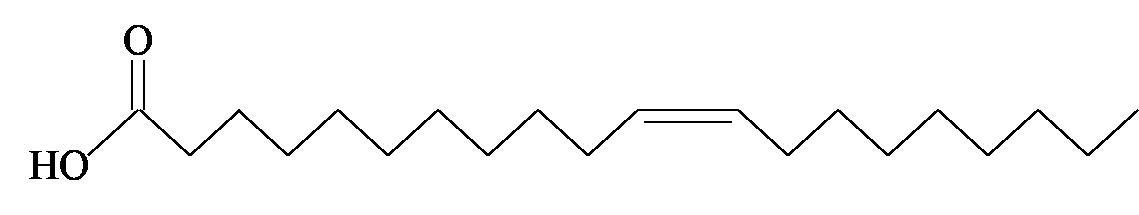 חומצה פלמיטית
חומצה פלמיטית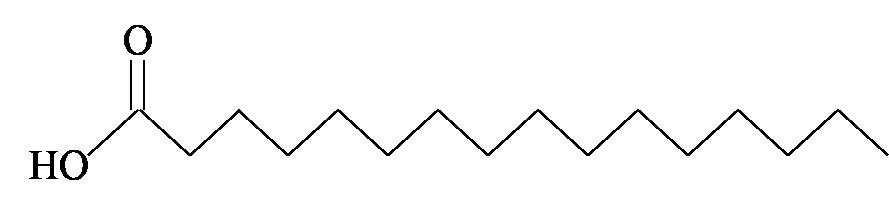
- כמה מול חומצה גונדואית, C19H37COOH(ℓ), אפשר להפיק מ-100 גרם חומצות שומן בשמן חוחובה?
העזר בנתוני הטבלה.
תשובה
אם אחוז החומצה הגונדואית הוא 60.6% אז ב- 100 גרם שמן חוחובה יש 60.6 גרם חומצה גונדואית.
שמן חוחובה מסוג אחר מכיל חומצה אלאידית. חומצה אלאידית היא חומצת שומן אומגה 9 והיא איזומר של חומצה אולאית.
- רשום ייצוג מקוצר לנוסחת המבנה של מולקולת חומצה אלאידית.
תשובה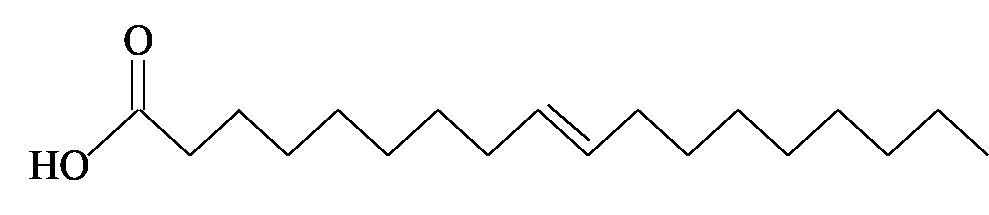
| סעיף ה הוא סעיף בחירה. אם תבחר לענות עליו, אל תענה על סעיף ח. |
- טמפרטורת ההיתוך של חומצה אלאידית גבוהה מטמפרטורת ההיתוך של חומצה אולאית. הסבר מדוע.
תשובה
בין המולקולות של חומצה אולאית ישנן בעיקר אינטראקציות ון־דר־ולס ומעט קשרי מימן. גם בין מולקולות החומצה האלאידית ישנן בעיקר אינטראקציות ון־דר־ולס ומעט קשרי מימן.
למולקולות של שתי החומצות יש אותו גודל ענן אלקטרונים ואותו מספר של קשרי C=C (מדובר באיזומרים).
ההבדל בטמפרטורת ההיתוך נובע מההבדל באיזומריה הגאומטרית של הקשר C=C. לחומצה האולאית יש קשר C=C במבנה גאומטרי ציס. לחומצה האלאידית יש קשר C=C במבנה גאומטרי טְרַנְס.
(העשרה: במצב ציס כיפוף המולקולה גדול יותר ולכן מולקולות החומצה האולאית נארזות במבנה פחות צפוף אינטראקציות הון־דר־ולס שביניהן חלשות יותר וצריך פחות אנרגייה לניתוק הקשרים בין מולקולות החומצה האולאית).
השמן שמופק מזרעים של שיחי חוחובה שגדלים בנגב, מכיל אחוז גבוה יותר של חומצות שומן רוויות. אחת מהן היא חומצה אראכידית.
נתון ייצוג מקוצר לנוסחת המבנה של מולקולת חומצה אראכידית: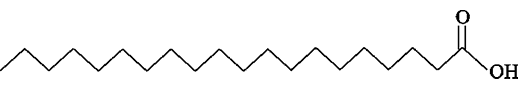
- כתוב רישום מקוצר של חומצה אראכידית.
תשובה
C20:0 - אפשר לקבל חומצה אראכידית מאחת החומצות המוצגות בטבלה בתהליך הידרוגנציה.
קבע איזו חומצה מתאימה לקבלת חומצה אראכידית. הסבר את קביעתך.
תשובה
ניתן לקבל מהחומצה הגונדואית. בעקבות תהליך ההידרוגנציה תתרחש פתיחה של הקשר הכפול (C=C) והוספה של שני אטומי מימן לפחמנים שבקשר הכפול (מתרחש תהליך סיפוח) מתקבלת חומצת שומן רוויה המכילה 20 אטומי פחמן (לחומצה הגונדואית אותו מספר של אטומי פחמן כמו לחומצה האראכידית)
| סעיף ח הוא סעיף בחירה. אם תבחר לענות עליו, אל תענה על סעיף ה. |
- אחת הדרכים להפקת שמן חוחובה היא הוספת הקסאן, C6H14(ℓ) , לזרעים גרוסים וניעורם.
שמן חוחובה מתמוסס היטב בהקסאן, C6H14(ℓ), הסבר מדוע.
תשובה
בערבוב הקסאן עם שמן חוחובה נוצרות אינטראקציות ון־דר־ולס בין מולקולות ההקסאן לבין המולקולות המרכיבות את שמן החוחובה. לכן שמן חוחובה נמס היטב באוקטן.
11. חומצות ובסיסים מבנה וקישור
| ענה על הסעיפים א, ג, ה, ועל אחד מן הסעיפים ב או ד. |
חומץ הוא נוזל ביתי נפוץ שיש בכל מטבח.
הנוזל בעל הריח הייחודי משמש לא רק להכנת רטבים אלא גם לניקוי.
חומץ הוא תמיסה של חומצה אצטית, CH3COOH(ℓ), במים.
- על בקבוק חומץ ביתי רשום חומץ 5% – כלומר ב- 100 מ”ל תמיסה יש 5 גרם של חומצה אצטית.
- חשב את הריכוז המולרי של החומצה האצטית בבקבוק החומץ. פרט את חישוביך.
תשובה
חומצה אצטית מגיבה עם מים על פי תגובה (1):
(1) CH3COOH(ℓ) + H2O(ℓ) → CH3COO–(aq) + H3O+(aq)
- קבע אם ה- pH של תמיסת חומץ קטן מ- 7, גדול מ- 7 או שווה ל- 7. נמק את קביעתך.
תשובה
ה- pH קטן מ-7 כי נוצרו יוני הידרוניום H3O+(aq) בתגובה. התמיסה מכילה עודף יוני הידרוניום.
- חשב את הריכוז המולרי של החומצה האצטית בבקבוק החומץ. פרט את חישוביך.
| סעיף ב הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ד. |
- כדי שהשימוש בחומץ הביתי יהיה בטיחותי לניקוי, מומלץ למהול אותו במים. מוסיפים 400 מ”ל מים (כשתי כוסות) ל- 100 מ”ל חומץ (כחצי כוס).
- חשב את הריכוז המולרי של החומצה האצטית בתמיסת החומץ המתקבלת לאחר המיהול. פרט את חישוביך.
תשובה
n = C × V = 0.83 × 0.1 = 0.083 moℓ - קבע אם ה- pH של תמיסת החומץ לאחר המיהול יהיה גבוה, נמוך או שווה ל- pH של תמיסת החומץ לפני המיהול. הסבר את קביעתך.
תשובה
ה- pH יהיה גבוה יותר כי ריכוז יוני ההידרוניום קטן יותר.
- חשב את הריכוז המולרי של החומצה האצטית בתמיסת החומץ המתקבלת לאחר המיהול. פרט את חישוביך.
כאשר מצב הצבירה של חומצה אצטית הוא גז, חלק ממולקולות החומצה האצטית יוצרות צמדים (דימרים), בכל צמד יש קשרי מימן מחברים בין המולקולות הבודדות.
- קבע באיזה מן האיורים (1)-(3) שלפניך, קשרי המימן הנוצרים בין מולקולות החומצה האצטית מתוארים נכון. נמק את קביעתך.
איור (1)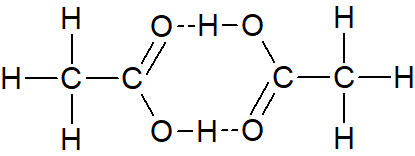 איור (2)
איור (2)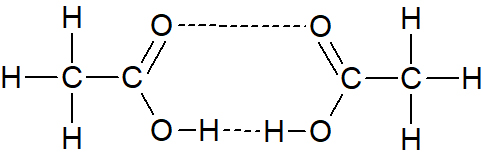 איור (3)
איור (3)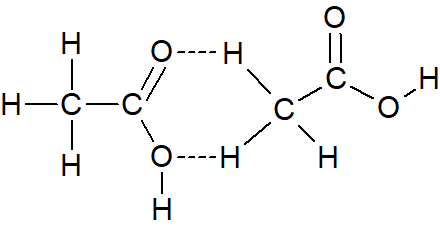 תשובה
תשובה
איור (1) נכון קשרי המימן הם בין אטומי מימן חשופים מאלקטרונים לזוג אלקטרונים לא קושר על אטום חמצן במולקולה סמוכה.
(באיור (2) מתואר קשר בין שני אטומי מימן. באיור 3 משתתף אטום מימן לא חשוף מאלקטרונים)
| סעיף ד הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ב. |
- נוהגים להשתמש בחומץ ביתי להסרת אבנית שמצטברת בקומקום.
נתונה תגובה (2) המתרחשת בין חומצה לבין סידן פחמתי, CaCO3(s), שהוא הרכיב העיקרי של אבנית:(2) CaCO3(s) + 2H3O+(aq) → CO2(g) + 3H2O(ℓ) + Ca2+(aq)
אותה התגובה מתרחשת כאשר מטפטפים תמיסת HCℓ(aq) על סלעים המכילים אבן גיר CaCO3(s).
כך מזהים נוכחות של אבן גיר בסלעים.
- לתמיסת HCℓ(aq) בנפח 10 מ”ל ובריכוז 0.5M הוסיפו CaCO3(s). כל המגיבים הגיבו בשלמות על פי תגובה (2).
חשב מהי מסת הסידן הפחמתי שהגיב בתגובה זו. פרט את חישוביך.
תשובה
נחשב כמה מול יוני הידרונים הגיבוH3O+(aq) HCℓ(aq) 1 : 1 יחס מולים 0.01 V (ליטר) 0.5 C (מול/ליטר) 0.005 0.005 n (מול) כעת נחשב כמה מול CaCO3(s) הגיבו.
CaCO3(s) H3O+(aq) 1 : 2 יחס מולים 0.0025 0.005 n (מול) וכעת נוכל לחשב את מסת CaCO3(s) שהגיבה.
m = n × Mw = 0.0025 × 100 = 0.25 gram
- קבע אם ה- pH של תמיסת HCℓ(aq) במהלך התרחשות תגובה (2), ירד, עלה, או לא השתנה. נמק את קביעתך.
תשובה
ה- pH עולה. במהלך התגובה יוני ההידרוניום H3O+(aq) מגיבים, מספר המולים שלהם קטן ולכן גם ריכוזם קטן ולכן ה-pH עולה.
- לתמיסת HCℓ(aq) בנפח 10 מ”ל ובריכוז 0.5M הוסיפו CaCO3(s). כל המגיבים הגיבו בשלמות על פי תגובה (2).
- לתמיסת HCℓ(aq) בנפח 12 מ”ל ובריכוז 0.5M הוסיפו 0.25 גרם סידן פחמתי CaCO3(s), והוא הגיב במלואו.
האם ה- pH של התמיסה בתום התגובה גדול מ- 7, קטן מ- 7 או שווה ל- 7?.
פרט את חישוביך או נמק במילים.
תשובה
מי שענה על סעיף ד ראה שלתגובה בשלמות הספיקו 10 מ”ל מתמיסת החומצה HCℓ(aq) במקרה זה הוסיפו 12 מ”ל מתמיסת החומצה ולכן נותר עודף יוני הידרוניום וה-pH בתום התגובה קטן מ- 7.
אפשר לחשב באופן הבא:
נחשב כמה מול יוני הידרוניום היו בתמיסה במקרה זה.H3O+(aq) HCℓ(aq) 1 : 1 יחס מולים 0.012 V (ליטר) 0.5 C (מול/ליטר) 0.006 0.006 n (מול) היות ש- CaCO3(s) הגיב בשלמות נוכל לחשב האם נותרה שארית מיוני ההדרוניום.
CaCO3(s) H3O+(aq) 1 : 2 יחס מולים 0.0025 0.006 n (מול) התחלה 0.0025 0.005 n (מול) תגובה 0.001 n (מול) סוף נותר עודף יוני הידרוניום ולכן התמיסה חומצית pH < 7.
12. חמצון־חיזור, חישובים, אנרגייה
| ענה על הסעיפים א, ב, ג, ד, ו, ז ועל אחד מן הסעיפים ג או ה. |
השאלה עוסקת בתרכובת היונית אמון חנקתי NH4NO3(s).
אמון חנקתי מוצק, NH4NO3(s), המוספג בתערובת נוזלית של פחמימנים, הוא חומר נפץ שמשמש לפיצוץ סלעים כדי לסלול דרכים באזורים הרריים. האמון החנקתי מתפרק בעת הפיצוץ.
נתונה תגובת הפירוק המלא של אמון חנקתי, NH4NO3(s):
(1) 2NH4NO3(s) → 2N2(g) + O2(g) + 4H2O(g)
- קבע אם תגובה (1) היא תגובת חמצון־חיזור. נמק את קביעתך.
תשובה
2NH4NO3(s) → 2N2(g) + O2(g) + 4H2O(g)
נקבע דרגות חמצון:ניתן לראות שבמהלך התגובה יש שינויים בדרגות החמצון במעבר מהמגיבים לתוצרים.
לכן יש בתגובה מעברי אלקטרונים.
התגובה היא תגובת חמצון־חיזור.
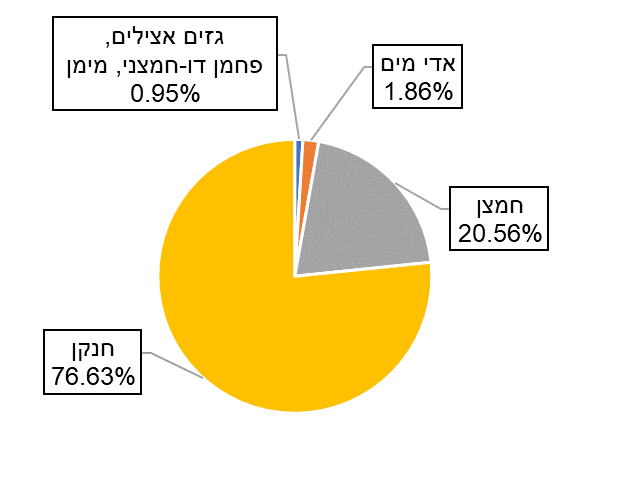
הגרף שלפניך מתאר את הרכב האוויר בטמפרטורה של 25°C ובלחות של 60% בלחץ 1 אטמוספירה.
- תוצרי הפירוק המלא של אמון חנקתי אינם גורמים לזיהום אוויר. הסבר עובדה זו.
תשובה
כל הגזים המתקבלים בתוצרים נמצאים באוויר (על פי התרשים הנתון) ולכן אינם גורמים לזיהום אוויר.
| סעיף ג הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ה. |
- להלן °ΔH לתגובות (2) ו- (3).
(2) N2(g) + 2H2(g) + 1½O2(g) → NH4NO3(s) ΔH02=-365.6kJ
(3) H2(g) + ½O2(g) → H2O(g) ΔH03=-241.8kJ
חשב את ΔH01 עבור תגובה (1), שהיא תגובת הפירוק המלא של אמון חנקתי.
תשובה
נעזר בחוק הס
את תגובה (2) נהפוך ונכפול ב-2
את תגובה (3) נכפול ב- 4 - בפירוק החלקי של אמון חנקתי, NH4NO3(s), מתקבלות תרכובות חנקן שונות כגון N2O(g) ו- NO2(g).
חשב את דרגות החמצון של אטומי החנקן בכל אחד מסוגי היונים המרכיבים את NH4NO3(s) ובשתי תרכובות החנקן הנתונות.
תשובה
| סעיף ה הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ג. |
- התרכובת אמון חנקתי, NH4NO3(s), משמשת בעיקר לדשן לגידולים חקלאיים.
אמון חנקתי, NH4NO3(s), נוצר בתגובה של חומצה חנקתית, HNO3(ℓ), עם אמוניה גזית, NH3(g).
ניסוח התגובה הוא:(4) NH3(g) + HNO3(ℓ) → NH4NO3(s)
חשב את מסת האמוניה, NH3(g), שנדרשת להכנת 1.0 ק”ג אמון חנקתי, NH4NO3(s), על פי תגובה (4).
נתון: 1 ק”ג = 1,000 גרם.
תשובה
נחשב את מספר המולים של אמון חנקתי NH4NO3(s).כעת נחשב את מספר מול אמוניה שהגיבה
NH3(g) NH4NO3(s) 1 : 1 יחס מולים 12.5 12.5 n (מול) וכעת נחשב את מסת האמוניה.
m = n × Mw = 12.5 × 17 = 212.5 gram
לדישון בעונת הקיץ, הדשן אמון חנקתי, NH4NO3(s), משווק בתמיסה מימית בריכוז 9.5M.
- רשום ניסוח לתגובת ההמסה של אמון חנקתי, NH4NO3(s), במים.
תשובה - לדישון בעונת החורף משתמשים בתמיסה בריכוז אחר – 7.9M.
איזו מן הפעולות c-a שלפניך יש לבצע בתמיסה לדישון בעונת הקיץ כדי שתתאים לדישון בעונת החורף? הסבר את בחירתך.- הקטנת נפח התמיסה על ידי אידוי מים.
- הגדלת נפח התמיסה על ידי הוספת מים.
- הוספת אמון חנקתי מוצק, NH4NO3(s), לתמיסה.
תשובה
התשובה היא b.
יש להקטין את הריכוז. הוספת מים תגדיל את נפח התמיסה אך לא תשנה את מספר המולים של המומס אמון חנקתי, לכן הריכוז יקטן.
13. מבנה וקישור, אנרגייה
| ענה על הסעיפים א, ב, ג, ד, ועל אחד מן הסעיפים ה או ו. |
אלכוג’ל הוא חומר שמשמש לחיטוי וניקוי הידיים כאשר מים וסבון אינם זמינים.
האלכוג’ל הוא תערובת נוזלית של שני סוגי כוהל שונים המומסים במים.
לפניך טבלה ובה נתונים על כהלים שאפשר למצוא באלכוג’ל.
| שם הכוהל | טמפרטורת רתיחה (C°) | ייצוג מקוצר של נוסחת מבנה של מולקולת הכוהל | |
| 1 | אתאנול | 78 | |
| 2 | 1-פרופאנול | 97 | |
| 3 | 2-פרופאנול | 82 | |
| 4 | גליצרול |
- א
- רשום נוסחת ייצוג אלקטרונים לכל אחת ממולקולות הכוהל הרשומות בטבלה.
תשובה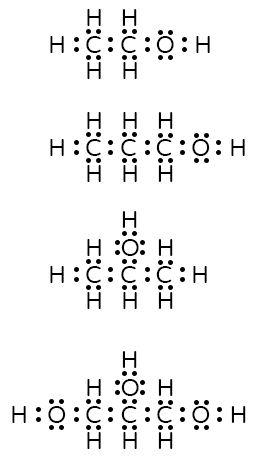
- אילו שני כהלים מבין הכהלים הנתונים בטבלה הם איזומרים?נמק.
תשובה
חומרים 2, 3 הם איזומרים כי יש להם אותה נוסחה מולקולרית אבל נוסחת מבנה שונה.
- רשום נוסחת ייצוג אלקטרונים לכל אחת ממולקולות הכוהל הרשומות בטבלה.
- הסבר מדוע טמפרטורת הרתיחה של 1-פרופאנול גבוהה מטמפרטורת הרתיחה של אתאנול.
תשובה
שני החומרים הם חומרים מולקולריים בין המולקולות שלהם ישנם קשרי מימן ואינטראקציות ון־דר־ולס. למולקולות של שני החומרים מספר זהה של מוקדים ליצירת קשרי מימן.
למולקולות של 1-פרופאנול ענן אלקטרונים גדול יותר ושטח פנים גדול יותר, ולכן אינטראקציות הון־דר־ולס בין המולקולות של 1-פרופאנול חזקות יותר, נדרשת יותר אנרגייה לפירוקן, לכן טמפרטורת הרתיחה של 1-פרופאנול גבוהה יותר. - איזה מבין ההיגדים (1) – (3) שלפניך מסביר את ההבדל בין טמפרטורת הרתיחה של 1-פרופאנול לבין טמפרטורת הרתיחה של 2-פרופאנול. נמק.
(1) שטח הפנים של מולקולת 1-פרופאנול גדול משטח הפנים של מולקולת 2-פרופאנול.
(2) מולקולת 1-פרופאנול היא קוטבית, ואילו מולקולת 2-פרופאנול אינה קוטבית.
(3) גודל ענן האלקטרונים של מולקולת 1-פרופאנול שונה מגודל ענן האלקטרונים של מולקולת 2-פרופאנול.
תשובה
התשובה היא (1).
בין המולקולות של שני החומרים יש קשרי מימן ואינטראקציות ון־דר־ולס.
למולוקולות של שני החומרים יש ענן אלקטרונים זהה (הם איזומרים) ואותו מספר מוקדים ליצירת קשרי מימן.
שטח הפנים של מולקולת 1-פרופאנול גדול יותר (המולקולה פחות מסועפת) לכן שטח המגע בין מולקולות 1-פרופאנול גדול יותר. אינטראקציות הון־דר־ולס בין המולקולות של 1-פרופאנול חזקות יותר, נדרשת יותר אנרגייה לפירוקן. לכן טמפרטורת הרתיחה של 1-פרופאנול גבוהה יותר. - קבע אם טמפרטורת הרתיחה של גליצרול גבוהה מטמפרטורת הרתיחה של 2-פרופאנול או נמוכה ממנה. נמק את קביעתך.
בתשובתך התייחס לכל סוגי הכוחות הפועלים בין המולקולות בכל אחת משתי התרכובות.
תשובה
לגליצרול טמפרטורת רתיחה גבוהה יותר.
למולקולות גליצרול יש יותר מוקדים אפשריים ליצירת קשרי מימן בין המולקולות לעומת מולקולות 2-פרופאנול. לכן קשרי המימן שבין מולקולות הגליצרול רבים יותר.
נוסף על כך, למולקולת גליצרול ענן אלקטרונים גדול מענן האלקטרונים של מולקולת 2-פרופאנול, לכן אינטראקציות הון־דר־ולס בין מולקולות גליצרול חזקות יותר.
קשרי המימן ואינטראקציות הון־דר־ולס בין מולקולות הגליצרול חזקים יותר מאשר קשרי המימן ואינטראקציות הון־דר־ולס שבין מולקולות 2-פרופאנול, נדרשת יותר אנרגייה לפירוקם. לכן טמפרטורת הרתיחה של גליצרול גבוהה יותר.
| סעיף ה הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ו. |
- אם נרטיב את כפות ידינו במים, נשפוך עליהן אלכוג’ל המכיל 70% אתאנול, C2H5OH(ℓ), ונשפשף אותן מעט זו בזו, נרגיש שהידיים מתחממות
- האם בתהליך המתואר הידיים קולטות אנרגייה או פולטות אנרגייה? נמק.
תשובה
היות שהידיים הן הסביבה והן מתחממות ניתן לקבוע שהידיים קולטות אנרגייה. יש מעבר אנרגייה מהמערכת לסביבה (התגובה היא תגובה אקסותרמית) - קבע איזו מן התגובות (1) או (2) היא התגובה הגורמת לתחושת ההתחממות בידיים. נמק את קביעתך.אם נרטיב את כפות ידינו במים, נשפוך עליהן אלכוג’ל המכיל 70% אתאנול, C2H5OH(ℓ), ונשפשף אותן מעט זו בזו, נרגיש שהידיים מתחממות.
תשובה
התגובה המתרחשת היא תגובה אקסותרמית (יש מעבר אנרגייה מהמערכת לסביבה) לכן התגובה המתאימה היא תגובה (1). - מהו השינוי שעובר האתאנול על פי התגובה שבחרת בתת סעיף ii : אידוי, המסה במים, עיבוי או פירוק?
תשובה
השינוי הוא המסה במים.
- האם בתהליך המתואר הידיים קולטות אנרגייה או פולטות אנרגייה? נמק.
| סעיף ו הוא סעיף בחירה אם תבחר לענות עליו, אל תענה על סעיף ה. |
- יש להימנע משימוש באלכוג’ל ליד מקור אש שכן החומר דליק ועלול לגרום לשרפה.
נתונות ארבע דיאגרמות של שינוי אנתלפיה.
מהי הדיאגרמה שמתארת בצורה הנכונה את שינוי האנתלפיה בתגובת השריפה של אתאנול?
נמק את בחירתך, והסבר מדוע פסלת כל אחת מהדיאגרמות האחרות.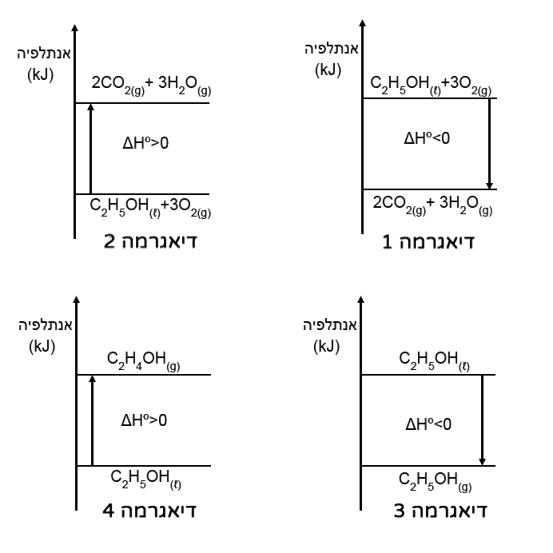
תשובה
הדיאגרמה הנכונה היא דיאגרמה (1).
דיאגרמות (3) ו- (4) מתארות תהליכי אידוי ועיבוי.
היות שתגובת שריפה היא אקסותרמית אז גם דיאגרמה 2 לא מתאימה כי היא מתארת תגובה אנדותרמית.
14. חומרים יוניים, חישובים.
| ענה על הסעיפים ג,ד,ה,ו, ועל אחד מהסעיפים א או ב. |
השאלה עוסקת בחומרים יונים ובתכונותיהם.
| סעיף א הוא סעיף בחירה. אם תבחר לענות עליו, אל תענה על סעיף ב. |
- כל החומרים היוניים הם מוצקים בטמפרטורת החדר.
הסבר קביעה זו ברמה מיקרוסקופית.
תשובה
החומרים היוניים מורכבים מיונים חיוביים ושליליים.
בין היונים בעלי המטענים המנוגדים קיימים קשרים יוניים (משיכה חשמלית חזקה).
בטמפרטורת החדר אין מספיק אנרגייה לפירוק הקשרים היוניים ולכן טמפרטורת ההיתוך גבוהה מטמפרטורת החדר והם מוצקים בטמפרטורת החדר.
| סעיף ב הוא סעיף בחירה. אם תבחר לענות עליו, אל תענה על סעיף א. |
- חומר יוני אינו מוליך חשמל בטמפרטורת החדר.
הסבר קביעה זו ברמה מיקרוסקופית.
תשובה
חומרים יונים במצב צבירה מוצק מורכבים מיונים חיוביים ושליליים שביניהם משיכה חשמלית חזקה. במצב מוצק בחומרים יונים, אין יונים ניידים, ולכן אין מוליכות חשמלית. - לפניך ארבעה ניסוחים (1) – (4)
- קבע איזה מן הניסוחים (1) – (4) מסמל תהליך היתוך של אשלגן יודי, KI(s).
תשובה
תגובה 4 - קבע איזה מן הניסוחים (1) – (4) מסמל תהליך המסה במים של אשלגן יודי, KI(s).
תשובה
תגובה 2
- קבע איזה מן הניסוחים (1) – (4) מסמל תהליך היתוך של אשלגן יודי, KI(s).
- המיסו 16.6 גרם KI(s) במים והתקבלה תמיסה בנפח 1 ליטר.
מהו מספר המולים הכולל של היונים בתמיסה? פרט את חישוביך.
תשובה
ראשית נחשב את מספר המולים של KI(s).K+(aq) KI(s) 1 : 1 יחס מולים 0.1 0.1 n (מול) I–(aq) KI(s) 1 : 1 יחס מולים 0.1 0.1 n (מול) לכן סך כל היונים הוא:
מול 0.2 = 0.1 + 0.1 . - אלומיניום גופרי הוא מוצק שמשמש בתעשייה הכימית ליצירת מימן גופרי, H2S(g).
- רשום את הנוסחה האמפירית של אלומיניום גופרי.
תשובה
Aℓ2S3(s) - אלומיניום גופרי מגיב עם מים ויוצר אלומיניום הידרוקסידי, Aℓ(OH)3(s), ומימן גופרי,
H2S(g). נסח ואזן את התגובה.
תשובה
Aℓ2S3(s) + 6H2O(ℓ) → 2Aℓ(OH)3(s) + 3H2S(g) - מהי המסה של אלומיניום הידרוקסידי, Aℓ(OH)3(s), שנוצר כאשר 30 ק”ג של אלומיניום גופרי מגיבים עם מים? פרט את חישוביך.
נתון: 1 ק”ג = 1000 גרם.
תשובה
נחשב את מספר המולים של האלומיניום הגופרי Aℓ2S3(s).Aℓ(OH)3(s) Aℓ2S3(s) 2 : 1 יחס מולים 400 200 n (מול) 78 MW (גרם למול) 31,200 m (גרם) המסה של אלומיניום גופרי שנוצר היא 31,200 גרם.
- רשום את הנוסחה האמפירית של אלומיניום גופרי.
- מגנזיום גופרתי, MgSO4(s), המכונה “מלח אנגלי” משמש, בין השאר, מלח אמבט להרגעה.
מילאו אמבט במים והמיסו במים מגנזיום גופרתי. נפח התמיסה באמבט היה 220 ליטר וריכוז
יוני המגנזיום, Mg2+(aq), באמבט היה 0.022M.
מהי מסת המגנזיום הגופרתי, MgSO4(s), שהומסה במים? פרט את חישוביך.
תשובהMgSO4(s) Mg2+(aq) 1 : 1 יחס מולים 220 V (ליטר) 0.022 C (מול/ליטר) 4.84 4.84 n (מול) m = n × Mw = 4.84 × 120 = 580.8 gram
