الفلزّات
عائلة الفلزّات هي عائلة إضافيّة تنتمي إلى المباني الضخمة.
إذا أمعنّا النظر في قائمة العناصر الدوريّة نُلاحِظ أنّ غالبية العناصر في القائمة هي من الفلزّات. نُلاحِظ أيضًا أنّ غالبيتها تمتلك صِفات مشتركة تعود إلى مبنى المادّة والجُسيمات التي تكوّنها.
مبنى المادّة الفلزّيّة عبارة عن أيونات موجبة (نوى/كاتيونات) في بحر(سحابة) إلكترونات.
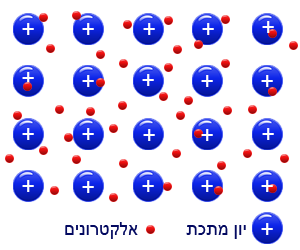
تتماسك الأيونات الموجبة، فيما بينها، بفضل التجاذب الكهربائيّ الذي يتولّد بينها وبين الإلكترونات المُتنقِّلة الموجودة في مبنى المادةّ والتي تتحرّك هناك بشكل حرّ.
سبق ورأينا في درس الرابط الأيونيّ أنّه لا حاجة لطاقة كبيرة لفصل إلكترونات التكافؤ في مُستوى الإلكترونات الأخير في ذرّات الفلزّات. هذا هو السبب في الحصول على المبنى الفلزّي.
في الفلزّات يتكوّن مدار ضخم تتحرّك فيه إلكترونات التكافؤ. هذه إلكترونات غير مُتمركزة أي لا تنتمي لنواة معيّنة. تتواجد هذه الإلكترونات في مدار مشترك، ولكن على عكس الرابط التساهميّ، حيث يكون التشارك بين ذرّتَيْن، فإن التشارك هنا يكون بين العديد من النوى.
يبدو أنّ المبنى الناتج هو مبنى ثلاثيّ الأبعاد تكون فيه الأيونات الموجبة قريبة من بعضها البعض، وذلك بفضل سحابة الإلكترونات التي تربطها معًا.
قوّة التجاذُب الكهربائيّ بين الأيونات الموجبة والإلكترونات المشحونة بشحنة سالبة في سحابة الإلكترونات غير المُتمركزة تميّز المبنى الفلزّيّ.
دعونا نُمعن النظر في مبنى المغنيسيوم:

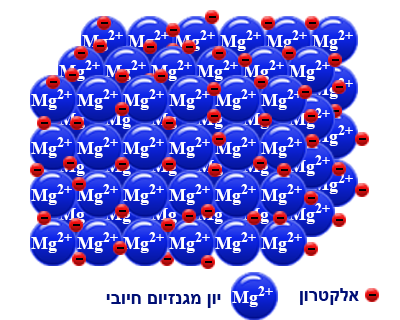
من النموذج الذي يصف مبنى الفلزّ، سنحاول فهم الصِفات التي تميّز معظم الفلزّات.
نُشير إلى أنّنا ذكرنا في بداية الدرس أنّ النموذج الذي يصف المبنى الفلزّيّ هو:
نموذج الكاتيونات في بحر من سحابة الإلكترونات المتنقّلة.
سنحاول وصف صِفات الفلزّات مع التطرّق إلى هذا النموذج.
صِفات وخصائص الفلزّات:
- الرابط يسمّىالرابط الفلزّي.
المستوى الميكروسكوبيّ
- المادّة الفلزّيّة مكوّنة من أيونات موجبة وسحابة إلكترونات مُتنقِّلة (غير مُتمركزة) وتسمّى الشبكة الفلزّيّة.
- القُوى التي تعمل في الرابط هي قوّة التجاذُب الكهربائيّ بين الأيونات الموجبة والإلكترونات السالبة التي تُحيط بها وتتحرّك بشكل عشوائيّ في كلّ الشبكة الفلزّيّة.
المستوى الماكروسكوبيّ
- تكون الموادّ الفلزّيّة صلبة في درجة حرارة الغرفة، باستثناء الزئبق (Hg).
التفسير الميكروسكوبيّ لذلك: بين الجُسَيمات التي تتكوّن منها الفلزّات، هناك تجاذُب كهربائيّ قويّ وبالتالي تنتظم الجُسَيمات في مبنى كثيف ممّا يجعلها تتواجد في الحالة الصلبة. - الفلزّات موصلة للتيّار الكهربائيّ في الحالة الصلبة وكذلك في الحالة السائلة (المُنصهرة).
التفسير الميكروسكوبيّ لذلك: سحابة الإلكترونات المُتنقِّلة التي تسمح بمرور التيّار. - الفلزّات قابلة للتطريق. يمكن تشغيل قوّة خارجيّة على الفلزّات لتغيير شكلها. على الرغم من تشغيل القوّة، الفلزّات لا تنكسر، على عكس الموادّ الأيونيّة التي تتحلّل عند تشغيل قوّة خارجيّة عليها. لقد شرحنا ذلك في درس صِفات الموادّ الأيونيّة.


التجاذُب الكهربائيّ بين الكاتيونات (الأيونات الموجبة) وبين الإلكترونات السالبة يبقى حتى بعد تشغيل القوّة ولذلك المبنى لا يتحلّل. على عكس المادّة الأيونيّة التي تتحلّل عند تشغيل قوّة عليها.
دعونا نلخّص هذا الجزء من الدرس من خلال مقطع فيديو.
السَبَائك
السبيكة هي خليط من الفلزّات. ينتج عن الخليط حالة جديدة تكون فيها المادّة، عادةً، أقوى/أكثر متانةً مقارنةً بالفلزّ الأصليّ النقي. بعض السبائك هي خليط من الفلزّات، بينما هناك سَبائك أخرى تحتوي على خليط من ذرّات موادّ فلزّيّة وذرّات موادّ لافلزّيّة مثل الكربون. تُعتبر ذرّات الكربون أصغر من ذرّات معظم الفلزّات، وتندمج بين الأيونات الموجبة في مبنى الشبكة الفلزّيّة (الرسم a). هناك سبائك مكوّنة من خليط من الفلزّات التي تحتوي على أيونات بأحجام مختلفة (الرسم b) أو مكوّنة من خليط من عدّة فلزّات، أيونات بأحجام مختلفة، إلى جانب ذرّات الكربون (الرسم c).
الوضع الجديد الذي تحتوي فيه السبائك على خليط من أيونات بأحجام مختلفة وأحيانًا أيضًا ذرّات الكربون، يُعيق حركة الأيونات الموجبة، على عكس الوضع في الشبكة الفلزّيّة التي تحتوي فقط على نوع واحد من الأيونات الموجبة، مما يتيح حركة الانزلاق للأيونات الموجبة فوق بعضها البعض عند تشغيل قوّة عليها.



والآن لنتعرّف على بعض الحقائق المثيرة حول الفلزّات.
يجدر بالذكر أنّ معرفة هذه الحقائق ليست مطلوبة في المنهاج التعليميّ.
- الفلزّات موصلة للحرارة.
- الفلزّات لامعة. هي في الواقع تلتقط (تبتلع) الضوء وتبعثه مرّة أخرى. الطاقة المُنبعثة هي الشرارة التي نراها.
- الفلزّات التي تقع في العمود الأوّل تتفاعل مع الماء. في التفاعُل ينبعث غاز هيدروجين قابل للاشتعال كما وتنبعث طاقة. إضافةً لذلك، المحلول الذي نحصل عليه قاعديّ بِطَبيعته. سنتعلّم عن هذا المصطلح ومعناه في فصل الحوامض والقواعد.
يمكن رؤية هذا التفاعُل في مقاطع الفيديو التالية:
الفلزّات القلويّة في الماء
بعض الفلزّات ليّنة جدًا. كما رأيتم في الفيديو، يمكن تقسيمها بالسكّين. - وماذا يحدث للفلزّ الذي يسمّى چاليوم (Ga) وهو فلزّ ليّن جدًا؟
في الفيديو التالي يمكن مشاهدة ما يحدث لملعقة غاليوم صغيرة في كوب شاي.
