الموادّ الأيونيّة
العائلة الأولى التي سنتعرّف عليها، والتي تنتمي لعائلات الموادّ ذات المباني الضخمة، هي عائلة الموادّ الأيونيّة.
تتكوّن الموادّ الأيونيّة نتيجة تجاذُب كهربائيّ بين الأيونات المشحونة بشحنات كهربائيّة متعاكسة.
تعالوا نتذكّر ما هو الأيون.
الأيون هو ذرّة أو مجموعة ذرّات، مجموع عدد بروتوناتها غير مساوٍ لمجموع عدد إلكتروناتها.
إذا كان مجموع عدد الإلكترونات أكبر من مجموع عدد البروتونات، يكون الأيون مشحونًا بشحنة سالبة، أيّ أنّه تكون فيه شحنات سالبة أكثر من الشحنات الموجبة. هذا الأيون يسمّى أنيون.
إذا كان مجموع عدد الإلكترونات أصغر من مجموع عدد البروتونات، يكون الأيون مشحونًا بشحنة موجبة، أيّ أنّه تكون فيه شحنات موجبة أكثر من الشحنات السالبة. هذا الأيون يسمّى كاتيون.
كيف تتكوّن الأيونات؟
انتبهوا إلى أنّنا قلنا إنّ عدد الإلكترونات أكبر أو أصغر، لأنّ ما يتغيّر في عمليّة تكوُّن الأيون في الرابط الأيونيّ هو عدد الإلكترونات، وذلك نتيجة لانتقال الإلكترونات. بعض الذرّات تخسر إلكترونات وأخرى تكسب إلكترونات. الذرّات المشاركة في الرابط لا تخسر أو تكسب بروتونات.
إذا تغيّر عدد البروتونات في الذرّة، ستتغيّر هويّتها أيضًا، وتصبح ذرّة أخرى. يجب أن نتذكّر أنّ عدد البروتونات يشير إلى العدد الذرّيّ للعنصر، ولكلّ عنصر عدد ذرّيّ مختلف.
تعلّمنا في الدروس السابقة، أنّه يمكن إخراج إلكترون من ذرّة معيّنة. هذه العمليّة تحتاج إلى بذل طاقة تسمّى طاقة التأيُّن Ei (Ionization Energy).
حتى عندما تكسب الذرّة إلكترونًا، تنطوي هذه العمليّة على تغيير في الطاقة. هذه الطاقة تسمّى طاقة الميل الإلكترونيّ (Eea (Electron Affinity Energy (هذا المصطلح غير مطلوب في المنهاج التعليميّ).
عندما تتكوّن الأيونات المشحونة بشحنات كهربائيّة متعاكسة، يتكوّن بينها تجاذُب كهربائيّ بحسب قانون كولوم. الأيونات المشحونة تترتّب في الفراغ بحيث تكون حول كلّ أيون سالب أيونات موجبة تحيطه، وحول كلّ أيون موجب أيونات سالبة تحيطه.
القالب الذي يصف المادّة يسمّى شبكة، وهو يصف مبنى المادّة وجُسَيماتها، في الحالة الصلبة.
الشبكة الأيونية مكوّنة من أيونات موجبة محاطة بأيونات سالبة وبالعكس – أيونات سالبة محاطة بأيونات موجبة، وبينها تجاذُب كهربائيّ.
يمكن وصف ذلك على النحو التالي:
سنعود للشبكة الأيونيّة وصفاتها فيما بعد. الآن، أصبحنا نفهم لماذا لا يمكننا القول إنّ المادّة الأيونيّة مكوّنة من جُزَيئات بل من أيونات موجبة محاطة بأيونات سالبة (وبالعكس)، وبينها تجاذُب كهربائيّ. الرابط بين الأيونات يسمّى رابطًا أيونيًّا.
سنحاول أن نفهم ماذا يحدُث بين عنصرَين يكوّنان رابطًا أيونيًّا، وأيّ أنواع عناصر تشارك في تكوين الرابط الأيونيّ، وماذا يحدُث لكلّ عنصر في العمليّة.
إحدى إمكانيّات تكوُّن المادّة الأيونيّة هي التفاعُل بين الفلزّ واللافلزّ. معظم العناصر في قائمة العناصر الدوريّة (باستثناء عائلات الغازات النبيلة) تكوِّن بينها مركّبات. عندما يتكوّن المركَّب، يتغيّر ترتيب الإلكترونات في الذرّات التي تكوّنه بحيث يصبح مستوى الإلكترونات الأخير فيها ممتلئًا (بشكل عام).
بما أنّ طاقة تأيُّن الفلزّات منخفضة بشكل عام بالمقارنة مع اللافلزّات، وطاقة تأيُّن اللافلزّات أعلى من طاقة تأيُّن الفلزّات، يمكننا قول ما يلي:
لا حاجة لبذل طاقة كبيرة في ذرّة الفلزّ (مقارنةً باللافلزّ) لإخراج إلكترونات التكافؤ منها، أيّ الإلكترونات الموجودة في مستوى الطاقة الأخير المعبّأ بالإلكترونات.
اللافلزّات التي لها طاقة تأيُّن عالية وطاقة ميل إلكترونيّ عالية مقارنةً بالفلزّات، ستُطلِق طاقة أكبر عند استقبال إلكترونات في مستوى الطاقة الأخير وبالتالي تكمله إلى مستوى طاقة كامل.
لننظر إلى المثال التالي:
عنصر الصوديوم (Na) موجود في الجهة اليسرى من قائمة العناصر الدوريّة، جهة الفلزّات.
لذرّة الصوديوم ترتيب الإلكترونات التالي: Na )2e )8e )1e
في هذه الحالة، عدد البروتونات (التي شحنتها موجبة) في نواة ذرّة الصوديوم هو 11. عدد الإلكترونات التي شحنتها سالبة في مستوى الإلكترونات هو 11. لذلك، الشحنة الكهربائيّة لعنصر الصوديوم هي 0 (صفر)، أيّ أنّه متعادل من الناحية الكهربائيّة.
عندما تخسر ذرّة الصوديوم إلكترون التكافؤ الوحيد في مستوى الطاقة الأخير، يصبح ترتيب الإلكترونات فيها على النحو التالي: Na )2e )8e.
في هذه الحالة، عدد البروتونات في الصوديوم غير مساوٍ لعدد الإلكترونات. الآن، يوجد للصوديوم 11 بروتونًا (شحنتها موجبة) في النواة، و-10 إلكترونات (شحنتها سالبة) فقط. لديه شحنات سالبة أقلّ من الشحنات الموجبة، لذلك فهو مشحون بشحنة موجبة.
الصوديوم في هذه الحالة هو أيون شحنته +1.
Na+
بالمقابل، ذرّة الكلور مثلًا (Cℓ) الموجودة من جهة اليمين في قائمة العناصر الدوريّة، جهة اللافلزّات.
ترتيب الإلكترونات في ذرّة الكلور هو: Cℓ )2e )8e )7e
يوجد في نواة ذرّة الكلور 17 بروتونًا (شحنتها موجبة) وفي مستويات الطاقة 17 إلكترونًا (شحنتها سالبة). لذلك، شحنتها هي 0 (صفر)، أيّ أنّها متعادلة من الناحية الكهربائيّة.
الكلور، كبقيّة اللافلزّات، سيُطلِق طاقة عندما يكسب إلكترونًا. بعد أن يكسب إلكترونًا واحدًا، عندما يصبح مستوى الطاقة الأخير ممتلئًا، سيبدو ترتيب الإلكترونات على النحو التالي Cℓ )2e )8e )8e.
في هذه الحالة، سيكون للكلور 17 بروتونًا في النواة، لكن 18 إلكترونًا في مستويات الطاقة. بكلمات أخرى، لديه إلكترونات أكثر من البروتونات، أو شحنات سالبة أكثر من الشحنات الموجبة، لذلك فهو مشحون بشحنة سالبة.
الكلور في هذه الحالة هو أيون شحنته -1.
Cℓ–
من المتّبع أن نكتب شحنة الأيون على النحو التالي -1 وليس 1-.
الآن، بعد أن رأينا تكوُّن الأيون الموجب وشحنته، وتكوُّن الأيون السالب وشحنته، سنحاول أن نفهم على أيّ مادّة سنحصل عندما تنجذب الأيونات إلى بعضها البعض وتكوِّن شبكة أيونيّة.
يمكن أن نتعامل مع هذه الظاهرة على النحو التالي:
لدينا أيونان، Na+ و- Cℓ–. عندما يتكوّن المبنى الكامل بينهما، الشبكة الأيونيّة، تكون شحنتهما الكلّيّة مساوية لصفر. لذلك، يمكن القيام بشيء مشابه بما قمنا به في تكوين الجُزَيء في الرابط الكوفالنتيّ، أيّ قاسم مشترك بين الشحنات، بغضّ النظر عن إشارة الشحنة الكهربائيّة. هذه العمليّة تمكّننا من كتابة صيغة وِحدة، والتي تصف تركيبة الأيونات في المادّة الأيونيّة والنسبة بينها.
القاسم المشترك بين (+1) و- (-1) هو 1 (بغضّ النظر عن إشارة الشحنة، بل قيمتها العدديّة فقط). لذلك، على كلّ أيون Na+ في الشبكة الأيونيّة، سيكون هناك أيون واحد Cℓ–.
يمكن كتابة الوحدة التي نحصل عليها والتي تمثّل المادّة التي تتكوّن على النحو التالي: NaCℓ.
هذه الوحدة تسمّى الصيغة الأمبيريّة للمادّة. انتبهوا إلى أنّها ليست جُزَيئًا.
الصيغة الأمبيريّة للمادّة تصف تركيبة الأيونات والنسبة بينها، في شبكة المادّة الأيونيّة. لا نكتب الأيونات وشحنتها في الصيغة الأمبيريّة، لكن إذا كانت معطاة لنا صيغة مادّة أيونيّة (مجدّدًا، انتبهوا إلى أنّه غير معطى لنا جُزَيء مادّة أيونيّة، فلا توجد هنا جُزَيئات)، يمكننا أن نفهم من الصيغة ومن قائمة العناصر الدوريّة أيّ أيونات تكوّن المادّة وما هي النسبة بينها. سنرى الآن أمثلة على ذلك.
عندما نكتب الصيغة الأمبيريّة للمادّة، من المتّبع أن نكتب الأيون الموجب أوّلًا، ثمّ الأيون السالب من بعده.
نعود ونكرّر أنّه في الصيغة الأمبيريّة للمادّة الأيونيّة، مجموع كلّ الشحنات الموجبة والسالبة هو 0 (صفر).
تعالوا نحدّد الصيغة الأمبيريّة التي نحصل عليها لبعض التركيبات بين الفلزّات واللافلزّات. سنرى كيف يمكننا القيام بذلك بسهولة بمساعدة قائمة العناصر الدوريّة.
ماذا ستكون الصيغة الأمبيريّة للمادّة الأيونيّة التي تتكوّن بين البوتاسيوم (K) والأكسجين (O)؟
البوتاسيوم هو فلزّ من العمود الأوّل في قائمة العناصر الدوريّة، لذلك ترتيب الإلكترونات فيه ينتهي بإلكترون واحد في مستوى الطاقة الأخير. بما أنّ البوتاسيوم هو فلزّ، لا حاجة لبذل طاقة كبيرة لإخراج إلكترون منه. لذلك، سيعطي إلكترونًا واحدًا ويصبح أيونًا شحنته +1. عدد الإلكترونات أصغر بواحدة من عدد البروتونات. سنحصل على الأيون: K+.
الأكسجين هو لافلزّ من العمود السادس في القائمة، لذلك ترتيب الإلكترونات فيه ينتهي بـ 6 إلكترونات في مستوى الطاقة الأخير. بما أنّ الأكسجين هو لافلزّ، لديه ميل إلكترونيّ عالٍ. إذا حصل على إلكترونَين، سيصل إلى مستوى طاقة أخير كامل. لذلك، سيصبح أيونًا سالبًا شحنته -2. سيكون لدينا إلكترونان أكثر من البروتونات في النواة.
سنحصل على الأيون: O2-.
الآن، نجد القاسم المشترك بين الأيونات التي تكوّنت: K+ O2-.
القاسم المشترك بين 1 و-2 هو 2. لذلك، يجب أن نأخذ أيونَيّ بوتاسيوم لكلّ أيون أكسجين لكي تكون الشحن الكلّيّة مساوية لصفر.
| O2- | K+ | |
| القاسم المشترك | 2 | 2 |
| يجب أن نضرب بـ: | 1 | 2 |
الصيغة الأمبيريّة للمادّة ستكون K2O.
ماذا ستكون هي الصيغة الأمبيريّة للمادّة الأيونيّة التي تتكوّن بين المغنيسيوم (Mg) واليود (I)؟
يقع المغنيسيوم في العمود الثاني، أي لديه إلكترونين تكافؤ، ولذلك شحنته كأيون ستكون +2.
يقع اليود في العمود السابع ولذلك شحنته كأيون ستكون -1.
والآن نبني
| I – | Mg2+ | |
| القاسم المشترك | 2 | 2 |
| يجب أن نضرب بـ: | 2 | 1 |
وبالتالي الصيغة الأمبيريّة للمادّة ستكون MgI2.
أكمِلوا الجدول التالي:
| العناصر | الأيون الموجب | الأيون | القاسم المشترك | الصيغة الأمبيريّة |
| Aℓ, F | ||||
| Na , I | ||||
| Mg , N | ||||
| Ca , S | ||||
| Aℓ , O |
| العناصر | الأيون الموجب | الأيون السالب | القاسم المشترك | الصيغة الأمبيريّة |
| Aℓ, F | Aℓ3+ | F– | 3 | AℓF3 |
| Na , I | Na+ | I– | 1 | NaI |
| Mg , N | Mg2+ | N3- | 6 | Mg3N2 |
| Ca , S | Ca2+ | S2- | 2 | CaS |
| Aℓ , O | Aℓ3+ | O2- | 6 | Aℓ2O3 |
يمكننا القول أنّ إحدى علامات التعرّف على المواد الأيونيّة هي أنّ تركيبتها الكيميائيّة تحتوي على أيون موجب (عادةً فلزّ) وأيون سالب (عادةً لافلزّ أو مجموعة من اللافلزات). سنتطرّق للحالات الشاذّة فيما بعد.
نذكر أحد الحالات الشاذّة التي يجدر معرفتها وتذكّرها وهي أيون الأمونيوم +NH4 انتبهوا بأنّه أيون مشحون بشحنة كهربائيّة موجبة ويتكوّن فقط من ذرّات عناصر لافلزّية.
الآن دعونا نرى كيف نصف صيغة التمثيل الإلكترونيّ.
سنتذكّر ما تعلّمناه في درس الرابط التساهميّ.
سنعود ونكتب صيغة التمثيل الإلكترونيّ للأيونات أحاديّة الذرّة التي تتكوّن من ذرّة واحدة فقط. سنرى فيما بعد أنّ هناك أيونات تحتوي على أكثر من ذرّة واحدة. سنتعلّم كتابة صيغة التمثيل الإلكترونيّ للأيونات الأبسط بينها. وفقًا للمنهاج التعليميّ، يجب عليكم معرفة كتابة صيغة التمثيل الإلكترونيّ للأيونات أحاديّة الذرّة فقط.
صيغة التمثيل الإلكترونيّ لذرّة الكلور هي:

ولأيون الكلور، عند انضمام إلكترون إضافيّ:

في حالة كنا نتحدّث عن لافلزّ، بعد تحوّله لأيون، يتمّ ملء مستوى الطاقة الأخير بالإلكترونات حتى يصبح مكتملًا (8 إلكترونات).
صيغة التمثيل الإلكترونيّ لذرّة الألومنيوم هي:

ولأيون الألومنيوم، بعد فقدانه 3 إلكترونات:
[Aℓ]3+
أكمِلوا الجدول التالي:
| الذرّة | الأيون | صيغة التمثيل الإلكترونيّ للذرّة | صيغة التمثيل الإلكترونيّ للأيون |
| Ca | |||
| N | |||
| Rb | |||
| S |
| الذرّة | الأيون | صيغة التمثيل الإلكترونيّ للذرّة | صيغة التمثيل الإلكترونيّ للأيون |
| Ca | Ca2+ | 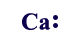 | [Ca]2+ |
| N | N3- |  |  |
| Rb | Rb+ |  | [Rb]+ |
| S | S2- | 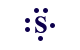 |  |
في كلّ مادّة أيونيّة تحتوي على أيون لفلزّ من العمود الأول، ستكون شحنة الأيون +1.
في كلّ مادّة أيونيّة تحتوي على أيون لفلزّ من العمود الثاني، ستكون شحنة الأيون +2.
في كلّ مادّة أيونيّة تحتوي على أيون لفلزّ من العمود الثالث، ستكون شحنة الأيون +3.
في كلّ مادّة أيونيّة ثنائيّة الذرّة مكوّنة من عنصرين فقط
سيكون لأيون لافلزّ من العمود السابع شحنة -1.
سيكون لأيون لافلزّ من العمود السادس شحنة -2.
سيكون لأيون لافلزّ من العمود الخامس شحنة -3.
تتكون المواد الأيونية من أيون موجب عادةً يكون مصدره من فلزّ ما. سنصادف أيضًا مواد أيونيّة تحتوي على فلزّات ليست من الأعمدة 1-3 في قائمة العناصر الدوريّة، بل فلزّات تنتمي إلى مجموعة الفلزّات الانتقاليّة. الآن سنرى كيف يمكننا باستخدام الصيغة الأمبيريّة للمادّة والقائمة الدوريّة، تحديد شحنة الأيون للفلزّات الانتقاليّة.
مثال على تمارين ممكنة
- معطى المركّب التالي: CuCℓ2.
ما هي شحنة أيون النحاس في المركّب CuCℓ2؟
لتحديد شحنة أيون النحاس سنتساعد بشحنة اللافلزّ (الكلور) ونتذكّر أنّه في كلّ صيغة أمبيريّة مجموع الشحنات الكلّيّة يساوي 0.
بما أنّ المادّة CuCℓ2 هي مادّة أيونيّة، فإنّ الكلور الموجود في العمود السابع من القائمة الدوريّة مشحون بشحنة -1. نظرًا لوجود أيونين من الكلور (2) في الصيغة الأمبيريّة، فإنّ عدد الشحنات السالبة هو 2، وبالتالي يجب أن يكون عدد الشحنات الموجبة مماثلًا أيّ 2. ذلك ليكون مجموع الشحنات مساويًا لصفر أو متعادلًا كهربائيًّا. لذلك، شحنة أيون النحاس في هذه الحالة هي +2.
سنرى ذلك على النحو التالي:
بالاستعانة بشحنة أيون واحد من الكلور (Cℓ–) وعدد من أيونات الكلور في الصيغة الأمبيريّة، نحسب الشحنة السالبة الكلّيّة.
| الأيون | Cℓ– |
| شحنة الأيون | 1- |
| عدد الأيونات في الصيغة الأمبيريّة | 2 |
| عدد الشحنات الكلّيّ | 2- |
الشحنة الموجبة الكلّيّة تساوي في قيمتها المطلقة الشحنة السالبة الكلّيّة، بحيث يكون مجموعهما صفرًا.
| الأيون | Cℓ– | |
| شحنة الأيون | 1- | |
| عدد الأيونات في الصيغة الأمبيريّة | 2 | |
| عدد الشحنات الكلّيّ | 2- | 2← |
إذا قسمنا الشحنة الكلّيّة على عدد ذرّات النحاس (Cu) في الصيغة الأمبيريّة نحصل على شحنة أيون النحاس.
| الأيون | Cℓ– | Cu2+ |
| شحنة الأيون | 1- | 2+ |
| عدد الأيونات في الصيغة الأمبيريّة | 2 | 1 ↑ |
| عدد الشحنات الكلّيّ | 2- | 2← |
الإجابة: شحنة أيون النحاس هي 2+
- جدوا في كلّ من الصيغ الأمبيريّة التالية، شحنة الأيون الموجب
الصيغة الأمبيريّة الأيون السالب الشحنة الكلّيّة للأيونات السالبة الشحنة الكلّيّة للأيونات الموجبة الأيون الموجب ZnO FeCℓ3 Cr2O3
لنفحص ما هي شحنة الأيون السالب:
| الصيغة الأمبيريّة | الأيون السالب | الشحنة الكلّيّة للأيونات السالبة | الشحنة الكلّيّة للأيونات الموجبة | الأيون الموجب |
| ZnO | O2- | |||
| FeCℓ3 | Cℓ– | |||
| Cr2O3 | O2- |
نحسب الشحنة السالبة الكلّيّة:
| الصيغة الأمبيريّة | الأيون السالب | الشحنة الكلّيّة للأيونات السالبة | الشحنة الكلّيّة للأيونات الموجبة | الأيون الموجب |
| ZnO | O2- | 2- | ||
| FeCℓ3 | Cℓ– | 3- | ||
| Cr2O3 | O2- | 6- |
نحدّد ما هي الشحنة الموجبة الكلّيّة:
| الصيغة الأمبيريّة | الأيون السالب | الشحنة الكلّيّة للأيونات السالبة | الشحنة الكلّيّة للأيونات الموجبة | الأيون الموجب |
| ZnO | O2- | 2- | 2+ | |
| FeCℓ3 | Cℓ– | 3- | 3+ | |
| Cr2O3 | O2- | 6- | 6+ |
نقسم الشحنة الموجبة الكلّية على عدد ذرّات الأيون الموجب في الصيغة الأمبيريّة:
| الصيغة الأمبيريّة | الأيون السالب | الشحنة الكلّيّة للأيونات السالبة | الشحنة الكلّيّة للأيونات الموجبة | الأيون الموجب |
| ZnO | O2- | 2- | 2+ | Zn2+ |
| FeCℓ3 | Cℓ– | 3- | 3+ | Fe3+ |
| Cr2O3 | O2- | 6- | 6+ | Cr3+ |
مصطلح آخر سنتعرّف عليه الآن وسنستخدمه فيما بعد هو الأيون المعقّد.
الأيون المعقّد هو الأيون الذي يتكوّن من أكثر من ذرّة واحدة.
عادةً تحتوي الأيونات المعقّدة على اللافلزّات وهي أيونات مشحونة بشحنة سالبة. ولكن، هناك أيضًا أيونات معقّدة تحتوي على فلزّات، وهناك أيضًا أيونات معقّدة تحتوي على لافلزّات مشحونة بشحنة موجبة. لا داعي لحفظ الأيونات المعقّدة غيبًا، إذ يمكن فهم شحنة الأيون من خلال الصيغة الأمبيريّة للمادّة.
فيما يلي بعض الأمثلة للأيونات المعقّدة:
SO42- , OH– , CH3COO– , NH2– , Cr2O72- , NH4+ , H3O+
كما في التمرين السابق، يمكننا حساب شحنة الأيون المعقّد.
في الأمثلة التالية ستظهر أيونات معقّدة شحنتها غير معروفة.
مثال على تمارين ممكنة
- ما هي شحنة الأيون السالب في المادّة الأيونيّة التي صيغتها الأمبيريّة هي Na2SO3؟
بما أنّ المادّة المعطاة تحتوي على أيون من العنصر Na، وهو فلزّ من العمود الأول في القائمة الدوريّة، فإنّ شحنته كأيون ستكون +1. ونظرًا لوجود أيونين من الصوديوم (Na+) فإنّ مجموع الشحنة الموجبة هو +2. لذلك، هناك أيضًا شحنتان سالبتان. الآن، ننتقل للأيون السالب. لاحظوا أنّ الأيون السالب في هذه الصيغة هو أيون معقّد، وبما أنّ هناك أيونًا سالبًا واحدًا فقط في الصيغة الأمبيريّة للمادّة (انتبهوا، الرقم 3 بجانب الأوكسجين يشير إلى عدد ذرّات الأوكسجين في الأيون المعقّد)، يمكننا حساب قيمته، وستكون -2. يمكننا عرض الحساب على النحو التالي: باستخدام شحنة أيون واحد من الصوديوم (Na+) وعدد من أيونات الصوديوم في الصيغة الأمبيريّة نحسب الشحنة الموجبة الكلّيّة:
| الأيون | Na+ |
| شحنة الأيون | 1+ |
| عدد الأيونات في الصيغة الأمبيريّة | 2 |
| عدد الشحنات الكلّيّ | 2+ |
والآن يمكننا معرفة الشحنة السالبة الكلّيّة. هي تساوي في قيمتها المطلقة الشحنة الموجبة الكلّيّة، بحيث يكون مجموعهما صفرًا:
| الأيون | Na+ | |
| شحنة الأيون | 1+ | |
| عدد الأيونات في الصيغة الأمبيريّة | 2 | |
| عدد الشحنات الكلّيّ | →2- | 2+ |
والآن، إذا قسمنا الشحنة الكلّيّة على عدد أيونات الـ-SO3 في الصيغة الأمبيريّة نحصل على شحنة أيون الـ SO3:
| الأيون | SO32- | Na+ |
| شحنة الأيون | 2- | 1+ |
| عدد الأيونات في الصيغة الأمبيريّة | 1 ↑ | 2 |
| عدد الشحنات الكلّيّ | →2- | 2+ |
- جدوا في كلّ من الصيغ الأمبيريّة للمواد الأيونيّة التالية، شحنة الأيون السالب.
الصيغة الأمبيريّة الأيون الموجب الشحنة الكلّيّة للأيونات الموجبة الشحنة الكلّيّة للأيونات السالبة الأيون السالب K2CO3 Mg(NO3)2 Aℓ(CℓO4)3
لنفحص ما هي شحنة الأيون الموجب:
| الصيغة الأمبيريّة | الأيون الموجب | الشحنة الكلّيّة للأيونات الموجبة | الشحنة الكلّيّة للأيونات السالبة | الأيون السالب |
| K2CO3 | K+ | |||
| Mg(NO3)2 | Mg2+ | |||
| Aℓ(CℓO4)3 | Aℓ3+ |
نحسب الشحنة الموجبة الكلّيّة:
| الصيغة الأمبيريّة | الأيون الموجب | الشحنة الكلّيّة للأيونات الموجبة | الشحنة الكلّيّة للأيونات السالبة | الأيون السالب |
| K2CO3 | K+ | +2 | ||
| Mg(NO3)2 | Mg2+ | +2 | ||
| Aℓ(CℓO4)3 | Aℓ3+ | +3 |
نحدّد ما هي الشحنة السالبة الكلّيّة. القيمة المطلقة للشحنة السالبة الكلّيّة تساوي الشحنة الموجبة الكلّيّة:
| الصيغة الأمبيريّة | الأيون الموجب | الشحنة الكلّيّة للأيونات الموجبة | الشحنة الكلّيّة للأيونات السالبة | الأيون السالب |
| K2CO3 | K+ | +2 | -2 | |
| Mg(NO3)2 | Mg2+ | +2 | -2 | |
| Aℓ(CℓO4)3 | Aℓ3+ | +3 | -3 |
نقسم على عدد الأيونات المعقّدة في الصيغة الأمبيريّة:
| الصيغة الأمبيريّة | الأيون الموجب | الشحنة الكلّيّة للأيونات الموجبة | الشحنة الكلّيّة للأيونات السالبة | الأيون السالب |
| K2CO3 | K+ | +2 | -2 | CO32- |
| Mg(NO3)2 | Mg2+ | +2 | -2 | NO3– |
| Aℓ(CℓO4)3 | Aℓ3+ | +3 | -3 | CℓO4– |
