صفات الموادّ الجُزَيئيّة - تمرين
- معطاة الموادّ التالية: رباعيّ يوديد الكربون CI4(s)، أكسجين O2(g)، ثاني أكسيد الكربون CO2(g)، بيروكسيد الهيدروجين – H2O2(ℓ).
- اكتبوا لكلّ واحدة من الموادّ صيغة التمثيل الإلكترونيّ.
| CI4(s) | H2O2(ℓ) | CO2(g) | O2(g) |
 |
- معلوم أنّه لجُزَيئات O2(g) مبنى خطّيّ، لجُزَيئات CO2(g) مبنى خطّيّ ولجزيئات CI4(s) مبنى تتراهيدر (هرم رباعيّ).
حدِّدوا لكلّ واحدة من الموادّ ما إذا كانت قطبيّة أو غير قطبيّة.
الموادّ الثلاث غير قطبيّة. يوجد لجُزَيئاتها مبنى متماثللا ينتُج عدم تماثُل في سحابة الإلكترونات. لذلك فهي غير قُطبيّة.
- اشرحوا لماذا درجة غليان CO2(g) أعلى من درجة غليان O2(g).
المادّة CO2 وأيضًا O2 هما مادّتان جُزَيئيّتان، جُزَيئاتهما غير قطبيّة. هناك تأثيرات متبادلة ڤان در ڤالس بين جُزَيئاتهما. بما أنّ سحابة الإلكترونات في جُزَيء CO2 أكبر من سحابة الإلكترونات في جُزَيء O2، هناك احتمال أكبر لتكوين ثنائيّات تقاطُب لحظيّة في جُزَيء CO2 والشحنات الجزئيّة التي تتكوّن فيها أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CO2 أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات O2. نحتاج إلى طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CO2. لهذا السبب، درجة غليان CO2 أعلى من درجة غليان O2.
- اشرحوا لماذا درجة غليان CI4(s) أعلى من درجة غليان CO2(g).
CI4 وأيضًا CO2 هما مادّتان جُزَيئيّتان. جُزَيئاتهما غير قطبيّة، وبينها توجد تأثيرات متبادلة ڤان در ڤالس. بما أنّ سحابة الإلكترونات في جُزَيء CI4 أكبر من سحابة الإلكترونات في جُزَيء CO2، هناك احتمال أكبر لتكوين ثنائيّ تقاطُبات لحظيّة في جُزَيءCI4 والشحنات الجزئيّة التي تتكوّن فيها أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CI4 أقوى من التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CO2. نحتاج إلى طاقة أكبر لتفكيك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات CI4. لذلك، درجة غليان CI4 أعلى من درجة غليان CO2.
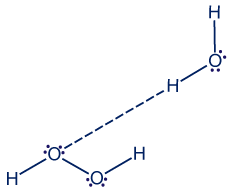
- اشرحوا لماذا تذوب المادّةH2O2(ℓ) في الماء. صيغوا عمليّة الإذابة واشرحوا سبب عدم توصيل المحلول للتيّار الكهربائيّ.
H2O2 والماء (H2O) هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد روابط هيدروجينيّة. لذلك تتكوّن روابط هيدروجينيّة بين جُزَيئات H2O2 وجُزَيئات الماء. لذلك، تذوب المادّة H2O2 في الماء.
صيغة عمليّة الإذابة:
المحلول غير موصل للتيّار الكهربائيّ بسبب عدم وجود أيونات حرّة الحركة أو شحنات كهربائيّة مُتنقِّلة في المحلول.
يمكن أن نفهم من صيغة العمليّة أنّ المحلول يحتوي على جُزَيئات H2O2 محاطة بجُزَيئات ماء، ولا توجد شحنات كهربائيّة مُتنقِّلة.
- اشرحوا لماذا تذوب المادّة CI4(s) في المادّة CS2(ℓ). صيغوا عمليّة الإذابة واشرحوا سبب عدم توصيل المحلول للتيّار الكهربائيّ.
CI4 و-CS2 هما مادّتان جُزَيئيّتان، جُزَيئاتهما غير قطبيّة. بين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس، لذلك تتكوّن تأثيرات متبادلة ڤان در ڤالس بين جُزَيئات CI4 وجُزيئات CS2. المادّة CI4 تذوب في المادّة CS2.
نصيغ عمليّة الإذابة
المحلول غير موصل للتيّار الكهربائيّ بسبب عدم وجود أيونات حرّة الحركة أو شحنات كهربائيّة مُتنقِّلة في المحلول.
- اشرحوا لماذا المادّة CI4(s) صلبة بدرجة حرارة الغرفة، بينما المادّة CO2(g) غازيّة بدرجة حرارة الغرفة.
CI4 هي مادّة جُزَيئيّة، وجُزَيئاتها غير قُطبيّة. هناك تأثيرات متبادلة ڤان در ڤالس بين جُزَيئاتها. بما أنّ سحابة الإلكترونات في جُزَيئات CI4 كبيرة، هناك احتمال أكبر لتكوين ثنائيّ تقاطُبات لحظيّة على الجُزَيئات، والشحنات الجزئيّة أكبر. لذلك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها تكون قويّة، وبدرجة حرارة الغرفة لا توجد طاقة كافية لتفكيك الروابط بين جُزَيئاتها. لذلك، تكون المادّة في الحالة الصلبة.
CO2 هي مادّة جُزَيئيّة ويمكن أن تتكوّن بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس. بما أنّ سحابة الإلكترونات في جُزَيئات CO2 صغيرة، هناك احتمال أصغر لتكوين ثنائيّات تقاطُب لحظيّة على الجُزَيئات، والشحنات الجزئيّة أصغر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها ضعيفة. هناك ما يكفي من الطاقة بدرجة حرارة الغرفة لتفكيك كلّ التأثيرات المتبادلة بين الجُزَيئات. لذلك، تكون المادّة في الحالة الغازيّة.
- أمامكم الصيَغ الجُزَيئيّة للموادّ التالية: C3H7OH, C4H10, H2O2, CH4. تظهر في الجدول التالي بعض صفات الموادّ A-D.
المادّة درجة الانصهار (C°) درجة الغليان (C°) الذائبيّة في الماء الذائبيّة في الهكسان
C6H14(ℓ)A 182- 161- – + B 138- 0 – + C 126- 97 + + D 0 150 + –
- لائِموا كلّ واحدة من الموادّ المعطاة للأحرف A-D.
A = CH4, B = C4H10, C = C3H7OH, D = H2O2
فيما يلي شرح الملاءَمة. بشكل عام، في الأسئلة التي فيها جدول، من المفضّل التركيز على الصفات التي تساعدنا في التمييز بسهولة بين الموادّ. بما أنّ السؤال عن موادّ جُزَيئيّة فقط وليس عن موادّ من عائلات أخرى، لا يمكننا الاستعانة بصفة التوصيل الكهربائيّ، بالأخصّ أنّ هذه الصفة لا تظهر في السؤال أساسًا.
سنحاول التمييز بين الموادّ من خلال صفات الذائبيّة. نلاحظ أنّ هناك مادّتين تذوبان في الماء، لذلك يجب أن نفحص أيّ مادّة من بين الموادّ الأربع المعطاة يمكن أن تكوّن روابط هيدروجينيّة. المادّتان C3H7OH و- H2O2 يمكنهما تكوين روابط هيدروجينيّة، لذلك فهما ملائمتان للمادّتين C و-D. نحدّد الفرق بينهما من خلال الفرق في درجة غليانهما. لجُزَيئات المادّة H2O2 يوجد عدد أكبر من المراكز لتكوين الروابط الهيدروجينيّة. لكي نفكّك هذه الروابط، نحتاج إلى طاقة أكبر، لذلك درجة انصهار ودرجة غليان H2O2 ستكونان أعلى. لذلك، المادّة C هي C3H7OH والمادّة D هي H2O2. نقارن بين درجات انصهار المادّتين الأخريين اللتين لا تذوبان في الماء لعدم قدرتهما على تكوين روابط هيدروجينيّة، لكن هذه المرّة بحسب العوامل التي تؤثّر على التأثيرات المتبادلة ڤان در ڤالس. المادّتان CH4 و- C4H10 هما مادّتان جُزَيئيّتان، وبين جُزَيئاتهما توجد تأثيرات متبادلة ڤان در ڤالس. لجُزَيئات المادّة C4H10 سحابة الإلكترونات أكبر، لذلك التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها أقوى. نحتاج إلى طاقة أكبر لتفكيك هذه التأثيرات المتبادلة. بالتالي، درجة غليانها أعلى. من هنا، المادّة A هي CH4 والمادّة B هي C4H10
- ماذا ستكون حالة المادّة لكلّ واحدة من الموادّ المعطاة بدرجة حرارة الغرفة؟
المادّتان A و- B غازيّتان لأنّ درجة حرارة الغرفة أعلى من درجة غليانهما.
المادّتان C و- D سائلتان لأنّ درجة حرارة الغرفة أعلى من درجة انصهارهما، لكنّها أقلّ من درجة غليانهما.
- المادّة C تذوب جيّدًا في الماء وأيضًا في الهكسان. اشرحوا لماذا؟
صيغوا عمليّة إذابة المادّة C في الماء وأيضًا في الهكسان.
حدِّدوا لكلّ واحد من المحلولَين ما إذا كان موصلًا للكهرباء. علّلوا إجابتكم.
المادّة C هي C3H7OH. لجُزَيئات هذه المادّة منطقة هيدروفيليّة (OH) تسمح بتكوين روابط هيدروجينيّة بين الجُزَيئات، ومنطقة هيدروفوبيّة (C3H7) تسمح بتكوين تأثيرات متبادلة ڤان در ڤالس بين الجُزَيئات. الماء هو مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة، لذلك، بين جُزَيئات المادّة C وبين جُزَيئات الماء تتكوّن روابط هيدروجينيّة.
فيما يلي صيغة عمليّة الإذابة في الماء:
الهكسان هو مادّة جُزَيئيّة توجد بين جُزَيئاتها تأثيرات متبادلة ڤان در ڤالس، لذلك بين جُزَيئات المادّة C وبين جُزَيئات الهكسان تتكوّن تأثيرات متبادلة ڤان در ڤالس، لذلك المادّة C تذوب في الهكسان.
فيما يلي صيغة عمليّة الإذابة في الهكسان:
المحلولان غير موصلين للتيّار الكهربائيّ بسبب عدم وجود شحنات كهربائيّة مُتنقِّلة فيهما.
- ارسموا رابطًا واحدًا بين جُزَيء الماء وجُزَيء المادّة الممثَّلة بالحرف D.
- اشرحوا لماذا درجة الغليان المادّة C أعلى من درجة غليان المادّة B.
للمادّة (C3H7OH) C درجة غليان أعلى من درجة غليان المادّة (C4H10) B، لأنّ المادّة C هي مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس، بينما بين جُزَيئات المادّة B توجد تأثيرات متبادلة ڤان در ڤالس فقط. الروابط الهيدروجينيّة بين جُزَيئات المادّة C، بالإضافة إلى التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئات المادّة C، أقوى من التأثيرات المتبادلة ڤان در ڤالس الموجودة بين جُزَيئات المادّة B. نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئات المادّة C، لذلك درجة غليانها أعلى.
- اشرحوا لماذا درجة غليان المادّة D أعلى من درجة غليان المادّة C.
للمادّة (H2O2) D درجة غليان أعلى من درجة غليان المادّة(C3H7OH) C، لأنّ المادّة D هي مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة. المادّة C هي مادّة جُزَيئيّة توجد بين جُزَيئاتها روابط هيدروجينيّة وتأثيرات متبادلة ڤان در ڤالس. للمادّة D يوجد عدد أكبر من المراكز أو الإمكانيّان لتكوين روابط هيدروجينيّة بين جُزَيئاتها، لذلك القوى بين جُزَيئاتها أقوى من تلك الموجودة بين جُزَيئات المادّة C.
لهذا السبب، نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئاتها، ودرجة غليانها أعلى.
- معطى المادّتان الكحوليّتان التاليتان: C2H5OH و-C3H7OH.
حدِّدوا لأيّ مادّة درجة غليان أعلى. اشرحوا السبب.
المادّتان الكحوليّتان C2H5OH و- C3H7OH هما مادّتان جُزَيئيّتان وتوجد بين جُزَيئاتهما روابط هيدروجينيّة (التي تتكوّن بين الأجزاء الهيدروفيليّة OH) وتأثيرات متبادلة ڤان در ڤالس (التي تتكوّن بيم الأجزاء الهيدروفوبيّة، الهيدروكربونات في الجُزَيئات متقاربة). لكلتيهما نفس عدد المراكز لتكوين الروابط الهيدروجينيّة. الفرق في درجة غليانهما ناجم عن قوّة التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتهما. بما أنّ لجُزَيئات المادّة C3H7OH جزء هيدروفوبيّ (سلسلة هيدروكربونيّة) أكبر (C3H7 مقابل C2H5)، فإنّ سحابة إلكتروناتها أكبر وهناك احتمال أكبر لتكوين ثنائيّات تقاطُب لحظيّة على الجُزَيئات، والشحنات الجزئيّة التي تتكوّن أكبر. لذلك، التأثيرات المتبادلة ڤان در ڤالس بين جُزَيئاتها أقوى. نحتاج إلى طاقة أكبر لتفكيك الروابط بين جُزَيئاتها، لذلك درجة غليانها أعلى.
- معطاة الموادّ التالية بأشكال تمثيل مختلفة:
مادّة 1 مادّة 2 مادّة 3 
CH3)2CHCH2CH2CH3) C4H10 مادّة 4 مادّة 5 مادّة 6 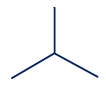
C5H12 CH3(CH2)4CH3 حدِّدوا أيّ الموادّ المعطاة هي إيزوميرات. اشرحوا السبب.
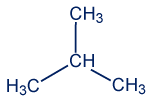
لكي نحدّد أيّ مادّة من بين الموادّ المعطاة هي إيزوميرات، يجب أن نفحص التركيبة الكيميائيّة الدقيقة لكلّ مادّة، وأن نكتب الصيغة الجُزَيئيّة لكلّ مادّة. للمادّتين 1 و-4 يوجد تمثيل مختصر للصيغة البنائيّة، لذلك، علينا أوّلًا أن نكتب تمثيلًا يمكننا بواسطته أن نحدّد بشكل دقيق الصيغة الجُزَيئيّة لكلّ واحدة من الموادّ.
المادّة 1 هي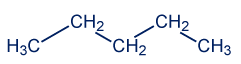
لذلك صيغتها الجُزَيئيّة هي C5H12.
الصيغة الجُزَيئيّة للمادّة 2 هي C6H14.
الصيغة الجُزَيئيّة للمادّة 3 هي C4H10.
وللمادّة 4 هي:
الصيغة الجُزَيئيّة للمادّة 4 هي C4H10.
الصيغة الجُزَيئيّة للمادّة 5 هي C5H12.
الصيغة الجُزَيئيّة للمادّة 6 هي C6H14.
المادّتان 1 و- 5 هما إيزوميرات؛ المادّتان 3 و-4 هما إيزوميرات؛ المادّتان 2 و-6 هما إيزوميرات. السبب في أنّ هذه الموادّ هي إيزوميرات، هو أنّ لكلّ واحد من الأزواج توجد نفس الصيغة الجُزَيئيّة، نفس التركيبة الكيميائيّة، لكن صيغة بنائيّة مختلفة.