أمثلة على الروابط التساهميّة (الكوفالنتيّة)، صيغة التمثيل الإلكترونيّ والصيغة الجُزَيئيّة
في الدرس السابق، شرحنا ماذا يعني الرابط التساهميّ (الكوفالنتيّ) وما هي الصيغة الجُزَيئيّة ومبنى لويس (صيغة التمثيل الإلكترونيّ). سنرى الآن أمثلة إضافيّة عن الروابط التي تتكوّن بين ذرّات عنصرَيْن من اللافلزّات.
نقوم بذلك على مراحل:
أوّلًا، نكتب صيغة التمثيل الإلكترونيّ لكلّ واحدة من الذرّتَيْن. لكي نُحدّد عدد إلكترونات التكافؤ الذي نُسجّله لكلّ واحدة من الذرّتَيْن، نمعن النظر في القائمة الدوريّة للعناصر. الكربون يقع في العمود الرابع، لذلك لديه 4 إلكترونات تكافؤ. الهيدروجين يقع في العمود الأوّل، لذلك لديه إلكترون تكافؤ واحد:
![]()
يمكن القول إنّ الكربون الذي لديه 4 إلكترونات في المستوى الأخير، سيُشارك أربعة إلكترونات لأنّه ينقصه 4 إلكترونات، وأيضًا لأنّ لديه 4 إلكترونات غير مُزدوَجة.
بينما الهيدروجين، الذي لديه إلكترون واحد، سيشارك إلكترونًا واحدًا فقط. الهيدروجين ينقصه إلكترون واحد في مستوى الطاقة الأخير. نذكّر هنا أنّ للهيدروجين مستوى طاقة واحد، ويمكن أن يمتلئ بإلكترونَيْن فقط.
من هنا، هناك عدّة طرق للوصول إلى الصيغة الجُزَيئيّة للمادّة التي نحصل عليها من ذرّات العنصرَيْن: الهيدروجين والكربون.
الطريقة التي سنعرضها الآن توضّح كيفيّة إيجاد الصيغة الجُزَيئيّة للمادّة بشكل سهل جدًا. عمليّة إيجاد الصيغة الجُزَيئيّة للمادّة تعتمد على إيجاد قاسم مشترك لعدد الإلكترونات التي تشاركها كلّ واحدة من الذرّتَيْن. لذلك، ننفّذ تمرينًا رياضيًّا سهلًا لإيجاد القاسم المشترك:
![]()
القاسم المشترك لـ 1 وَ-4 هو 4. لذلك، في جُزَيء المادّة الجديدة ستشارك 4 ذرّات هيدروجين على كلّ ذرّة كربون. يجب ضرب الـ 1 الخاصّ بالهيدروجين بـ 4 للحصول على 4: 1×4=4. يجب ضرب الـ 4 الخاصّة بالكربون بـ 1 للحصول على 4: 4×1=4.
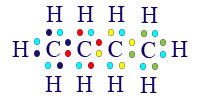
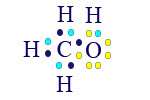
أبسط جُزَيء يحتوي على كربون وهيدروجين هو الميثان. الصيغة الجُزَيئيّة التي تصف التركيبة الدقيقة للمادّة هي CH4.
الآن، نصف صيغة التمثيل الإلكترونيّ للجُزَيء الذي حصلنا عليه.
عند كتابة صيغة التمثيل الإلكترونيّ، نبدأ دائمًا بالذرّة التي تشارك عدد الإلكترونات الأكبر. في هذه الحالة، الكربون.
![]()
الآن، نضيف للتمثيل الإلكترونيّ 4 ذرّات هيدروجين. كلّ ذرّة هيدروجين تشارك إلكترونًا واحدًا.
بما أنّ الكربون تنقصه 4 إلكترونات لإكمال المستوى الأخير، فإنّ كلّ إلكترون غير مُزدوَج في ذرّة الكربون سيكوِّن رابطًا مع إلكترون في ذرّة الهيدروجين.
نحصل على:
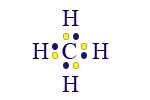
الآن، كلّ واحدة من الذرّات في جُزَيء CH4 قد وصلت إلى مستوى إلكترونات أخير مليء.
يمكن القول إنّه بهذه الطريقة، بدأنا بإيجاد الصيغة الجُزَيئيّة، وبواسطتها قمنا ببناء صيغة التمثيل الإلكترونيّ.
هناك طريقة أخرى، وهي البدء مباشرةً بالتمثيل الإلكترونيّ، كما وضّحنا في نهاية المثال، ومن ثمّ الربط بين الذرّات حتى الوصول إلى مستوى الإلكترونات الأخير المليء. أنا أفضّل الطريقة الأولى.
في المرحلة الأولى، نُحدّد عدد الإلكترونات التي ستشاركها كلّ ذرّة. نقوم بذلك بحسب عدد الإلكترونات التي تنقص الذرّة في المستوى الأخير لإكماله إلى مستوى إلكترونات مليء. في هذه المرحلة، ليس إلزاميًّا أن نرسم صيغة التمثيل الإلكترونيّ. يمكن تحديد عدد الإلكترونات التي تنقص الذرّة في المستوى الأخير، من خلال موقع العنصر في قائمة العناصر الدوريّة.
ذرّة الكلور تقع في العمود السابع في القائمة الدوريّة، لذلك لديها 7 إلكترونات تكافؤ. ينقصها إلكترون واحد لإكمال المستوى الأخير إلى مستوى مليء. بالتالي، ذرّة الكلور ستشارك إلكترونًا واحدًا.
ذرّة النيتروجين تقع في العمود الخامس في قائمة العناصر الدوريّة، لذلك لديها 5 إلكترونات تكافؤ. تنقصها 3 إلكترونات لإكمال المستوى الأخير لمستوى مليء، لذلك ستشارك 3 إلكترونات.
الآن، نجد القاسم المشترك لهما من حيث مشاركة الإلكترونات:
![]()
القاسم المشترك هو 3. يجب ضرب الكلور بـ 3 والنيتروجين بـ 1، لذلك يجب أن نأخذ 3 ذرّات كلور لكلّ ذرّة نيتروجين.
في لغة الكيميائيّين، نكتب النتيجة على النحو التالي NCℓ3 وهذه عمليًّا الصيغة الجُزَيئيّة للمادّة.
الآن، نكتب لهذه الصيغة الجُزَيئيّة صيغة التمثيل الإلكترونيّ.
نبدأ بذرّة النيتروجين، وهي الذرّة المركزيّة، أيّ الذرّة التي تشارك إلكترونات أكثر في جُزَيء NCℓ3. ننتبه إلى أنّ ذرّة النيتروجين يجب أن تشارك ثلاثة إلكترونات، بينما ذرّة الكلور يجب أن تشارك إلكترونًا واحدًا فقط. لذلك، كلّ واحدة من ذرّات الكلور الثلاث ستشارك إلكترونًا واحدًا فقط مع الإلكترونات غير المُزدوَجة (المنفردة) في ذرّة النيتروجين.
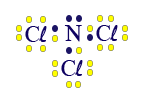
انتبهوا الآن إلى أنّ كلّ واحدة من الذرّتَيْن لديها مستوى طاقة أخير مليء.
طبعًا، لا حاجة للإشارة إلى الإلكترونات بألوان مختلفة. الهدف هو توضيح مصدر كلّ واحد من الإلكترونات في الرابط.
ذرّة الأكسجين تشارك إلكترونَيْن لأنّها تقع في العمود السادس في قائمة العناصر الدوريّة، أيّ أنّه ينقصها إلكترونان لإكمال مستوى الطاقة الأخير. ذرّة الكلور تشارك إلكترونًا واحدًا لأنّها تقع في العمود السابع في قائمة العناصر الدوريّة، أيّ أنّه ينقصها إلكترون واحد لإكمال مستوى الطاقة الأخير.
![]()
القاسم المشترك لـ 1 وَ-2 هو 2. يجب ضرب الكلور بـ 2 والأكسجين بـ 1. لذلك، يجب أن نأخذ ذرّتَيّ كلور لكلّ ذرّة أكسجين واحدة.
بلغة الكيميائيّين، نكتب النتيجة على النحو التالي OCℓ2. هذه هي الصيغة الجُزَيئيّة للمادّة.
نبدأ صيغة التمثيل الإلكترونيّ من ذرّة الأكسجين، وهي الذرّة المركزيّة، أيّ الذرّة التي تشارك إلكترونات أكثر في جُزَيء OCℓ2. ننتبه إلى أنّ ذرّة الأكسجين يجب أن تشارك إلكترونَيْن، بينما ذرّة الكلور يجب أن تشارك إلكترونًا واحدًا فقط. لذلك، كلّ واحدة من ذرّتَيّ الكلور ستشارك إلكترونًا واحدًا فقط مع الإلكترونات غير المُزدوَجة (المنفردة) في ذرّة الأكسجين.
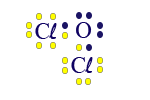
انتبهوا الآن إلى أنّ كلّ واحدة من الذرّتَيْن لديها مستوى طاقة أخير مليء.
نشير هنا إلى أنّ ذرّة الأكسجين وذرّة الكلور، لديهما تركيبات كيميائيّة أخرى، مثل Cℓ2O3 ، Cℓ2O5 وهناك تركيبات أخرى أيضًا. كذلك الأمر أيضًا للنيتروجين والكلور من المثال 2، وللكربون والهيدروجين من مثال 1.
في الطريقة التي عرضناها لإيجاد الصيغة الجُزَيئيّة للمادّة، التي تتكوّن من هذَيْن العنصرَيْن، نصل إلى التركيبة الأبسط، أيّ الصيغة الجُزَيئيّة الأبسط التي يمكن تكوينها بواسطة العنصرَيْن المعطيَيْن.
الذرّتان، البروم واليود، تقعان في العمود السابع في قائمة العناصر الدوريّة. لذلك، كلّ واحدة منهما تشارك إلكترونًا واحدًا، والقاسم المشترك هو 1. الناتج الذي نحصل عليه هو BrI.
انتبهوا إلى أنّه في هذا الجُزَيء، لا توجد ذرّة مركزيّة، لأنّ الذرّتَيْن تشاركان إلكترونًا واحدًا. صيغة التمثيل الإلكترونيّ ستكون:
![]()
والآن، أصبح لكلّ واحدة من الذرّتَيْن مستوى طاقة أخير مليء.
ذرّة الأكسجين وذرّة الكبريت أيضًا، تقعان في العمود السادس في قائمة العناصر الدوريّة. لذلك، لديهما 6 إلكترونات في مستوى الطاقة الأخير. ينقص كلّ واحدة منهما إلكترونان لإكمال مستوى الطاقة الأخير. من هنا، نستنتج أنّ الأكسجين والكبريت أيضًا يشاركان إلكترونَيْن. القاسم المشترك هو 2، لذلك يجب أن نأخذ (نضرب بـ) واحدًا من كلّ واحدة منهما.
المركَّب الذي يتكوّن بينهما هو SO.
التمثيل الإلكترونيّ هو:
![]()
انتبهوا الآن إلى أنّ مستوى الطاقة الأخير في كلّ واحدة من الذرّتَيْن مليء.
في هذا الجُزَيء أيضًا، لا توجد ذرّة مركزيّة، لأنّ الذرّتَيْن تشاركان إلكترونَيْن. انتبهوا إلى أنّه في هذا الجُزَيء، بين ذرّة الأكسجين وذرّة الكبرين، يتكوّن رابط زوجيّ.
الكربون يشارك 4 إلكترونات، بينما الأكسجين يشارك إلكترونَيْن، لذلك القاسم المشترك هو 4. يجب أن نأخذ ذرّة كربون واحدة لكلّ ذرّتَيّ أكسجين. الصيغة الجُزَيئيّة للمادّة هي CO2.
. نبدأ صيغة التمثيل الإلكترونيّ من ذرّة الكربون، وهي الذرّة المركزيّة، أيّ الذرّة التي تشارك إلكترونات أكثر في جُزَيء CO2. ننتبه إلى أنّ ذرّة الكربون يجب أن تشارك 4 إلكترونات، بينما ذرّة الأكسجين تشارك إلكترونَيْن فقط. لذلك، كلّ واحدة من ذرّتَيّ الأكسجين ستشارك إلكترونَيْن، مع الإلكترونات غير المُزدوَجة (المنفردة) في ذرّة الكربون.
صيغة التمثيل الإلكترونيّ لهذا الجُزَيء هي:
![]() انتبهوا الآن إلى أنّ كلّ واحدة من الذرّتَيْن لديها مستوى طاقة أخير مليء.
انتبهوا الآن إلى أنّ كلّ واحدة من الذرّتَيْن لديها مستوى طاقة أخير مليء.
ننتقل الآن إلى نوع آخر من التمارين في موضوع التمثيل الإلكترونيّ للجُزَيئات. الآن، ستكون الصيغة الجُزَيئيّة للمادّة معطاة، ولن نحتاج لتحديد الجُزَيء الذي نحصل عليه. سنرى أيضًا أمثلة على جُزَيئات لديها أكثر من نوعَيّ ذرّات في الجُزَيء، وأكثر من ذرّة مركزيّة واحدة.
هناك عدّة طرق لكتابة صيغة التمثيل الإلكترونيّ (صيغة لويس) للجُزَيئات الأكثر تعقيدًا، مثل هذا الجُزَيء وغيره. كما في التمارين السابقة، نبدأ من الذرّة التي تشارك إلكترونات أكثر. للقيام بذلك، نتوجّه لقائمة العناصر الدوريّة، ونجد العمود الذي تقع فيه كلّ واحدة من الذرّات.
في هذا المثال، سنعمل مرحلةً تلو الأخرى للتأكّد من أنّنا نكتب الناتج النهائيّ الصحيح.
ذرّة الكربون (C) تقع في العمود الرابع. تنقصها 4 إلكترونات، لذلك فهي ستشارك 4 إلكترونات.
ذرّة النيتروجين (N) تقع في العمود الخامس. لديها 5 إلكترونات في المستوى الأخير، وتنقصها 3 إلكترونات. هذا يعني أنّها ستشارك 3 إلكترونات.
ذرّة الهيدروجين التي تقع في العمود الأوّل تحتوي على إلكترون واحد، وينقصها إلكترون واحد فقط. نذكّر مرّة أخرى أنّ الهيدروجين لديه مستوى طاقة واحد يمكن أن يتّسع إلكترونَيْن فقط. بما أنّ لديه إلكترونًا واحدًا، ينقصه إلكترون واحد، لذلك سيشارك إلكترونًا واحدًا.
نبدأ بالكربون، وهو الذرّة المركزيّة، أيّ الذرّة التي تشارك عدد الإلكترونات الأكبر.
![]()
الآن، نضيف ذرّة النيتروجين:
![]() نتيجة مشاركة زوج إلكترونات واحد، توجد حول النيتروجين 6 إلكترونات وحول الكربون 5 إلكترونات. نقوم بمشاركة إضافيّة:
نتيجة مشاركة زوج إلكترونات واحد، توجد حول النيتروجين 6 إلكترونات وحول الكربون 5 إلكترونات. نقوم بمشاركة إضافيّة:
![]() الآن، حول الكربون توجد 6 إلكترونات وحول النيتروجين 7 إلكترونات. لذلك، نقوم بمشاركة إضافيّة:
الآن، حول الكربون توجد 6 إلكترونات وحول النيتروجين 7 إلكترونات. لذلك، نقوم بمشاركة إضافيّة:
![]()
الآن، حول النيتروجين توجد 8 إلكترونات، أيّ أنّ مستوى الطاقة الأخير مليء. حول الكربون توجد 7 إلكترونات فقط في المستوى الأخير، لذلك ينقصه إلكترون واحد إضافيّ.
الآن، تحدُث مشاركة بين الإلكترون غير المُزدوَج الأخير لذرّة الكربون وبين الإلكترون غير المُزدوَج لذرّة الهيدروجين:
![]()
مستوى الطاقة الأخير للكربون أصبح مليئًا الآن وفيه 8 إلكترونات، ومستوى الطاقة الأخير للهيدروجين مليء وفيه إلكترونان. مستوى الإلكترونات الأخير لديه مليء. في نهاية الأمر، صيغة التمثيل الإلكترونيّ تُكتَب كما تظهر في التمثيل الأخير. انتبهوا إلى أنّ النيتروجين كوَّنَ بطًا ثلاثيًّا مع الكربون، والهيدروجين كوَّنَ رابطًا فرديًّا مع الكربون.
يمكن وصف العمليّة على النحو التالي:
بما أنّ ذرّة الكربون تشارك 4 إلكترونات، نربط بها ذرّة النيتروجين التي تشارك 3 إلكترونات وذرّة الهيدروجين التي تشارك إلكترونًا واحدًا فقط. نرتّب الإلكترونات حول ذرّة الكربون على النحو التالي:
![]() نضيف للكربون النيتروجين والهيدروجين. نضيف النيتروجين بجانب الكربون من جهة اليمين. في هذه الحالة، يشارك النيتروجين 3 إلكترونات مع الكربون:
نضيف للكربون النيتروجين والهيدروجين. نضيف النيتروجين بجانب الكربون من جهة اليمين. في هذه الحالة، يشارك النيتروجين 3 إلكترونات مع الكربون:
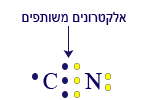 بعد الارتباط، توجد للنيتروجين 8 إلكترونات في المستوى الأخير، بينما للكربون 7 إلكترونات فقط. نذكّركم أنّه يجب عَدّ الإلكترونات المشتركة للكربون وللنيتروجين أيضًا.
بعد الارتباط، توجد للنيتروجين 8 إلكترونات في المستوى الأخير، بينما للكربون 7 إلكترونات فقط. نذكّركم أنّه يجب عَدّ الإلكترونات المشتركة للكربون وللنيتروجين أيضًا.
نربط الهيدروجين بالإلكترون المنفرد الأخير لذرّة الكربون، ونحصل على:
![]() الآن، حول الكربون والنيتروجين توجد 8 إلكترونات، بينما حول الهيدروجين يوجد إلكترونان.
الآن، حول الكربون والنيتروجين توجد 8 إلكترونات، بينما حول الهيدروجين يوجد إلكترونان.
كلّ الذرّات مليئة بحسب قاعدة الاوكتيت، التي تنصّ على أنّ مستوى الطاقة الأخير مليء.
نمعن النظر في قائمة العناصر الدوريّة ونلاحظ أنّ:
الكربون يقع في العمود 4؛ تنقصه 4 إلكترونات، أيّ أنّ الكربون سيشارك 4 إلكترونات.
الأكسجين يقع في العمود 6، ينقصه إلكترونان، أيّ أنّ الأكسجين سيشارك إلكترونَيْن.
الكلور يقع في العمود 7؛ ينقصه إلكترون واحد، أيّ أنّ الكلور سيشارك إلكترونًا واحدًا.
نبدأ صيغة التمثيل الإلكترونيّ من الكربون، لأنّه الذرّة المركزيّة التي تشارك عدد الإلكترونات الأكبر.
قبل ترتيب الإلكترونات حول الكربون، نفكّر بالخطوة القادمة.
بما أنّ الأكسجين يجب أن يشارك إلكترونَيْن، وكلّ واحدة من ذرّتَي الكلور يجب أن تشارك إلكترونًا واحدًا فقط، نرتّب ذرّة الكربون من البداية على النحو التالي:
![]() نضيف الأكسجين. الأكسجين سيشارك إلكترونَيْن، فنحصل على الحالة التالية:
نضيف الأكسجين. الأكسجين سيشارك إلكترونَيْن، فنحصل على الحالة التالية:
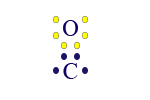
الآن، حول الأكسجين توجد 8 إلكترونات، بينما حول الكربون 6 إلكترونات. نضيف ذرّتَيّ الكلور. كلّ واحدة منهما سترتبط بالإلكترون غير المُزدوَج لذرّة الكربون.
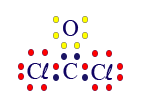 الآن، حول كلّ واحدة من الذرّات في الجُزَيء CCℓ2O توجد ثمانية إلكترونات في مستوى الطاقة الأخير.
الآن، حول كلّ واحدة من الذرّات في الجُزَيء CCℓ2O توجد ثمانية إلكترونات في مستوى الطاقة الأخير.
الكربون يشارك 4 إلكترونات، بينما الهيدروجين يشارك إلكترونًا واحدًا. بما أنّ هناك ذرّتَيّ كربون، نبدأ الربط بينهما. انتبهوا إلى أنّ كلتَيْهما ذرّتان مركزيّتان:
![]() الآن، بعد أن شاركَت كلّ واحدة من ذرّتَيّ الكربون إلكترونًا واحدًا، أصبحت حول كلّ واحدة من ذرّتَيّ الكربون 5 إلكترونات.
الآن، بعد أن شاركَت كلّ واحدة من ذرّتَيّ الكربون إلكترونًا واحدًا، أصبحت حول كلّ واحدة من ذرّتَيّ الكربون 5 إلكترونات.
بالإضافة لذرّتَيّ الكربون، توجد 6 ذرّات هيدروجين. كلّ واحدة تشارك إلكترونًا واحدًا، وبما أنّ لكلّ ذرّة كربون ما زالت هناك 3 إلكترونات إضافيّة غير مشتركة، نربط بكلّ ذرّة كربون 3 ذرّات هيدروجين. نحصل على صيغة التمثيل الإلكترونيّ التالية:
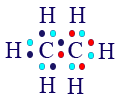 الآن، لكلّ ذرّة كربون يوجد مستوى طاقة أخير مليء، وفيه 8 إلكترونات؛ لكلّ ذرّة هيدروجين يوجد مستوى طاقة أخير مليء وفيه إلكترونان.
الآن، لكلّ ذرّة كربون يوجد مستوى طاقة أخير مليء، وفيه 8 إلكترونات؛ لكلّ ذرّة هيدروجين يوجد مستوى طاقة أخير مليء وفيه إلكترونان.
في المثال التالي، سنرى أنّ الروابط الفرديّة بين الذرّات المركزيّة لا تكون كافية أحيانًا، ويجب أن نكوِّن بينها روابط زوجيّة أو ثلاثيّة.
نبدأ مجدًّدا من ذرّات الكربون، كما في المثال السابق.
![]() وننتبه هنا أيضًا أنّ هناك 6 إلكترونات غير مُزدوَجة. لكن في هذا المثال، لدينا 4 ذرّات هيدروجين إضافيّة في الجُزَيء. إذا أضفنا ذرّات الهيدروجين الأربع، بأيّ تركيبة كانت، لن تصل إحدى ذرّتَيّ الكربون أو كلتاهما إلى مستوى طاقة أخير مليء نتيجة الارتباط. مثلًا:
وننتبه هنا أيضًا أنّ هناك 6 إلكترونات غير مُزدوَجة. لكن في هذا المثال، لدينا 4 ذرّات هيدروجين إضافيّة في الجُزَيء. إذا أضفنا ذرّات الهيدروجين الأربع، بأيّ تركيبة كانت، لن تصل إحدى ذرّتَيّ الكربون أو كلتاهما إلى مستوى طاقة أخير مليء نتيجة الارتباط. مثلًا:
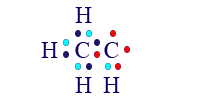 في هذه الحالة، حول ذرّة الكربون اليسرى توجد 8 إلكترونات، حول كلّ واحدة من ذرّات الهيدروجين يوجد إلكترونان، بينما حول ذرّة الكربون اليمنى توجد 6 إلكترونات.
في هذه الحالة، حول ذرّة الكربون اليسرى توجد 8 إلكترونات، حول كلّ واحدة من ذرّات الهيدروجين يوجد إلكترونان، بينما حول ذرّة الكربون اليمنى توجد 6 إلكترونات.
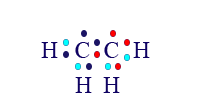
في هذا المثال، حول ذرّات الهيدروجين يوجد إلكترونان. لكن حول كلّ واحدة من ذرّتَيّ الكربون توجد 7 إلكترونات فقط. لكلّ واحدة منهما ينقص إلكترون واحد إضافيّ للوصول إلى المستوى الأخير المليء.
إذا نظرنا إلى المثال الأخير، يمكننا القول إنّه لكلّ واحدة من ذرّتَيّ الكربون ما زال هناك إلكترون واحد غير مُزدوَج، وإذا شاركتا هذا الإلكترون غير المُزدوَج مع بعضهما البعض، سنحصل على الحالة التالية:
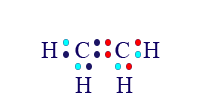
الآن، لكلّ ذرّة كربون يوجد مستوى طاقة أخير مليء، وفيه 8 إلكترونات؛ لكلّ ذرّة هيدروجين يوجد مستوى طاقة أخير مليء وفيه إلكترونان.
الآن، حاوِلوا حلّ الأمثلة التالية: C2H2 , N2H4 , N2H2 , H2O2 , HNO.
في كثير من الحالات، شكل كتابة الجُزَيء، طريقة الكتابة وصياغة الصيغة الجُزَيئيّة للمادّة، تتمّ وفقًا للطريقة التي ترتبط فيها الذرّات مع بعضها البعض. من خلال كتابة الصيغة الجُزَيئيّة، يمكن كتابة صيغة التمثيل الإلكترونيّ (مبنى لويس) للمادّة.
نستعين مرّة أخرى بقائمة العناصر الدوريّة. بحسب موقع العنصر في قائمة العناصر الدوريّة، يمكننا معرفة عدد الإلكترونات التي سيشاركها.
الكربون (C) يقع في العمود الرابع؛ لديه 4 إلكترونات في مستوى الطاقة الأخير؛ تنقصه 4 إلكترونات، لذلك سيشارك 4 إلكترونات.
النيتروجين (N) يقع في العمود الخامس؛ لديه 5 إلكترونات في مستوى الطاقة الأخير؛ تنقصه 3 إلكترونات، لذلك سيشارك 3 إلكترونات.
الأكسجين (O) يقع في العمود السادس؛ ينقصه إلكترونان لإكمال مستوى الطاقة الأخير (8 إلكترونات)، لذلك سيشارك إلكترونَيْن.
الهيدروجين (H) هو حالة شاذّة، فهو يكمل مستوى الطاقة الأخير فيه إلى إلكترونَيْن. تذكّروا أنّ لديه مستوى طاقة واحدًا فقط. الهيدروجين يشارك إلكترونًا واحدًا فقط.
نبدأ الكتابة من الكربون، وهو الذرّة المركزيّة التي تشارك عدد الإلكترونات الأكبر. بما أنّ الكربون يقع بين الأكسجين والنيتروجين، في الصيغة الجُزَيئيّة سيشارك إلكترونَيْن مع الأكسجين لأنّ الأكسجين غير مرتبط بأيّ ذرّة أخرى (يقع في أقصى اليمين من الصيغة)؛ سيشارك الكربون إلكترونَيْن إضافيَّيْن مع ذرّة النيتروجين.
النيتروجين يشارك 3 إلكترونات: إلكترونَيْن مع الكربون (كما ذكرنا سابقًا) والإلكترون الثالث مع الهيدروجين. صيغة التمثيل الإلكترونيّ ستبدو على النحو التالي:
![]()
حاوِلوا حلّ المثال التالي: HOCN
إذا أمعنّا النظر في الجُزَيء المعطى، نلاحظ من الكتابة أن ذرّة الكربون مرتبطة بثلاث ذرّات هيدروجين. بما أنّ ذرّة الكربون تكوِّن 4 روابط، الرابط الرابع سيكون مع ذرّة الأكسجين. وطبعًا، ذرّة الأكسجين التي تكوِّن رابطَيْن، ستكوِّن رابطًا إضافيًّا مع ذرّة الهيدروجين.
صيغة التمثيل الإلكترونيّ ستكون على النحو التالي:
رأينا لغاية الآن في كلّ الأمثلة أنّ الذرّات المختلفة تستوفي قاعدة الأوكتيت. نتيجة الترابُط الكيميائيّ، تصل الذرّات إلى مستوى طاقة أخير مليء، بشكل عام بـ 8 إلكترونات؛ الهيدروجين بإلكترونَيْن.
لكن لكلّ قاعدة هناك شواذّ، وطبعًا هناك حالات لا تتحقّق فيها قاعدة الأوكتيت.
بالرغم من تكوُّن روابط تساهميّة (كوفالنتيّة)، هناك حالات لا تصل فيها ذرّة أو أكثر إلى مستوى طاقة أخير مليء، أو أنّ فيه أكثر من 8 إلكترونات.
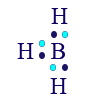
ومن الجدير أن نذكر هنا مثالًا (ولا يمكن أن نعرف مسبقًا متى يتمّ ذلك ومتى لا يتمّ) عن عنصر البورون (B).
للعنصر B توجد 3 إلكترونات تكافؤ في المستوى الأخير. عندما يشارك إلكترونات التكافؤ الثلاثة، يتكوّن مبنى جديد يكون فيه لذرّة البورون 6 إلكترونات في مستوى الطاقة الأخير، وليس 8 كما من المتوقّع أن يحدُث.
نذكّر مرّة أخرى أنّه لا حاجة لأن نتذكّر عن ظهر قلب الحالات التي لا تتحقّق فيها قاعدة الأوكتيت، لكن من المفضّل أن نتذكّر البورون (B) كحالة شاذّة.
ملاحظة إضافيّة: تحدّثنا في هذا الدرس عن المواد المسمّاة موادّ جُزَيئيّة فقط، أيّ المواد المكوّنة من جُزَيئات، حيثأنّ كلّ جُزَيء مكوّن من ذرّات لافلزّات وبينها روابط تساهميّة (كوفالنتيّة). سندخل في التفاصيل لاحقًا.
يمكن أيضًا كتابة صيغة التمثيل الإلكترونيّ للجُسَيْمات التي ليست جُزَيئات. رأينا في هذا الدرس أنّه يمكن كتابة صيغة التمثيل الإلكترونيّ للذرّات أيضًا. وكما سنرى في الدرس الذي يتحدّث عن الأيونات، يمكن كتابة صيغة التمثيل الإلكترونيّ للأيونات أيضًا. سنتعلّم كيفيّة كتابة صيغة التمثيل الإلكترونيّ للأيونات أحاديّة الذرّة فقط، لأنّها هي المطلوبة فقط في المنهاج التعليميّ. الأيونات أحاديّة الذرّة هي أيونات مكوّنة من ذرّة واحدة. سنرى أيضًا تمثيلات للتركيبات المكوّنة من أكثر من ذرّة واحدة. سنرى أنّه بمساعدة صيغة التمثيل الإلكترونيّ، يمكننا تحديد ما إذا التركيبة متعادلة أو مشحونة بشحنة كهربائيّة، أيّ أنّها أيون، وما إذا كان الأيون موجبًا أو سالبًا.