طاقة التأيُّن
تعريف
طاقة التأيُّن هي الطاقة التي يجب بذلها لإخراج (نزع) إلكترون واحد من الذرّة أو من الأيون (ذرّة أو مجموعة ذرّات عدد/مجموع إلكتروناتها غير مساوٍ لعدد/مجموع بروتوناتها).
رمز طاقة التأيُّن هي Ei – (Energy Ionisation)
هذا التعريف لا يشمل الجزء الكمّيّ لطاقة التأيُّن. في هذه المرحلة، لا يمكننا شرحه.
لماذا يجب بذل طاقة من أجل نزع الإلكترون؟
الشرح بسيط. الإلكترون مشحون بشحنة سالبة وينجذب إلى الشحنة الموجبة للبروتونات الموجودة في نواة الذرّة. يوجد تجاذُب كهربائيّ بين الإلكترون والبروتونات. للفصل بينهما، يجب التغلّب على التجاذُب الكهربائيّ. وذلك بواسطة بذل طاقة.
علينا أن نفهم بماذا يتعلّق التجاذُب/التنافُر الكهربائيّ بين شحنتَين متشابهتَين أو متعاكستَين.
يمكن إيجاد الإجابة عن ذلك في قانون كولوم، الذي يصف التجاذُب/التنافُر الكهربائيّ على النحو التالي:
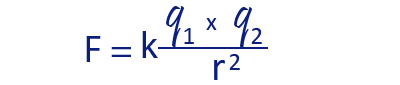
سنتطرّق الآن إلى التجاذُب فقط، وليس التنافُر.
F
قوة التجاذُب الكهربائيّ: تشير إلى قوّة التجاذُب التي تعمل بين الشحنات الكهربائيّة.
k
ثابت كولوم: عدد ثابت. لن نتطرّق إليه الآن. (كما يشبه القيمة π، وهي قيمة ثابتة في قانون حساب محيط الدائرة. وقيمتها 3.14).
q1 و –q2
مقدار الشحنات الكهربائيّة.
r
البُعد بين الشحنات الكهربائيّة.
القانون هو كالتالي:
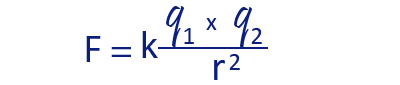
نلاحظ من هذه المعادلة أنّ قوّة التجاذُب تتناسب تناسبًا طرديًّا مع مقدار الشحنات الكهربائيّة (البسط).
ونلاحظ من المعادلة أيضًا أنّ قوّة التجاذُب تتناسب تناسبًا عكسيًّا مع البُعد بين الشحنات الكهربائيّة (المقام).
مصطلح التناسب الطرديّ مأخوذ من المقارنة بين المقادير. عندما نقارن بين مقدارَين يؤثّران على بعضهما البعض، إذا كبُر الأوّل وكبُر الثاني معه (والعكس أيضًا، أيّ إذا كبُر الثاني وكبُر الأوّل معه)، فهذا تناسب طرديّ.
لكن، إذا كبُر الأوّل وصغُر الثاني، أو العكس (أيّ كبُر الثاني وصغُر الأوّل)، فهذا تناسب عكسيّ.
من السهل فهم ذلك في المعادلة التي تصف قوّة التجاذُب الكهربائيّ، F.
كلّما كانت q1 وَ- q2 أكبر، يكون البسط في المعادلة أكبر، لذلك فإنّ ناتج القسمة F (القوّة) سيكون أكبر (أقوى).
والعكس صحيح، كلّما كانت q1 وَ- q2 أصغر، يكون البسط في المعادلة أصغر، وبالتالي فإنّ ناتج القسمة F (القوّة) سيكون أصغر (أضعف). هذا تناسُب طرديّ.
كلّما كان r أكبر، يكون المقام في المعادلة أكبر، لذلك فإنّ ناتج القسمة F (القوّة) سيكون أصغر (أضعف).
والعكس صحيح، كلّما كان r أصغر، يكون المقام في المعادلة أصغر، وبالتالي فإنّ ناتج القسمة F (القوّة) سيكون أكبر (أقوى). هذا تناسُب عكسيّ.
نعود الآن لطاقة التأيُّن، لنرى العلاقة بين قوّة التجاذُب الكهربائيّ وبين طاقة التأيُّن.
عرّفنا طاقة التأيُّن على أنّها الطاقة التي يجب بذلها من أجل نزع (إخراج) إلكترون من ذرّة أو من أيون.
لنزع الإلكترون، يجب التغلّب على قوّة التجاذُب الكهربائيّ بين الإلكترون السالب والنواة الموجبة.
يمكن القول إنّه كلّما كانت قوّة التجاذُب الكهربائيّ (F) بين الإلكترون الذي نريد نزعه وبين النواة أكبر، علينا بذل طاقة أكبر من أجل نزع الإلكترون (لكي نتغلّب على قوة التجاذُب بين الإلكترون والنواة).
والعكس صحيح، كلّما كانت قوّة التجاذُب (F) أصغر، سنحتاج إلى طاقة أقلّ.
نستنتج من هنا أنّ كمّيّة الطاقة مرتبطة بقوّة التجاذُب، وقوّة التجاذُب مرتبطة بعاملَين: البُعد بين الشحنات ومقدار الشحنات.
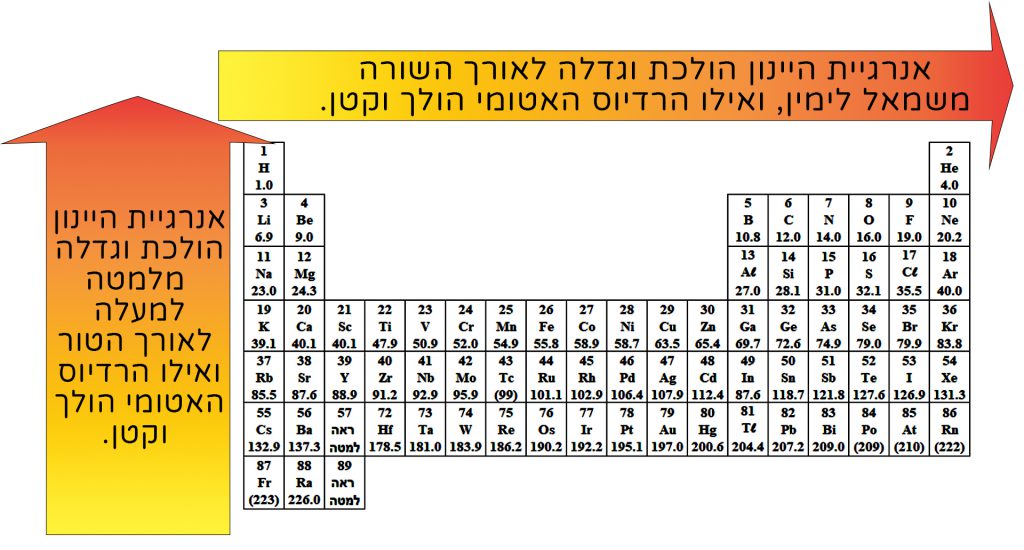
فيما يلي مخطّط يبيِّن العوامل التي تؤثّر على طاقة التأيُّن:
أمثلة
حدِّدوا لِمَن توجد طاقة تأيُّن أكبر: لـ Na (الصوديوم) أو لـ K (البوتاسيوم)؟
للقيام بذلك، علينا أن نحدّد أين تكون قوّة التجاذُب الكهربائيّ بين الإلكترون والنواة أقوى.
تجدر الإشارة هنا إلى أنّنا ننزع الإلكترون المتواجد في مستوى الطاقة الأبعد عن النواة، أيّ المستوى الخارجيّ. هذا الإلكترون يُسمّى إلكترون التكافؤ. وهو الأسهل للنزع كما ذكرنا سابقًا. إلكترون التكافؤ يتواجد في مستوى الطاقة الأبعد عن النواة. كلّما كان البُعد بين الإلكترون (ذي الشحنة السالبة) والنواة (ذات الشحنة الموجبة) أكبر، تكون قوّة التجاذُب الكهربائيّ بينهما أضعف، ومن السهل الفصل بينهما.
لكي نُحدِّد لأيٍّ من الذرّات توجد طاقة تأيُّن أكبر، يجب كتابة ترتيب الإلكترونات أو الإمعان بقائمة العناصر الدوريّة. سنرى طريقتَين لذلك.
ترتيب الإلكترونات في الذرّات
لذرّة الصوديوم 11 إلكترونًا. لذلك، ترتيب إلكتروناتها سيكون على النحو التالي:
Na )2e‾ )8e‾ )1e‾
لذرّة البوتاسيوم 19 إلكترونًا. لذلك، ترتيب إلكتروناتها سيكون على النحو التالي:
K )2e‾ )8e‾ )8e‾ )1e‾
العامل الأوّل الذي سنفحصه هو البُعد. البُعد هو العامل الأكثر تأثيرًا.
نلاحظ أنّ لذرّة البوتاسيوم 4 مستويات طاقة معبّأة، بينما لذرّة الصوديوم 3 مستويات طاقة معبّأة. هذا يعني أنّ الإلكترون الذي نريد نزعه/فصله في ذرّة البوتاسيوم، هو الإلكترون المتواجد في مستوى الطاقة الرابع. بينما في ذرّة الصوديوم، الإلكترون الذي نريد نزعه متواجد في مستوى الطاقة الثالث.
بُعد الإلكترون الذي نريد نزعه عن النواة في ذرّة الصوديوم، أصغر.
ينصّ قانون كولوم على أنّه كلّما كان البُعد بين الشحنات الكهربائيّة أصغر، تكون قوّة التجاذُب الكهربائيّ بينها أكبر. لذلك، طاقة التأيُّن (Ei)، الطاقة التي يجب بذلها لإخراج الإلكترون من الذرّة، في ذرّة الصوديوم أكبر.
Ei (Na) > Ei (K)
قائمة العناصر الدوريّة
يمكن التوصّل إلى الاستنتاج بأنّ للصوديوم والبوتاسيوم عدد مستويات الطاقة مختلفًا، والاستنتاج بأنّ ذرّة البوتاسيوم أكبر، من قائمة العناصر الدوريّة، بدون كتابة ترتيب الإلكترونات للذرّتَين.
ملاحظة: من المفضّل قراءة هذا الشرح بعد قراءة درس قائمة العناصر الدوريّة الموجود في هذا الفصل، مبنى الذرّة، من أجل فهم المصطلحات مثل العمود، الدورة والسطر في القائمة الدوريّة.
من خلال التمعُّن في القائمة الدوريّة، نلاحظ أنّ:
البوتاسيوم موجود في الدورة (السطر) الرابع. هذا يعني أنّ لديه 4 مستويات طاقة معبّأة (كما رأينا في درس قائمة العناصر الدوريّة).
الصوديوم موجود في الدورة الثالثة. هذا يعني أنّ لديه 3 مستويات طاقة معبّأة.
لذلك، يمكن أن نحدّد أن بُعد إلكترون التكافؤ عن النواة في ذرّة الصوديوم أصغر، بالمقارنة مع بُعد إلكترون التكافؤ عن النواة في ذرّة البوتاسيوم. من هنا، طاقة التأيُّن (Ei) لذرّة الصوديوم أكبر. وما السبب؟
ينصّ قانون كولوم على أنّه كلّما كان البُعد بين الشحنات الكهربائيّة أصغر، تكون قوّة التجاذُب الكهربائيّ بينها أكبر. لذلك من الأصعب الفصل بينهما. هذا يعني أنّ طاقة التأيُّن – الطاقة التي يجب بذلها لفصل الإلكترون عن الذرّة – لذرّة الصوديوم أكبر.
Ei (Na) > Ei (K)
حدِّدوا لِمَن توجد طاقة تأيُّن أكبر: لـ Na (الصوديوم) أو لـ Mg (المغنيسيوم)؟
لذرّة الصوديوم 11 إلكترونًا. لذلك، ترتيب إلكتروناتها سيكون على النحو التالي:
Na )2e‾ )8e‾ )1e‾
لذرّة المغنيسيوم 12 إلكترونًا. لذلك، ترتيب إلكتروناتها سيكون على النحو التالي:
Mg )2e‾ )8e‾ )2e‾
العامل الأوّل الذي سنفحصه هو البُعد، أو عدد مستويات الطاقة المعبّأة. كما ذكرنا، البُعد هو العامل الأكثر تأثيرًا.
نلاحظ أنّ لذرّة المغنيسيوم ولذرّة الصوديوم أيضًا ثلاثة مستويات طاقة معبّأة. بناءً على ذلك فقط، لا يمكن التحديد في أيٍّ من الذرّتَين (الصوديوم أو المغنيسيوم) بُعد الإلكترون الذي نريد إخراجه من النواة أكبر. من أجل تقدير كمّيّة طاقة التأيُّن في ذرّتَين لهما نفس عدد مستويات الطاقة، نفحص العامل الثاني الذي يؤثّر على قوّة التجاذُب الكهربائيّ.
العامل الثاني الذي يؤثّر على قوّة التجاذُب الكهربائيّ هو مقدار الشحنات الكهربائيّة. فيما يتعلّق بطاقة التأيُّن، مقدار الشحنات الكهربائيّة مساوٍ لعدد البروتونات في النواة، بينما نريد إخراج إلكترون واحد فقط.
كلّما كان عدد البروتونات أكبر، فإنّ قوّة التجاذُب الكهربائيّ بين البروتونات الموجودة في النواة وبين الإلكترون الذي نريد إخراجه أقوى، بحسب قانون كولوم. لذلك سيكون من الأصعب إخراج الإلكترون.
لذرّة المغنيسيوم يوجد بروتونات أكثر في النواة. ينصّ قانون كولوم على أنّه كلّما كانت الشحنات الكهربائيّة أكبر، تكون قوّة التجاذُب بينها أقوى. هذا يعني أنّ طاقة التأيُّن لذرّة المغنيسيوم أكبر من طاقة التأيُّن لذرّة الصوديوم.
Ei (Na) < Ei (Mg)
يمكن التوصّل إلى الاستنتاج بأنّ للعنصرَين، الصوديوم والمغنيسيوم، عدد مستويات إلكترونات متساويًا، من قائمة العناصر الدوريّة، بدون كتابة ترتيب الإلكترونات للذرّتَين.
ملاحظة: هنا أيضًا، من المفضّل قراءة هذا الشرح بعد قراءة درس قائمة العناصر الدوريّة الموجود في هذا الفصل، مبنى الذرّة، من أجل فهم المصطلحات مثل العمود، الدورة والسطر في القائمة الدوريّة.
من خلال التمعُّن في القائمة الدوريّة، نلاحظ أنّ الصوديوم والمغنيسيوم موجودان في الدورة (السطر) الثالث. وبما أنّ البُعد بين الإلكترون الذي نريد إخراجه من النواة غير متساوٍ في كلتيهما، سنستعين بالعامل الثاني من أجل تقدير كمّيّة طاقة التأيُّن.
العامل الثاني الذي يؤثّر هو مقدار الشحنات الكهربائيّة (فيما يتعلّق بطاقة التأيُّن، مقدار الشحنات الكهربائيّة مساوٍ لعدد البروتونات في النواة، بينما نريد إخراج إلكترون واحد). ينصّ قانون كولوم على أنّه كلّما كانت الشحنة الكهربائيّة (عدد البروتونات) أكبر، فإنّ قوّة التجاذُب الكهربائيّ تكون أكبر، لذلك سيكون من الأصعب الفصل بين الإلكترون والبروتونات. لذلك، طاقة التأيُّن (Ei) لذرّة المغنيسيوم أكبر.
Ei (Na) < Ei (Mg)
من المتّبع قياس طاقة التأيُّن بوحدات طاقة، ومن بينها كيلو جاول/مول (kJ/mol).
ذكرنا أيضًا مقدارًا آخر وهو البُعد بين الشحنات الكهربائيّة، وفيما ستعلّق بالذرّة، المقصد هو نصف قُطر الذرّة.
نصف قُطر الذرّة هو البُعد بين نواة الذرّة ومستوى الطاقة الأخير المعبّأ بالإلكترونات.
يمكننا المقارنة بين أنصاف أقطار الذرّات على امتداد عمود أو في سطر في قائمة العناصر الدوريّة.
على امتداد العمود، من الأعلى إلى الأسفل، يكبر نصف قُطر الذرّة، وكلّما نزلنا للأسفل في العمود يصبح للذرّة عدد أكبر من مستويات الطاقة المعبّأة بالإلكترونات، لذلك يكبر نصف قُطر الذرّة. والعكس صحيح للأعلى.
وعلى امتداد السطر، يوجد للذرّات نفس عدد مستويات الطاقة المعبّأة بالإلكترونات. لكن عدد البروتونات يكبر على امتداد السطر، من اليسار إلى اليمين. لذلك، قوّة التجاذُب الكهربائيّ بين النواة والإلكترونات تكون أقوى، ونصف قُطر الذرّة يصبح أصغر، وبالعكس.
يقاس نصف قُطر الذرّة بوحدات طول، مثلًا: أنغستروم.
يمكن دمج تصرُّف طاقة التأيُّن ونصف قُطر الذرّة في قائمة العناصر الدوريّة على النحو التالي: