حالات المادّة
للمادّة ثلاث حالات أساسيّة: صلبة، سائلة وغازيّة. في إطار البرنامج الدراسيّ، سنتطرّق إلى هذه الحالات.
بالرغم من ذلك، تجدر الإشارة إلى أنّ هناك حالات إضافيّة للمادّة، مثل البلازما. هناك أيضًا حالات (فازات) إضافيّة مثل المحاليل على أنواعها.
تعريف حالات المادّة الأساسيّة الثلاث: الصلبة، السائلة والغازيّة، ليس مُطلقًا. هناك مواد مختلفة مُدرَجة ضمن هذا التعريف الأساسيّ، وهناك مواد غير مُدرجَة فيه.
مثال: الزجاج، الذي يبدو صلبًا. بيَّنَ فحص علميّ أجريَ على الزجاج أنه لا يتلاءم بشكل مُطلق مع تعريف المادّة الصلبة (سنشرح السبب في الفصول المتقدّمة).
في هذا الفصل، سنتطرّق إلى المادّة الصلبة البلّوريّة.
كما ذكرنا، للمادّة ثلاث حالات أساسيّة: صلبة، سائلة وغازيّة.
نلخّص مميّزات حالات المادّة المختلفة في الجدول التالي:
| الميزة / حالة المادّة | صلبة | سائلة | غازيّة |
| حركة مرئيّة للعين على المستوى الماكروسكوبيّ | لا يوجد | يوجد | يوجد (إذا كان الغاز ملوّنًا) |
| كثافة الجُسَيمات | عالية | متوسّطة | منخفضة |
| الترتيب والدوريّة | عالية | متوسّطة | لا يوجد |
| الحركة الميكروسكوبيّة | تذبذُب | تذبذُب ودوران | تذبذُب، دوران وإزاحة |
| القوى بين الجُسَيمات | قويّة | ضعيفة | لا توجد (غاز مثاليّ) |
| الطاقة (للمادّة نفسها) | منخفضة | متوسّطة | عالية |
في المادّة الصلبة البلّوريّة، الجُسَيمات المرتبة في مبنًى ذي ترتيب ودوريّة عالية، تكون جُسَيمات المادّة كثيفة ويكون بينها تجاذُب؛ تتحرّك الجُسَيمات بحركة غير محسوسة وغير مرئيّة للعين، وتسمّى حركة ذبذبة. وهي حركة اهتزازيّة.
في الحالة السائلة، البُعد بين جُسَيمات المادّة أكبر بالمقارنة مع المادّة الصلبة؛ التجاذُب بين جُسَيمات المادّة أضعف، ممّا يتيح المجال لحركة الجُسَيمات بشكل أكبر. جُسَيمات المادّة “تحتكّ” ببعضها البعض وتتحرّك بحركة دورانيّة، بالإضافة إلى حركة ذبذبة. تأخذ اليمكن أن تتحوّل المادّة من حالة إلى أخرى من خلال إضافة طاقة من البيئة المحيطة إلى المادّة، أو من خلال إطلاق طاقة من المادّة إلى البيئة المحيطة القريبة منها.
شكل حرّ في الفراغ الذي تتواجد فيه. هذه الحركة تسمّى إزاحة، أو من الحالة السائلة إلى الحالة الغازيّة، يجب بذل طاقة. الطاقة مطلوبة لتفكيك الروابط بين جُسَيمات المادّة.
عندما تتحوّل المادّة من الحالة الغازيّة إلى الحالة السائلة، أو من الحالة السائلة إلى الحالة الصلبة، يتمّ إطلاق طاقة، وذلك بسبب تكوُّن روابط بين جُسَيمات المادّة.
لكلّ واحد من تحوُّلات المادة يوجد اسم ودرجة حرارة تميّزه.
عملية الانصهار (أو الصهر) هي تحوُّل المادّة من الحالة الصلبة إلى الحالة السائلة.
تتمّ صياغة العمليّة التي تصف تحوُّل المادّة A من الحالة الصلبة إلى الحالة السائلة على النحو التالي:
A(s) → A(ℓ)
لعمليّة الانصهار درجة انصهار خاصة. لكلّ مادّة توجد درجة انصهار خاصّة في الضغط الجوّيّ. درجة الحرارة هذه متعلّقة بقوّة الروابط بين جُسَيمات المادّة.
عملية الغليان هي تحوُّل المادّة من الحالة السائلة إلى الحالة الغازيّة.
تتمّ صياغة العمليّة التي تصف تحوُّل المادّة A من الحالة السائلة إلى الحالة الغازيّة على النحو التالي:
A(ℓ) → A(g)
لعمليّة الغليان درجة غليان خاصّة. لكلّ مادّة توجد درجة غليان خاصّة في الضغط الجوّيّ. درجة الحرارة هذه متعلّقة بقوّة الروابط بين جُسَيمات المادّة.
درجة الانصهار – Tm.
درجة الغليان – Tb.
تجدر الإشارة إلى أنّه قد تحدُث أيضًا عمليّات عكسيّة للعمليّات المذكورة أعلاه.
عمليّة التكثيف التي يتحوّل فيها الغاز إلى سائل
A(g) → A(ℓ)
تحدُث عمليّة التكثيف بنفس درجة الحرارة التي تحدُث فيها عمليّة الغليان.
عمليّة التجمُّد (التصلُّب)
A(ℓ) → A(s)
تحدُث هذه العمليّة بنفس درجة الحرارة التي تحدُث فيها عمليّة الانصهار.
لو تمكّنّا من الحفاظ على درجة حرارة ثابتة 0°C في وعاء يحتوي على ماء الثلج (وهو ماء وصلب أيضًا)، فسيتمّ الحفاظ على حالة المادّة السائلة والثلج (الماء في الحالة الصلبة) طالما تمّ الحفاظ على درجة الحرارة. لو برّدنا ماء الثلج، سيتجمّد الماء. لو سخّنّا ماء الثلج، سينصهر الثلج ويتحوّل إلى سائل.
هناك مواد تتحوّل من الحالة الصلبة إلى الحالة الغازيّة مباشرةً. هذه العمليّة تسمّى التسامي، وتتمّ صياغتها على النحو التالي:
A(s) → A(g)
أمثلة على مواد تمرّ بعمليّة التسامي: اليود وثاني أكسيد الكربون الصلب، المعروف بـ “الثلج الجاف”.
بواسطة المعطيات عن درجة انصهار ودرجة غليان المادّة، يمكن أن نُحدّد حالتها في درجات حرارة مختلفة.
على سبيل المثال، إذا كانت معطاة لنا المادّة X ومعلوم لنا أنّ درجة انصهارها (Tm) هي 28°C ودرجة غليانها هي 75°C، يمكننا أن نحدّد حالتها في درجة حرارة 32°C.
كيف يمكننا أن نحدّد حالة المادّة X في درجة حرارة 32°C بمساعدة المعطيات المعلومة لنا عنها؟
نرسم رسمًا بيانيًّا يظهر عليه محور درجة الحرارة. نشير أوّلًا إلى درجة انصهار ودرجة غليان المادّة.
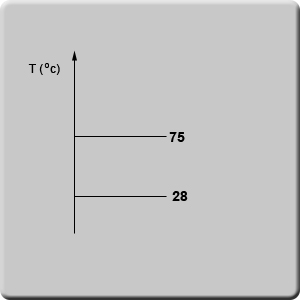
نضيف إلى الرسم البيانيّ درجة الحرارة التي نريد أن نفحص فيها حالة المادّة (الخطّ الأحمر).
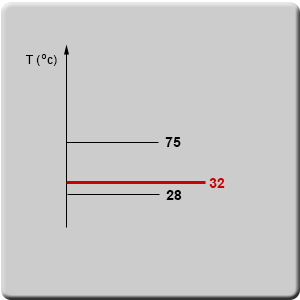
حالة المادّة X في درجة حرارة 32°C هي سائلة، لأنّ درجة حرارة الفحص فوق درجة الانصهار، لكنها تحت درجة الغليان.
نصف تغيُّرات درجة الحرارة التي تطرأ على مادّة معيّنة في الحالة الصلبة عند إضافة طاقة (تسخين)، في الرسم البيانيّ التالي:
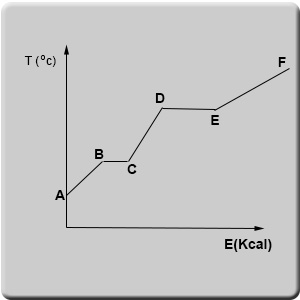
يمكن أن نلاحظ في الرسم البيانيّ أنّ هناك مقاطع والتي فيها تؤدّي إضافة طاقة (على شكل حرارة) للمادّة إلى رفع درجة حرارتها (AB، CD، EF). بالمقابل، في مقطع أخرى، إضافة طاقة لا تُحدِث أيّ تغيير في درجة حرارة المادّة (BC، DE).
كيف يمكن تفسير نتائج القياس (أيّ، الرسم البياني الذي حصلنا عليه)؟
أوّلًا، يجب علينا أن نعرف المصطلحَين “المستوى الماكروسكوبيّ” و”المستوى الميكروسكوبيّ”.
المستوى الماكروسكوبيّ يتطرّق إلى الأشياء التي نراها، نشعر بها أو نقيسها. في هذه الحالة، نقيس التغيُّر في درجة الحرارة نتيجة إضافة طاقة للمادّة.
بينما المستوى الميكروسكوبيّ يتطرّق إلى جُسَيمات المادّة ولِما يحدُث بين جُسَيمات المادّة (أيّ الروابط بين جُسَيمات المادّة ونوع الروابط)، قبل إضافة الطاقة وبعد إضافة الطاقة. نحن لا نرى ما يحدُث، لكن يمكننا تفسيره. في الفصول القادمة، سنتعلّم أنه عندما نتحدّث عن المستوى الميكروسكوبيّ للمادّة، يجب أن نتطرّق إلى الجُسَيمات التي تُكوِِّن المادّة، للروابط بينها ولأنواع حركتها. في هذه المرحلة، بما أنّنا لم نتعلّم عن أنواع الجُسَيمات المختلفة التي تُكوِِّن المادّة وعن الروابط بينها، لن نتطرّق لهذه المصطلحات لكن سنتطرّق إلى طريقة حركة المادّة في حالاتها المختلفة على المستوى الميكروسكوبيّ.
نعود إلى الرسم البيانيّ:
في النقطة A المادّة المعطاة كانت في الحالة الصلبة. بدأنا بتسخين المادّة. إضافة الطاقة تزيد معدّل سرعة حركة جُسَيمات المادّة. حركة جُسَيمات المادّة بشكل أسرع تنعكس في ارتفاع درجة الحرارة. تستمرّ الجُسَيمات في الحركة حتى النقطة B على الرسم البيانيّ.
من النقطة B وحتى النقطة C، إضافة الطاقة لا تؤدّي إلى ارتفاع درجة الحرارة. ماذا يحدُث لهذه الطاقة؟ هل تضيع؟ على مدار السنوات، لم يعرف العلماء معنى المقطع BC، فسُمِّيَ “الطاقة الكامنة”. لم ينجح العلماء في تفسير وإنساب هذه الطاقة للتغيُّرات التي طرأت على المادّة. من المعروف اليوم أنّ الطاقة التي تضاف للمادّة في المقطع BC تؤدّي إلى تفكيك جزء من الروابط بين جُسَيمات المادّة. نتيجةً لذلك، تنخفض كثافة المادّة وتتغيّر حالتها. هذا يحدث على امتداد كل المقطع BC. طالما أن كلّ المادّة لم تُغيّر حالتها، لن يكون هناك تغيير في درجة حرارة المادّة. فقط عندما تُغيّر كلّ المادّة حالتها، يطرأ ارتفاع على درجة حرارة المادّة. هذا الارتفاع في درجة الحرارة يعني أن هناك ارتفاع قد طرأ مجدّدًا على مُعدّل سرعة جُسَيمات المادّة.
تداد المقطع CD الظاهر في الرسم البيانيّ، طرأ ارتفاع على درجة الحرارة حتى النقطة D التي يطرأ فيها تغيير مرّة أخرى على حالة المادّة وتتحوّل إلى غازيّة. من هناك، إضافة الطاقة تزيد مجدّدًا من معدّل سرعة جُسَيمات المادّة، ويطرأ ارتفاع على درجة حرارتها. فيما بعد، تحدُث عمليّات أخرى، وسنتطرّق إليها لاحقًا في تعلّم الكيمياء.
قياس درجة الحرارة
نقيس درجة الحرارة بواسطة ميزان حرارة.
هناك عدّة مقاييس لقياس درجة الحرارة. سنذكر منها ثلاثة مقاييس، لكنّنا سنتعامل مع واحد فقط.
مقاييس درجة الحرارة الثلاثة المتّبعة هي:
مقياس سلزيوس (C)
مقياس كلفن (K)
مقياس فهرنهايت (F)
مقياس سلزيوس هو مقياس درجة حرارة، حيث أنّ القيمة 0°C ي درجة انصهار الماء، والقيمة 100°C
هي درجة غليان الماء. المقياس مقسّم بشكل متساوٍ بين هاتَين النقطتَين، حيث أنّ كلّ علامة قياس تُسمّى درجة واحدة.
مقياس كلفن هو مقياس مشابه لمقياس سلزيوس، مع إزاحة لنقطة الصفر. في هذا المقياس، لا توجد قيَم سالبة، وأصغر قيمة تُسمّى أيضًا الصفر المُطلق. هذا مقدار درجة الحرارة الأصغر الذي يمكن الوصول إليه نظريًا، ولا يمكن اجتيازه.
العلاقة بين القيمة على مقياس سلزيوس والقيمة على مقياس كلفن، هي على النحو التالي:
°C = K-273.15
K = °C + 273.15
المقياس الثالث هو مقياس فهرنهايت. المقياس يعتمد على نقطة انصهار خليط من الثلج والملح، ومعدّل درجة حرارة جسم الإنسان السليم. في تعلّم الكيمياء، لن نتعامل مع هذا المقياس. الانتقال بين مقياس سلزيوس ومقياس فهرنهايت، يتمّ على النحو التالي:
°C = [ 5(°F-32)] : 9
